近年来, 在围生期围生儿脑损伤及早产儿抢救治疗中, 生存率明显提高, 但小儿神经发育缺陷的发生率却显著增加。新生儿中枢神经损伤的原因众多, 其中高浓度氧疗所致的脑损伤发生率, 逐年增加, 成为降低新生儿生存率的重要因素之一, 越来越受到重视。研究证实, 大脑发育成熟过程中, 长时间接触高浓度氧环境, 可能使神经运动功能受到损害, 远期认知功能也会产生一定的缺陷[1-2]。在高浓度氧疗的同时, 其他组织器官也可能受到高氧性损伤, 尤其在新生儿阶段, 各系统发育尚不完善, 其中, 肺和脑是最易损伤的脏器[3]。研究发现, 新生大鼠在高氧诱导后, 会启动内质网应激(ERS), 通过IRE-1、PERK和ATF6三个经典通路迅速活化, 诱导并激活CHOP, 引起细胞凋亡。与细胞凋亡密切相关的糖调节蛋白78(glucose-regulated protein 78, GRP78)表达明显升高, 大脑皮层细胞凋亡加剧, 且凋亡程度与处在高氧环境中时间呈正相关[4]。前列腺素E1(prostaglandin E1, PGE-1)作用广泛, 能降低炎症细胞活性, 提高超氧化物歧化酶等相关酶的活性, 减少对脑血管内皮的损伤, 进而避免因氧浓度不适产生的脑血管可逆性损伤; 一定程度减少氧自由基的产生和蛋白水解酶的释放, 从而降低脑血管通透性, 稳定溶酶体膜, 减轻脑水肿症状, 更有利于新生儿神经系统发育。长期高浓度氧疗可导致新生儿中枢神经系统损伤, 产生慢性进行性认知功能障碍, 是多种因素参与的复杂病理过程, 发病机制未明[5]。热休克蛋白家族(HSP)是内质网上重要的分子伴侣, 在细胞凋亡过程中扮演重要角色, GRP78与新生儿神经系统疾病如新生儿缺氧缺血性脑病(HIE)、癫癎等的发病有关, 发病期间脑组织活检分析显示, 在许多存活的神经元中, GRP78蛋白表达上调[6]。CHOP是一个ERS转录因子, 具有特异性, 在正常情况下低水平广泛表达于各种细胞, 而在ERS中, 表达大大增加, 诱导神经元凋亡[7]。本研究通过观察应用PGE-1对高氧脑损伤新生大鼠脑组织中GRP78、CHOP蛋白含量的影响, 说明PGE-1对高氧诱导脑损伤的保护作用的可能机制。
1 材料与方法 1.1 实验动物及试剂健康Wistar新生大鼠60只, 体重6~10 g, 由延边大学动物科提供, 动物许可证号:SYXK(吉)(2007-0011), 前列腺素E1(PGE-1)(北京泰德制药股份有限公司), CHOP抗体、GRP78抗体(Santa Cruz公司), SDS-PAGE凝胶电泳试剂盒(Solarbi公司), TUNEL细胞凋亡原位检测试剂盒(南京碧波生物科技有限公司), Diff-Quik染色液及试剂盒(北京博普斯生物技术有限公司)。
1.2 高氧脑损伤模型的制备采用高浓度氧诱导法制备高氧脑损伤模型[8]:60只新生Wistar大鼠随机分成空气对照组、高氧脑损伤模型组和高氧脑损伤+PGE-1组, 雌雄不限, 每组20只。空气对照组置于常温常压空气环境, 高氧脑损伤模型组、高氧脑损伤+PGE-1组与哺乳母鼠共置于自制高氧箱中, 持续通入100%医用氧气(2 L/min), 并用数字测氧仪持续监测氧箱内氧及CO2浓度, 氧浓度85%以上, CO2浓度≤5%, 箱内放置生石灰粉末吸收水蒸气和多余的CO2, 连续7 d。玻璃箱与室内温度维持在24~26℃, 湿度维持在60%~70%。空气与高氧环境下隔日互换雌鼠, 避免哺乳母鼠因氧中毒产生应激反应, 导致喂养能力下降及咬伤新生大鼠。高氧脑损伤+PGE-1组自造模第1天起, 每只新生大鼠每日腹腔注射PGE-1 2 μg/kg, 连续7 d。空气对照组及模型组等剂量注射生理盐水。
1.3 一般状态记录日常实验中记录新生大鼠的生存率和一般状态反应指标, 包括体重、皮肤颜色、觅食能力、消化能力及死亡率等表现。
1.4 标本采集制备模型第7天, 各组进行下列操作:新生7 d大鼠乙醚蒸气吸入麻醉后, 固定在动物手术台, 剪下头部, 剥开颅骨, 充分暴露脑组织并取出, 取左侧脑组织用于含水量测定; 右侧部分脑组织置于10%甲醛溶液中固定24 h, 制作石蜡包埋切片用于苏木精-伊红(HE)染色(n=2)及细胞凋亡检测(n=8);右侧剩余脑组织置于-80℃冰箱内保存, 用于检测脑组织中GRP78、CHOP蛋白表达水平(n=10)。
1.5 脑组织含水量测定采集标本时立即选用取出的左侧脑组织, 用医用棉清洁脑组织表面及周围, 及时称量, 记录为脑组织湿重。同一标本置于80℃烤箱内烤干水分, 每日计量, 若连续2 d称重重量不再减轻且为同一数值, 即为脑组织干重并记录。利用Elliot公式= [(湿重-干重)/湿重]×100%, 计算脑组织含水量。标本置于37℃烤箱内保存。
1.6 脑组织病理观察20 mL 10%甲醛固定液灌注固定脑组织(约5 min)后, 离体行外固定, 最多24 h。常规洗涤脱水、浸蜡包埋后进行石蜡切片, 厚度3~5 μm, 作HE染色, 每组各取2张病理切片。观察各组脑细胞和损伤程度。
1.7 脑组织细胞凋亡检测严格按照核染色结合TUNEL法, 预处理包埋切片的脑组织, 作核染色, 每组每个脑组织选取4张TUNEL染色切片, 置于400倍显微镜下, 每张切片选取5个不同视野, 记录每个视野的阳性细胞, 计算大脑皮层细胞凋亡指数。细胞凋亡指数以百分率表示。
1.8 Western blot法检测脑组织GRP78及CHOP蛋白预处理组织标本, 进行还原性SDS-PAGE电泳, 90 V恒流60 min, 半干式转膜(PVDF膜), 300 mA恒流40 min。封闭液封闭过夜, TBST缓冲液中充分振荡清洗, 分别滴加一、二抗(终浓度稀释比例为1:2 000 ECM显色)。X光片曝光后显影、定影、晾干。测得蛋白灰度值与β-actin条带灰度值的比值, 即对应蛋白的相对表达量。
1.9 统计学分析采用SPSS 16.0统计软件对数据进行统计学分析。计量资料以均数±标准差(x±s)表示, 多组间比较采用方差分析, 组间两两比较采用SNK-q检验, P < 0.05表示差异有统计学意义。
2 结果 2.1 一般情况持续暴露高浓度氧环境7 d后, 模型组平均体重(12.7±1.7 g)明显低于对照组(17.9±2.1 g)(P < 0.05);与对照组新生大鼠相较, 模型组新生大鼠生存率下降, 食物摄入量减少, 消化功能降低, 同时出现皮肤颜色苍白、紫绀、惊厥、行动姿势不稳等神经系统损伤表现, 这些表现与新生儿脑损伤的临床反应相似。
2.2 各组大鼠脑组织含水量测定三组新生大鼠脑组织含水量比较差异有统计学意义(F=44.67, P < 0.05)。高氧脑损伤模型组脑组织含水量(84.3%±1.5%)高于高氧脑损伤+PGE-1组(79.9%±1.4%)及空气对照组(73.6%±1.3%)(P < 0.05);高氧脑损伤+PGE-1组脑组织含水量高于空气对照组(P < 0.05)。
2.3 各组大鼠脑组织病理结果分析病理切片结果显示, 空气对照组:大脑皮层神经细胞整齐, 细胞形态规整, 极少见炎症细胞浸润及细胞水肿。高氧脑损伤模型组:脑内皮层细胞排列紊乱, 胞核偏大, 大量核固缩, 胞质淡染水肿, 小血管壁扩张充血水肿, 视野中核深染的炎症细胞浸润多, 纤维组织少量增生。高氧脑损伤+PGE-1组:脑内皮层细胞排列齐, 核质比大致正常, 脑实质周围炎症细胞明显减少, 脑水肿减轻。见图 1。
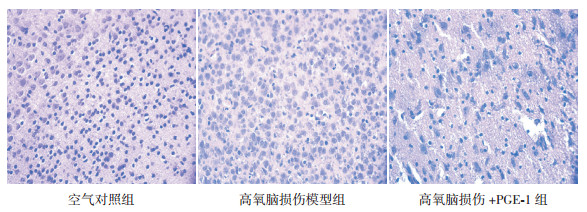
|
图 1 各组大鼠脑组织病理切片(HE染色, ×400) 空气对照组可见脑组织细胞排列整齐, 核质均匀; 高氧脑损伤模型组可见脑组织细胞排列紊乱, 大量核固缩及胞质水肿, 炎症细胞浸润多; 于高氧脑损伤模型组比较, 高氧脑损伤+PGE-1组脑组织细胞排列整齐, 核质均匀, 脑组织炎症细胞明显减少, 脑组织细胞水肿明显减轻。 |
各组新生大鼠脑组织TUNEL染色测定细胞凋亡指数比较差异有统计学意义(F=982.63, P < 0.05)。高氧脑损伤模型组脑组织细胞凋亡指数(36.4%±2.3%)高于高氧脑损伤+PGE-1组(30.9%±0.7%)及空气对照组(5.6%±0.7%)(P < 0.05);高氧脑损伤+PGE-1组脑组织细胞凋亡指数高于空气对照组(P < 0.05)。见图 2。
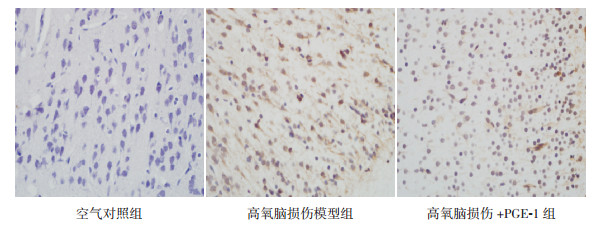
|
图 2 各组大鼠脑组织细胞凋亡情况(TUNEL染色, ×400) DAPI染色下, 空气对照组示脑组织中阳性凋亡细胞少见, 以大脑皮层上皮细胞为主, 胞核呈均质蓝色; 高氧脑损伤模型组示出现较多细胞胞核呈凝聚的亮白色, 为凋亡小体, 即阳性凋亡细胞; 高氧脑损伤+PGE-1组示凋亡小体较模型组明显减少。 |
高氧脑损伤模型组脑组织GRP78、CHOP蛋白的表达均高于高氧脑损伤+PGE-1组和空气对照组(P < 0.05);高氧脑损伤+PGE-1组脑组织GRP78、CHOP蛋白的表达高于空气对照组(P < 0.05)。见表 1, 图 3。
| 表 1 各组脑组织GRP78及CHOP蛋白检测结果比较 |
|
|
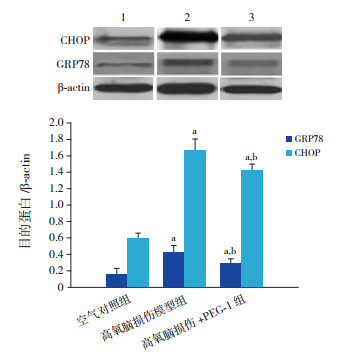
|
图 3 Western blot法检测各组脑组织GRP78及CHOP蛋白 上图为电泳条带图, 1:对照组; 2:高氧脑损伤模型组; 3:高氧脑损伤+PGE-1组。下图为统计图(n=10), a示与空气对照组比较, P < 0.05;b示与高氧脑损伤模型组比较, P < 0.05。 |
随着新生儿学近年来的迅速发展, 氧疗是新生儿及早产儿抢救治疗中最主要的治疗措施。有学者研究表明, 长期暴露在高氧环境中的新生儿易引起高氧性肺损伤、高氧性视网膜病变、HIE等疾病, 最终导致患儿病情恶化, 严重影响患儿的存活率及成年后的生活质量。尤其在极低和超低出生体重早产儿中高氧性脑损伤普遍存在, 其损伤程度更大, 病情更重。近年来, 有研究表明, 高浓度氧能影响大脑, 使大脑的重量减轻[3]。哺乳动物的脑重可反映脑组织发育情况, 高氧环境下可降低毛细血管数量, 进而减少了组织血供, 降低神经连接的密度、少突胶质细胞的活性及神经营养因子调控存活通路的活性, 一定程度上, 影响脑血液循环, 从而影响脑发育及中枢系统功能的形成, 干扰了神经营养因子的表达, 加速了神经细胞、致炎细胞因子及血管内皮细胞的凋亡过程。
研究显示, 早产儿认知和运动障碍, 与异常白质区域直接相关[9]。相对于人类大脑的发展, 啮齿类动物脑发育过程中存在发育延迟, 实验证明[10], 新生大鼠生后1 d相当于孕龄18~20周胎儿, 生后2 d相当于孕龄20~24周胎儿, 生后3 d相当于孕龄24~28周胎儿, 生后7 d相当于28~32周出生的早产儿。即生后1周新生大鼠, 相当于早产出生的新生儿。新生大鼠的脑发育与新生儿相似, Dorrell等[11]予新生3 d大鼠吸入5%氧气60 min, 持续吸入24 h, 30只动物模型中死亡14只, 存活9只并出现脑损伤, 损伤程度与早产儿脑损伤程度一致。故本实验采用新生大鼠建立高氧脑损伤动物模型, 模拟出临床上早产儿长期暴露于高氧环境中导致的脑损伤, 结果发现生后7 d高氧脑损伤模型组新生大鼠脑组织病理呈现典型的脑损伤表现, 证明本实验模型取得成功, 脑内皮层细胞较空气对照组有明显变化, 这与文献的报道相一致[12-13]。以此模型研究其损伤机制, 可为以后对早产儿高氧脑损伤的防治提供可行的理论依据。
高氧诱导下, 暴露在高氧环境中的新生儿脑细胞凋亡和细胞损伤立即发生, 最多不超过48 h。高氧引起的新生儿神经退行性疾病的炎症反应和活性氧诱导少突胶质细胞死亡, 可导致神经髓鞘形成不良和认知功能障碍相关的超微结构变化[14]。有报告显示, 在高氧早产儿脑损伤的结果为破坏轴突少突胶质细胞完整性, 在成人脑白质为传导性持续性下降[15]; 即在高浓度氧环境发育成熟的大脑, 认知功能也会产生一定的缺陷, 成人表现在脑白质, 新生儿表现在神经细胞凋亡及变性。PGE-1作为花生四烯酸衍生物, 有强烈的扩张血管及增加血管通透性的作用, 新生大鼠在高氧环境造成脑血流量不足, 进而代偿性缺氧, PGE-1使脑血流量增加, 减轻脑水肿。PGE-1有最大程度延迟及阻止细胞凋亡过程的能力, 避免脑白质进一步发生不可逆的损伤, 及时有效地预防了远期并发症的发生。GRP78蛋白即ERS系统中一种重要的伴侣蛋白, 在ERS时表达增加, 被认为可以减轻ERS。有实验研究报道在高氧诱导未折叠蛋白质反应(UPR)中, 暴露于高氧的培养细胞中GRP78蛋白大量表达, 是细胞的一种重要的防御机制, 在细胞凋亡中, 起关键的调节作用[16-17]。CHOP是一个ERS特异的转录因子, 其表达引起凋亡。有研究显示, 正常情况下, CHOP表达十分低下, ERS时, CHOP表达显著增加, 可能与在内质网中的UPR有关[18]。PGE-1在细胞程序化进程中起重要的调节作用, 与细胞表面的前列环素受体结合激活多种蛋白激酶, 促进滞留在内质网中的未折叠蛋白的合成, 抑制内质网应激反应进程[19]。本实验结果显示, 高浓度氧可引起大鼠脑组织含水量明显增加, 诱发脑水肿; 新生大鼠持续在高浓度氧环境中(氧浓度维持在85%以上)7 d后, GRP78及CHOP蛋白相对表达量特异性升高, 加速脑组织细胞凋亡进程。PGE-1治疗后, GRP78及CHOP蛋白相对表达量有所下调, 由于高氧环境下引起的脑水肿及炎症也有不同程度减轻。
综上所述, PGE-1对新生大鼠高氧诱导脑损伤具有保护作用, 其机制可能为通过ERS途径下调GRP78、CHOP蛋白表达, 从而抑制细胞凋亡。
| [1] |
陈坤, 蒋朴, 徐颖, 等. Toll样受体4在新生小鼠常压高氧脑损伤中的作用[J]. 免疫学杂志, 2012, 28(2): 98-103. (  0) 0) |
| [2] |
薛辛东, 富建华, 蔡清. 新生儿疾病研究进展[J]. 中国实用儿科杂志, 2012, 27(5): 339-342. (  0) 0) |
| [3] |
Goren B, Cakir A, Sevinc C, et al. Uridine treatment protects against neonatal brain damage and long-term cognitive deficits caused by hyperoxia[J]. Brain Res, 2017, 1676: 57-68. DOI:10.1016/j.brainres.2017.09.010 (  0) 0) |
| [4] |
关丽英, 许彩民, 潘华珍. 内质网应激介导的细胞凋亡[J]. 生物化学与生物物理进展, 2007, 34(11): 1136-1141. DOI:10.3321/j.issn:1000-3282.2007.11.003 (  0) 0) |
| [5] |
Salmaso N, Jablonska B, Scafidi J, et al. Neurobiology of premature brain injury[J]. Nat Neurosci, 2014, 17(3): 341-346. DOI:10.1038/nn.3604 (  0) 0) |
| [6] |
金梅花, 金正勇, 申英花. 阿奇霉素对新生大鼠高氧肺损伤的防治作用及其机制[J]. 山东医药, 2016, 56(31): 40-42. DOI:10.3969/j.issn.1002-266X.2016.31.012 (  0) 0) |
| [7] |
闫颖, 赵咏梅, 赵志炜, 等. 内质网应激通路相关分子GRP78及CHOP在糖尿病脑病小鼠海马表达的变化[J]. 首都医科大学学报, 2011, 32(1): 90-94. (  0) 0) |
| [8] |
宋朝敏, 王程毅, 陈涵强, 等. 新生大鼠高氧脑损伤的评价研究[J]. 中国新生儿科杂志, 2014, 29(1): 54-57. (  0) 0) |
| [9] |
Rumajogee P, Bregman T, Miller SP, et al. Rodent hypoxia-ischemia models for cerebral palsy research:A systematic review[J]. Front Neurol, 2016, 7: 57. (  0) 0) |
| [10] |
Semple BD, Blomgren K, Gimlin K, et al. Brain development in rodents and humans:Identifying benchmarks of maturation and vulnerability to injury across species[J]. Prog Neurobiol, 2013, 106-107: 1-16. DOI:10.1016/j.pneurobio.2013.04.001 (  0) 0) |
| [11] |
Dorrell MI, Otani A, Aguilar E, et al. Adult bone marrow-derived stem cells use R-cadherin to target sites of neovascularization in the developing retina[J]. Blood, 2004, 103(9): 3420-3427. DOI:10.1182/blood-2003-09-3012 (  0) 0) |
| [12] |
Kurul SH, Yiş U, Kumral A, et al. Protective effects of topiramate against hyperoxic brain injury in the developing brain[J]. Neuropediatrics, 2009, 40(1): 22-27. DOI:10.1055/s-0029-1224101 (  0) 0) |
| [13] |
Benderro GF, Sun X, Kuang Y, et al. Decreased VEGF expression and microvascular density, but increased HIF-1 and 2α accumulation and EPO expression in chronic moderate hyperoxia in the mouse brain[J]. Brain Res, 2012, 1471: 46-55. DOI:10.1016/j.brainres.2012.06.055 (  0) 0) |
| [14] |
Serdar M, Herz J, Kempe K, et al. Fingolimod protects against neonatal white matter damage and long-term cognitive deficits caused by hyperoxia[J]. Brain Behav Immun, 2016, 52: 106-119. DOI:10.1016/j.bbi.2015.10.004 (  0) 0) |
| [15] |
Ritter J, Schmitz T, Chew LJ, et al. Neonatal hyperoxia exposure disrupts axon-oligodendrocyte integrity in the subcortical white matter[J]. J Neurosci, 2013, 33(21): 8990-9002. DOI:10.1523/JNEUROSCI.5528-12.2013 (  0) 0) |
| [16] |
Chen X, Orriols M, Walther FJ, et al. Bone morphogenetic protein 9 protects against neonatal hyperoxia-induced impairment of alveolarization and pulmonary inflammation[J]. Front Physiol, 2017, 8: 486. DOI:10.3389/fphys.2017.00486 (  0) 0) |
| [17] |
Ogawa H, Kaira K, Takahashi K, et al. Prognostic role of BiP/GRP78 expression as ER stress in patients with gastric adenocarcinoma[J]. Cancer Biomark, 2017, 20(3): 273-281. DOI:10.3233/CBM-170062 (  0) 0) |
| [18] |
Jiang Q, Chen S, Ren W, et al. Escherichia coli aggravates endoplasmic reticulum stress and triggers CHOP-dependent apoptosis in weaned pigs[J]. Amino Acids, 2017, 49(12): 2073-2082. DOI:10.1007/s00726-017-2492-4 (  0) 0) |
| [19] |
Gezginci-Oktayoglu S, Orhan N, Bolkent S. Prostaglandin-E1 has a protective effect on renal ischemia/reperfusion-induced oxidative stress and inflammation mediated gastric damage in rats[J]. Int Immunopharmacol, 2016, 36: 142-150. DOI:10.1016/j.intimp.2016.04.021 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


