支气管肺发育不良(bronchopulmonary dysplasia, BPD)是早产儿尤其是极/超低出生体重儿最常见的并发症之一。BPD的发病机制尚未明确,目前认为多种因素参与其中,包括基因易感性、宫内因素(感染、缺氧或发育障碍等)和生后多重打击(机械通气、氧中毒、肺水肿、感染等)[1]。BPD对早产儿呼吸、神经等多系统会造成近期及远期不良影响,甚至危及生命,其中重度BPD患儿结局更差[2]。因此,明确BPD加重的危险因素对临床防治BPD、改善早产儿预后至关重要。目前关于BPD的研究多集中于围生期高危因素、氧疗及机械通气对BPD的影响,而关于BPD严重程度的影响因素及肺功能、呼吸系统预后差异的研究相对较少。本研究通过对不同程度BPD早产儿的临床资料进行回顾性分析,并对其肺功能及呼吸系统疾病进行随访,探讨BPD程度较重的危险因素及不同程度BPD患儿的肺功能差异,为临床防治BPD提供依据。现将研究结果报道如下。
1 资料与方法 1.1 研究对象收集2014年3月至2016年3月我院新生儿重症监护病房(NICU)收治的诊断为BPD的144例早产儿的临床资料,其中轻度BPD 81例,中度BPD 51例,重度BPD 12例。入选标准:(1)胎龄<32周;(2)住院时间>28 d;(3)本院出生且生后即转入NICU。排除标准:(1)先天发育畸形(包括复杂先天性心脏病);(2)先天性肺发育不良;(3)遗传代谢性疾病;(4)染色体病。
1.2 诊断及分组依据美国国家儿童健康与人类发育研究机构(NICHD)制定的BPD诊断及分度标准进行BPD诊断与分度[3]。任何氧依赖(>21%)超过28 d的新生儿诊断为BPD。BPD分度:胎龄<32周,根据其纠正胎龄36周或出院时需吸入氧浓度(FiO2)分为:(1)轻度:未用氧;(2)中度:FiO2<30%;(3)重度:FiO2≥30%或需机械通气。本研究根据患儿BPD的程度分为轻度组与中重度组。
1.3 资料收集所收集资料包括:(1)围生期高危因素:胎龄、出生体重、性别、双/多胎、分娩方式、母亲高危因素、产前激素应用、宫内窘迫及Apgar评分1 min≤7分情况;(2)治疗情况:生后应用枸橼酸咖啡因、促红细胞生成素(EPO)及糖皮质激素情况,机械通气、持续正压通气(CPAP)、氧疗及住院天数;(3)合并症及并发症:新生儿呼吸窘迫综合征(RDS)、肺炎、败血症、颅内出血(ICH)、脑室周围白质软化(PVL)、坏死性小肠结肠炎(NEC)、胆汁淤积综合症、早产儿视网膜病(ROP)[4]发生情况;(4)转归:好转出院、放弃/死亡。
生后糖皮质激素应用指征:出生1周后仍需有创呼吸支持[用法:地塞米松0.15 mg/(kg·d)×3 d,逐渐减停,共7~10 d][5]。
1.4 随访(1)纠正胎龄40周行肺功能检查;(2)记录纠正胎龄1岁时因肺炎再入院及喘息性疾病发作次数,以≥3次为反复入院/发作;(3)记录出院后婴儿期死亡情况。
1.5 统计学分析采用SPSS 21.0软件行统计学分析。正态分布的计量资料采用均数±标准差(x±s)表示,非正态分布的计量资料采用中位数和四分位数间距[M(P25,P75)]表示,计数资料采用例数(百分比)描述。正态分布的计量资料组间比较采用成组t检验,非正态分布计量资料组间比较采用秩和检验,计数资料组间比较采用χ2检验或校正χ2检验,多因素分析采用非条件logistic回归分析。P<0.05为差异有统计学意义。
2 结果 2.1 一般资料纳入符合条件的BPD患儿144例,其中男96例,女48例;轻度组81例,中重度组63例。胎龄26.4~31.9周(平均29.1±1.2周),出生体重750~1 800 g(平均1 182±202 g)。轻度组和中重度组两组出生体重及性别分布比较差异无统计学意义(P>0.05)。中重度组胎龄(29.5±1.3周)大于轻度组(28.9±1.1周)(P<0.05),但中重度组小于胎龄儿比例(41%)高于轻度组(11%)(P<0.05)。
2.2 围生期高危因素及治疗情况中重度组重度子癎前期比例高于轻度组(P<0.05),先兆早产比例低于轻度组(P<0.05)。两组剖宫产率、胎膜早破、妊娠期糖尿病、胎盘异常、产前应用激素、宫内窘迫、Apgar评分1 min≤7分等围生期因素差异无统计学意义(P>0.05)。中重度组出生2周仍需机械通气比例高于轻度组(P<0.05),机械通气时间、总氧疗时间及住院时间长于轻度组(P<0.05),枸橼酸咖啡因应用率低于轻度组(P<0.05)。两组持续正压通气(CPAP)时间、EPO及生后糖皮质激素应用率比较差异无统计学意义。见表 1。
| 表 1 两组患儿围生期高危因素及治疗情况的比较 |
|
|
中重度组肺炎、胆汁淤积综合症发生率及NICU放弃/病死率均高于轻度组(P<0.05); 两组Ⅲ~Ⅳ级RDS、败血症、NEC、Ⅲ~Ⅳ级ICH、PVL及ROP的发生率比较差异均无统计学意义(P>0.05)。见表 2。
| 表 2 两组患儿合并症及并发症发生率的比较 [例(%)] |
|
|
将小于胎龄儿、重度子癎前期、先兆早产、枸橼酸咖啡因应用、出生2周仍需机械通气、肺炎等两组间单因素分析差异有统计学意义的因素作为自变量,以中重度BPD发生为因变量,进行多因素logistic回归分析,结果显示:小于胎龄儿、肺炎、出生2周仍需机械通气为BPD程度较重的危险因素(P<0.05),见表 3。
| 表 3 BPD程度影响因素的logistic回归分析 |
|
|
144例BPD患儿中NICU放弃/死亡7例(均为重度BPD),婴儿期死亡8例(轻度组4例,中重度组4例),失访11例(轻度组7例,中重度组4例)。中重度组总死亡率(11/59,19%)明显高于轻度组(4/74,5%)(χ2=5.750,P=0.016)。婴儿期死亡的8例患儿中,2例出院3 d内死亡,其中1例猝死,1例因呛奶窒息死亡,均为轻度BPD患儿;余6例均死于重症肺炎。共118例(轻度组70例,中重度组48例)患儿随访至纠正胎龄1岁,其中77例纠正胎龄40周时曾行肺功能检查(轻度组42例,中重度组35例)。两组患儿随访中死亡及失访情况见图 1。
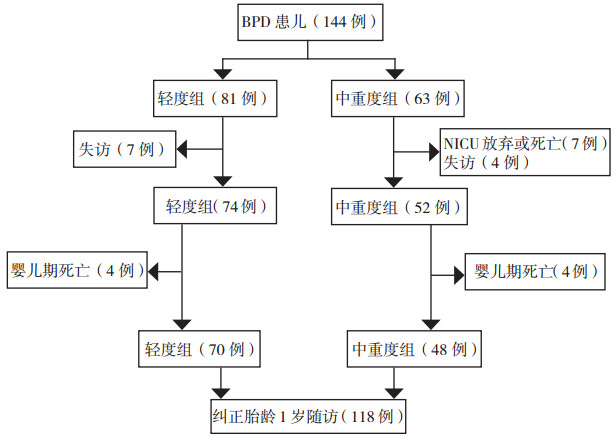
|
图 1 BPD患儿随访中死亡及失访情况 |
纠正胎龄40周肺功能检测中,中重度BPD组达峰时间比(TPTEF/TE%)、达峰容积比(VPEF/VE%)及25%潮气量时呼吸流速(TEF25%)均低于轻度组(P<0.05),两组潮气量/体重(TV/kg)、呼吸频率、TEF75%、TEF50%比较差异无统计学意义(P>0.05),见表 4。
| 表 4 两组患儿纠正胎龄40周肺功能的比较 (x±s) |
|
|
随访至纠正胎龄1岁,48例中重度组患儿中有14例(14/48,29%)因肺炎反复入院≥3次,高于轻度组(3/70,4%)(χ2=13.634,P<0.001);中重度组患儿中有13例(13/48,27%)反复喘息发作≥3次,高于轻度组(2/70,3%)(χ2=14.421,P<0.001)。
3 讨论近年来,随着NICU救治能力的普遍提升,更多早产儿尤其极/超低出生体重儿存活,BPD发病率逐渐上升。BPD已成为影响早产儿住院时间及远期预后的重要因素,尤其中重度BPD可造成远期肺功能下降及神经发育异常[6]。因此,积极防治BPD对提高早产儿生存质量至关重要。
目前研究认为宫内及生后感染可引发炎症反应,释放大量炎症介质,如肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6、-8、-10等,造成肺发育受阻、肺血管及间质损伤,增加BPD的发病风险,但关于宫内感染/绒毛膜羊膜炎与BPD关系的研究结论尚不一致,国内研究多认为宫内感染可增加BPD严重程度[7-9]。本研究显示两组患儿胎膜早破比例差异无统计学意义,中重度组先兆早产比例相对较低,但logistic多因素回归分析并未发现先兆早产与BPD程度相关,而先兆早产最常见的原因是宫内感染,提示宫内感染与BPD程度可能并不相关。本研究发现,生后肺炎可加重BPD程度,是BPD程度较重的独立危险因素,与既往结论相符[10],故应积极防治感染,降低医院感染率,避免加重肺损伤。
目前关于重度子癎前期与BPD的关系仍不明确。研究表明,重度子癎前期是胎龄<32周早产儿发生BPD的重要危险因素,且可加重BPD的严重程度[11]。其机制可能与子癎前期造成胎儿宫内生长受限,并释放炎症因子及可溶性血管内皮生长因子受体-1(sFlt-1),阻断VEGF信号途径,阻碍肺血管及间质发育有关[12]。本研究显示中重度BPD组重度子癎前期比例明显增多,且多因素logistic回归分析显示小于胎龄儿是BPD程度较重的危险因素。因此,应重视重度子癎前期、小于胎龄儿对胎儿/新生儿肺发育的影响。
机械通气和氧疗造成的压力/容量损伤和氧化应激损伤与BPD的严重程度密切相关。中重度BPD患儿生后除罹患RDS外,常存在先天肺泡或间质发育障碍,需较长时间呼吸支持及氧疗,引发机体无菌性炎症反应,加重肺损伤[13]。Wai等[14]研究表明,生后14 d内累积给氧量是早产儿纠正胎龄36周时发生BPD或死亡的独立危险因素。本研究显示中重度BPD患儿机械通气及氧疗时间较长,出生2周仍需机械通气是BPD程度较重的高危因素,有助于识别中重度BPD高危儿并早期防治。因此,应采取肺保护性通气策略,缩短机械通气时间,尽早改用无创呼吸支持,合理用氧,减轻肺损伤。
早产和肺发育不成熟与BPD的发生及严重程度相关,胎龄越小,越易发生中重度BPD[9]。本研究显示中重度组胎龄反而较大,可能与其小于胎龄儿比例高、样本量小有关。曾有学者认为,因早产、肺表面活性物质缺乏所致的RDS是BPD发病的高危因素,但近年来随着与围生期感染、缺氧有关的新型BPD逐渐增多,其RDS程度轻,生后早期只需低浓度氧或不需用氧,但逐渐出现氧依赖[15],故目前认为RDS程度可能与BPD严重程度无直接关系。本研究结果与此一致。
国外研究表明,枸橼酸咖啡因可用来治疗早产儿呼吸暂停,并可降低早产儿BPD发生率[16]。本研究显示轻度组枸橼酸咖啡因应用率较高,提示枸橼酸咖啡因可能可减轻BPD的严重程度,但经多因素logistic回归分析后此作用消失,可能与样本量小有关,需要扩大样本量进一步研究分析。
肺功能检查是反映肺顺应性和气道阻力的有效方法,中重度BPD患儿肺功能较差,更易出现反复呼吸道感染及喘息性疾病[17]。研究显示,BPD早产儿远期肺功能指标FEV1和FEF25~75下降,易出现喘息等呼吸系统疾患,但仅有约1/3的喘息患儿支气管扩张剂治疗有效,疗效差于普通足月哮喘患儿,可能与两者发病机制不同有关[18]。本研究亦显示,中重度BPD患儿更易出现阻塞性通气障碍,易反复罹患肺炎及喘息性疾病,与此一致。因此,应关注BPD患儿远期呼吸系统预后,并积极寻找更为有效的治疗方法。
中重度BPD组患儿因肺部病变重,NICU死亡/放弃率较轻度组明显升高,但有2例轻度BPD患儿出院3 d内猝死或因呛奶窒息死亡。因此,BPD患儿离院前均需做好过渡期宣教及指导。通过建立母婴同室病房,教会家属观察患儿异常情况、家庭氧疗、安全合理喂养、预防感染及猝死的方法,可有效降低BPD患儿再入院率[19]。
BPD已成为影响早产儿住院时间及远期预后的重要因素,尤其中重度BPD增加早产儿病死率及远期呼吸系统疾病发生率,给患儿及家庭带来严重危害及负担。本研究发现小于胎龄儿、肺炎、机械通气时间较长是BPD程度较重的危险因素,且中重度BPD患儿肺功能较差,易出现反复感染、喘息等并发症,对临床防治BPD、改善早产儿预后有指导意义。但本研究仍存在随访时间较短、样本量小等不足,需大样本、多中心的临床随机对照研究进一步明确BPD的临床特征及预后。
| [1] |
Alvira CM, Morty RE. Can we understand the pathobiology of bronchopulmonary dysplasia?[J]. J Pediatr, 2017, 190: 27-37. DOI:10.1016/j.jpeds.2017.08.041 (  0) 0) |
| [2] |
Jensen EA, Schmidt B. Epidemiology of bronchopulmonary dysplasia[J]. Birth Defects Res A Clin Mol Teratol, 2014, 100(3): 145-157. DOI:10.1002/bdra.23235 (  0) 0) |
| [3] |
Jobe AH, Bancalari E. Bronchopulmonary dysplasia[J]. Am J Respir Crit Care Med, 2001, 163(7): 1723-1729. DOI:10.1164/ajrccm.163.7.2011060 (  0) 0) |
| [4] |
邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学[M]. 第4版. 北京: 人民卫生出版社, 2011, 395-398, 401-408, 340-347, 706-713, 715-719, 477-483, 110, 887-892.
(  0) 0) |
| [5] |
Doyle LW, Davis PG, Morley CJ, et al. Low-dose dexamethasone facilitates extubation among chronically ventilator-dependent infants:a multicenter, international, randomized, controlled trial[J]. Pediatrics, 2006, 117(1): 75-83. DOI:10.1542/peds.2004-2843 (  0) 0) |
| [6] |
Islam JY, Keller RL, Aschner JL, et al. Understanding the short-and long-term respiratory outcomes of prematurity and bronchopulmonary dysplasia[J]. Am J Respir Crit Care Med, 2015, 192(2): 134-156. DOI:10.1164/rccm.201412-2142PP (  0) 0) |
| [7] |
Davidson LM, Berkelhamer SK. Bronchopulmonary dysplasia:chronic lung disease of infancy and long-term pulmonary outcomes[J]. J Clin Med, 2017, 6(1): pii:E4. DOI:10.3390/jcm6010004 (  0) 0) |
| [8] |
Balany J, Bhandari V. Understanding the impact of infection, inflammation, and their persistence in the pathogenesis of bronchopulmonary dysplasia[J]. Front Med (Lausanne), 2015, 2: 90. (  0) 0) |
| [9] |
李燕, 韦秋芬, 潘新年, 等. 早产儿支气管肺发育不良严重程度的影响因素[J]. 中国当代儿科杂志, 2014, 16(10): 1014-1018. DOI:10.7499/j.issn.1008-8830.2014.10.011 (  0) 0) |
| [10] |
任艳丽, 孔祥永, 杜志方, 等. 不同程度支气管肺发育不良早产儿的临床及影像学特点[J]. 中国当代儿科杂志, 2015, 17(5): 440-444. DOI:10.7499/j.issn.1008-8830.2015.05.005 (  0) 0) |
| [11] |
Ozkan H, Cetinkaya M, Koksal N. Increased incidence of bronchopulmonary dysplasia in preterm infants exposed to preeclampsia[J]. J Matern Fetal Neonatal Med, 2012, 25(12): 2681-2685. DOI:10.3109/14767058.2012.708371 (  0) 0) |
| [12] |
Tang JR, Karumanchi SA, Seedorf G, et al. Excess soluble vascular endothelial growth factor receptor-1 in amniotic fluid impairs lung growth in rats:linking preeclampsia with bronchopulmonary dysplasia[J]. Am J Physiol Lung Cell Mol Physiol, 2012, 302(1): L36-L46. DOI:10.1152/ajplung.00294.2011 (  0) 0) |
| [13] |
Keszler M, Sant'Anna G. Mechanical ventilation and bronchopulmonary dysplasia[J]. Clin Perinatol, 2015, 42(4): 781-796. DOI:10.1016/j.clp.2015.08.006 (  0) 0) |
| [14] |
Wai KC, Kohn MA, Ballard RA, et al. Early cumulative supplemental oxygen predicts bronchopulmonary dysplasia in high risk extremely low gestational age newborns[J]. J Pediatr, 2016, 177: 97-102. DOI:10.1016/j.jpeds.2016.06.079 (  0) 0) |
| [15] |
Voynow JA. "New" bronchopulmonary dysplasia and chronic lung disease[J]. Paediatr Respir Rev, 2017, 24: 17-18. (  0) 0) |
| [16] |
Park HW, Lim G, Chung SH, et al. Early caffeine use in very low birth weight infants and neonatal outcomes:a systematic review and meta-analysis[J]. J Korean Med Sci, 2015, 30(12): 1828-1835. DOI:10.3346/jkms.2015.30.12.1828 (  0) 0) |
| [17] |
Malleske DT, Chorna O, Maitre NL. Pulmonary sequelae and functional limitations in children and adults with bronchopulmonary dysplasia[J]. Paediatr Respir Rev, 2018, 26: 55-59. (  0) 0) |
| [18] |
Fawke J, Lum S, Kirkby J, et al. Lung function and respiratory symptoms at 11 years in children born extremely preterm:the EPICure study[J]. Am J Respir Crit Care Med, 2010, 182(2): 237-245. DOI:10.1164/rccm.200912-1806OC (  0) 0) |
| [19] |
李兰, 陈舜妹, 郭荣莲. 个体化过渡期护理模式在早产儿支气管肺发育不良中的应用[J]. 国际护理学杂志, 2017, 36(7): 898-901. (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


