钠牛磺胆酸共转运多肽(sodium taurocholate cotransporting polypeptide, NTCP)缺陷病是位于染色体14q24.2的SLC10A1基因变异引起的遗传性胆汁酸代谢病。SLC10A1基因于1994年由Hagenbuch等克隆,其编码的NTCP蛋白的功能也得以深入研究[1-2]。SLC10A1基因包含5个外显子,基因全长23 kb[3]。NTCP由349个氨基酸组成,分子量为38 kD,是一种表达于肝细胞基侧膜的转运蛋白,是参与胆汁酸肠肝循环的重要载体,可将血浆中的结合胆汁酸盐摄入肝细胞[1, 4-5]。
虽然SLC10A1基因被克隆多年,NTCP的功能也被广泛研究,但有关NTCP缺陷病的报道非常有限,目前查到国外文献5篇[6-10],涉及14例患者;国内文献1篇,报道2例患者[11]。这些NTCP缺陷病患者均以持续性高胆汁酸血症为突出特点。然而,本病的遗传方式、流行病学特点尚不明确,对临床表现的认识仍有待观察和积累,治疗也缺乏确切的方案。本文报道暨南大学附属第一医院确诊的一例NTCP缺陷病患者,为该病的诊治提供参考。
1 资料与方法 1.1 病例介绍患者,男,3.3个月,因发现皮肤及巩膜黄染3月余入院。患者生后第4天开始出现皮肤及巩膜黄染,曾在当地医院予蓝光照射,皮肤黄染减轻出院。出院后黄疸逐渐加重,2月龄查血生化(见表 1)示转氨酶、胆汁酸及胆红素升高,以结合胆红素升高为主;腹部超声示胆囊偏小,肝脾未见异常;红细胞葡萄糖-6-磷酸脱氢酶活性正常;液相串联质谱法血液氨基酸和酰基肉碱谱检测未发现异常;磁共振水成像肝内外胆管未见明显异常;上腹部磁共振示肝大、轻度脂肪肝。2.5月龄时行腹腔镜探查+胆道造影+肝脏活检术,发现:腹腔内少量黄绿色腹水,双侧鞘状突未闭,肝脏暗红色、无明显增大、未见肝硬化改变,可见胆汁淤积,胆总管存在、胆囊腔及管腔内可见少量墨绿色胆汁;胆道造影胆总管及肝内胆管显影清晰,可见副肝管存在,肝内胆管显示清晰;肝活检示肝细胞气球样变,细胞内胆汁淤积,间质淋巴细胞浸润,肝内胆管增生不明显。予护肝、茵栀黄等治疗,黄染减轻出院。出院后黄疸再次加重,为明确病因至我科就诊。患儿自起病以来,精神、食纳一般,睡眠可,人工喂养,大小便正常,体重增长正常。
| 表 1 患儿实验室检查的动态变化 |
|
|
患儿系第3胎第2产,出生胎龄35周,自然分娩出生,出生体重2.55 kg(适于胎龄儿),身长48 cm,出生时无窒息史。父母体健,非近亲结婚。否认家族类似病史及传染病史。
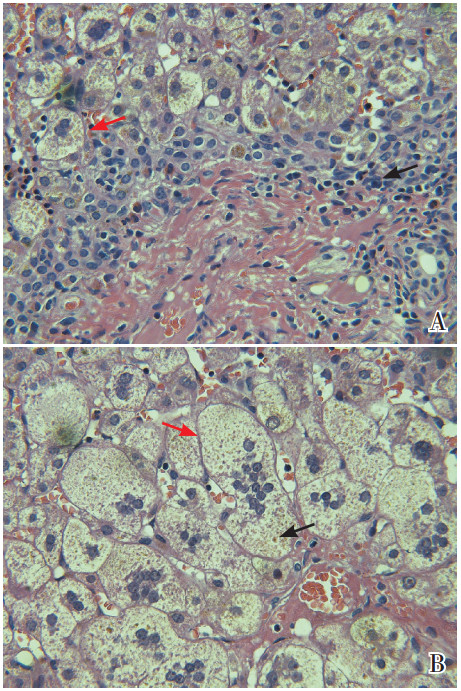
体格检查:体重6.2 kg(-1.2 SD),身长60 cm(-1.5 SD),头围39 cm(-1.6 SD)。神清,反应可,发育正常,营养中等。全身皮肤及巩膜中度黄染,无皮疹及出血点,浅表淋巴结未触及。头颅五官未见畸形。前囟平软,约2 cm×2 cm。双肺呼吸音清,未闻及干湿啰音。心律齐,心音有力,未闻及病理性杂音。腹平软,右上腹壁可见一手术疤痕,肝右肋下3.5 cm、质地中等,脾肋下未触及。脊柱、四肢无畸形。腹壁、膝腱和跟腱等生理反射可引出,布氏、克氏和巴氏征均阴性。肛门及外生殖器无异常。辅助检查:血、尿、粪常规正常;生化(见表 1)示结合胆红素升高,呈典型胆汁淤积性黄疸改变;血清25-OH-VitD降低;肝炎病毒(-);梅毒、结核、HIV抗体均阴性。肝脏病理切片会诊(见图 1):肝细胞气球样变,多核巨细胞易见,部分细胞见淤胆现象,肝小叶结构破坏,见点状坏死,汇管区炎性细胞浸润。SLC25A13基因高频突变筛查未检测到c.851_854del4、c.1638_1660dup、IVS6+5G>A和IVS16ins3kb等4种希特林缺陷病相关的高频突变[12-14]。
|
图 1 肝脏组织病理检查(苏木素-伊红染色,放大倍数×400) A:门管区周围炎症细胞浸润、以淋巴细胞为主(如黑色箭头所指)。肝细胞胞浆疏松,部分呈气球样变(如红色箭头所指)。B:多核巨细胞易见(如红色箭头所指),其内可见胆色素沉积(如黑色箭头所指)。 |
用Blood DNA Minikit试剂盒(Simgen公司,中国)提取患儿及父母基因组DNA,采用聚合酶链式反应(polymerase chain reaction, PCR)对SLA10A1基因的5个外显子及其侧翼序列进行扩增。扩增引物根据SLC10A1基因序列,运用Premier 5.0软件设计(上海立菲生物技术有限公司合成)。PCR反应体系及温度条件参考文献[10]。PCR产物经2%琼脂糖凝胶电泳分离,目的条带使用切胶纯化试剂盒(Qiagen)从胶中回收。将纯化的PCR产物进行测序(英潍捷基上海贸易有限公司)。应用Chromas软件对测序结果进行分析,并应用DNAMAN软件与SLC10A1基因组参考序列进行比对。
1.3 聚合酶链式反应-限制性片段长度多态性分析采用聚合酶链式反应-限制性片段长度多态性(polymerase chain reaction restriction fragment length polymorphism, PCR-RFLP)验证SLC10A1基因型,其原理参考文献[8]。PCR正向和逆向引物(上海立菲生物技术有限公司合成)分别是5' -CCAGTTCCCTCTGAGTGTATGTG-3' 和5' -GCAGGCTCAGGTCTAATATTGG-3' 。扩增反应体系及温度条件参考文献[10]。酶切反应体系:PCR扩增产物10 μL,灭菌双蒸水18 μL,10×Buffer B 2 μL,Hph Ⅰ酶1 μL,混合离心后37℃温水浴2 h。酶切后产物经3%琼脂糖凝胶电泳分离,使用凝胶成像仪观察目的条带。
1.4 全基因组测序为排除ATP8B1、ABCB11、VPS33B、AMACR、HSD17B4等其它50种影响胆汁酸代谢的基因突变[8],进一步采集患儿静脉血,提取DNA,纯化得到富集的DNA文库后进行全基因组测序分析(深圳华大基因科技有限服务公司检测)。对测序产生的原始数据去接头、过滤50%的低质量序列,使Q20值达93.33%,以保证质控。最后进行基因序列生物信息学分析,找出致病基因及其变异性质。变异命名采用人类基因组变异协会(http://www.hgvs.org, HGVS)命名法,变异意义参考Ensemble数据库(http://www.ensembl.org)。
1.5 错义变异致病性的生物信息学预测错义突变的致病性通过PolyPhen-2(http://genetics.bwh.harvard.edu/pph2/)、MutationTaster(http://mutationtaster.org/MutationTaster/index.html)和SIFT(http://sift.jcvi.org/)3种软件进行预测。对错义位点的氨基酸行保守性分析。人SLC10A1基因编码蛋白的氨基酸序列从Ensemb l数据库获取,采用Ensemb l BLAST/BLAT软件(http://asia.ensembl.org/Multi/Tools/Blast?db=core)与其他物种的同源氨基酸序列进行比对。
本研究获医院伦理委员会批准及患儿父母知情同意。
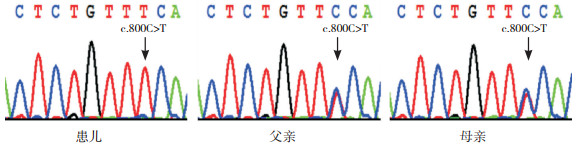
2 结果 2.1 遗传学分析结果SLC10A1基因Sanger测序(图 2)发现患儿为c.800C>T(p.Ser267Phe)变异的纯合子,其父母均为该变异的携带者。
|
图 2 患儿及其父母SLC10A1基因Sanger测序图 患儿为c.800C>T(p.Ser267Phe)变异的纯合子,其父母均为该变异的携带者。变异位点如箭头所示。 |
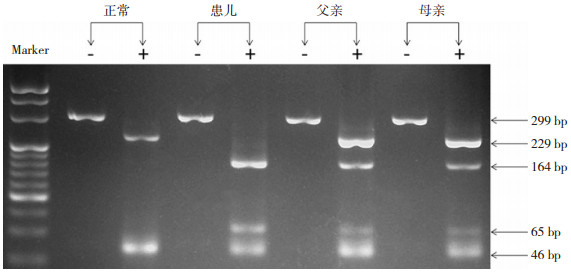
采用Hph I限制性内切酶对PCR产物进行酶切,酶切产物经3%琼脂糖凝胶电泳分离并观察目标条带,该变异产生了164 bp和65 bp两个新条带,说明患儿为c.800C>T(p.Ser267Phe)变异的纯合子,其父母均为同一变异的携带者。见图 3。
|
图 3 患儿及其父母SLC10A1基因PCR-RFLP分析凝胶电泳 患儿为c.800C>T(p.Ser267Phe)变异的纯合子,其父母均为该变异的携带者。 |
全基因组测序未发现影响胆汁酸稳态的其它50种遗传病致病基因的插入、缺失、经典剪接位点变异等致病性变异,虽然SLCO1B1基因检出1个无义突变,AKR1D1和CFTR基因检出3个错义突变,然而其相关疾病在临床表型、遗传方式等方面均与本患儿临床和实验室表现不相符,见表 2。进一步对3个错义突变采用PolyPhen-2、MutationTaster和SIFT软件进行致病性预测,其中AKR1D1基因的c.797G>A(p.R266Q)变异虽三个软件的预测结果分别为可能致病、致病和影响蛋白质功能,但其表型为先天性胆汁酸合成障碍2型,主要表现为胆汁淤积性黄疸,脂肪、脂溶性维生素吸收障碍,血清转氨酶升高,但血清总胆汁酸正常甚至降低,而γ-谷氨酰转肽酶水平不高,与本患儿的临床和生化表型特征不符;其余2个错义变异软件预测结果均无致病性且变异位点的氨基酸不保守。
| 表 2 全基因组测序发现的胆汁酸代谢相关基因的变异类型 |
|
|
根据患儿病史、临床表现及实验室检查,诊断为胆汁淤积症,结合肝脏组织病理,予醋酸泼尼松抗炎及护肝、补充脂溶性维生素等治疗,转氨酶和胆红素等逐渐恢复正常,但TBA水平继续维持高水平,考虑NTCP缺陷病,于17.2月龄时行SLC10A1基因分析得以确诊。确诊后未予特殊治疗。目前已经随访至34.3月龄,体重13 kg(-1.3 SD)、头围48 cm(-1.3 SD)、身长91 cm(-2 SD),智力发育正常,黄疸消退,肝脏大小、质地和肝功能均恢复正常,胆汁酸仍高(表 1)。
3 讨论NTCP缺陷病最突出的特征为血浆总胆汁酸显著并持续性升高,并与其他肝功指标变化不同步、不平行,部分患者在婴儿期尤其是新生儿期表现为胆汁淤积性黄疸。本例患儿主要特点为迁延性黄疸(结合胆红素升高为主)、胆汁酸增高伴肝脏肿大,肝脏病理发现大量多核巨细胞,部分肝细胞内胆色素沉积,因此肝内胆汁淤积症诊断成立。患儿经腹腔镜探查排除了胆道梗阻;液相串联质谱法血液氨基酸检测和酰基肉碱谱检测未发现异常;肝炎病毒、梅毒、结核、HIV抗体均阴性,不支持这些病原体感染引起的胆汁淤积;新生儿期起病的黄疸需要排除遗传性胆汁淤积,但Sanger测序对SLC25A13基因4个高频突变位点进行筛查未发现致病突变,不支持希特林缺陷病;而且患儿缺乏皮肤瘙痒、脂肪泻等其他胆汁淤积的临床表现,高胆汁酸血症与其他肝功能指标的变化趋势不同步,这些特点与NTCP缺陷病的特征性表现类似[6]。SLC10A1基因变异分析发现患儿为已报道[7-10]的致病性变异c.800C>T(p.Ser267Phe)纯合子,且全基因组测序未检测到其它胆汁酸代谢相关基因存在变异,从而确诊NTCP缺陷病。
肝脏摄取胆汁酸主要由位于肝细胞基侧膜的钠依赖和非钠依赖性转运蛋白介导[15]。非钠依赖的转运蛋白有机阴离子转运多肽(organic anion transporting polypeptides, OATPs)是一个包含多种蛋白质的超级家族,其中OATP1B1和1B3两个成员以异二聚体形式表达在肝细胞基侧膜,主要负责摄取血浆胆红素,尤其是直接胆红素,同时也具备胆汁酸摄取功能[16]。钠依赖性转运蛋白即为SLC10A1基因编码的NTCP,主要将结合胆汁酸从血浆转运到肝细胞。由于SLC10A1基因突变,NTCP缺陷病患者肝细胞钠依赖性胆汁酸摄取功能受损,致使血浆胆汁酸明显升高,继而通过OATP1B1/1B3以非钠依赖性方式转运入肝细胞,一方面加重了OATP1B1/1B3摄取胆汁酸的负担,另一方面竞争性抑制其摄取胆红素的功能,从而导致胆红素尤其是直接胆红素升高[8, 10-11]。
目前已报道的NTCP缺陷病患者有25-OH-VitD降低的倾向。Vaz等[6]报道的首例儿童NTCP缺陷病患者存在25-OH-VitD降低。Liu等[7]报道的8例SLC10A1基因p.Ser267Phe纯合子突变患者均存在25-OH-VitD降低,并且排除了肠道疾病引起的肠吸收不良等原因。本例患儿在婴儿期25-OH-VitD也降低。NTCP缺陷病患者25-OH-VitD降低可能与肠道内胆汁酸减少和/或活性不足导致膳食脂肪溶解和脂溶性维生素吸收减少有关。
NTCP缺陷病目前尚缺乏确切的治疗手段,长期高胆汁酸血症的远期影响尚不清楚。但NTCP缺陷病以结合胆汁酸升高为主,而血浆中结合胆汁酸的有害性远低于游离胆汁酸[17]。因此,本病的高胆汁酸血症是否需积极处理,尚需进一步研究。
总之,本研究首次提供了NTCP缺陷病患儿存在胆汁淤积症的病理学依据。本文患儿以持续性高胆汁酸血症为突出表现,在婴儿早期具有较典型胆汁淤积症的临床、生化和病理学特点,SLC10A1基因型为高频变异p.Ser267Phe的纯合子。本研究进一步丰富了对NTCP缺陷病患儿表型特征的认识,对于该病的诊断和治疗具有一定的参考价值。
| [1] |
Hagenbuch B, Meier PJ. Molecular cloning, chromosomal localization, and functional characterization of a human liver Na+/bile acid cotransporter[J]. J Clin Invest, 1994, 93(3): 1326-1331. DOI:10.1172/JCI117091 (  0) 0) |
| [2] |
Hallén S, Mareninova O, Branden M, et al. Organization of the membrane domain of the human liver sodium/bile acid cotransporter[J]. Biochemistry, 2002, 41(23): 7253-7266. DOI:10.1021/bi012152s (  0) 0) |
| [3] |
Shiao T, Iwahashi M, Fortune J, et al. Structural and functional characterization of liver cell-specific activity of the human sodium/taurocholate cotransporter[J]. Genomics, 2000, 69(2): 203-213. DOI:10.1006/geno.2000.6329 (  0) 0) |
| [4] |
Hagenbuch B, Dawson P. The sodium bile salt cotransport family slc10[J]. Pflugers Arch, 2004, 447(5): 566-570. DOI:10.1007/s00424-003-1130-z (  0) 0) |
| [5] |
Anwer MS, Stieger B. Sodium-dependent bile salt transporters of the SLC10A1 transporter family:more than solute transporters[J]. Pflugers Arch, 2014, 466(1): 77-89. DOI:10.1007/s00424-013-1367-0 (  0) 0) |
| [6] |
Vaz FM, Paulusma CC, Huidekoper H, et al. Sodium taurocholate cotransporting polypeptide (SLC10A1) deficiency:conjugated hypercholanemia without a clear clinical phenotype[J]. Hepatology, 2015, 61(1): 260-267. DOI:10.1002/hep.27240 (  0) 0) |
| [7] |
Liu R, Chen C, Xia X, et al. Homozygous p.Ser267phe in SLC10A1 is associated with a new type of hypercholanemia and implications for personalized medicine[J]. Sci Rep, 2017, 7(1): 9214. DOI:10.1038/s41598-017-07012-2 (  0) 0) |
| [8] |
Deng M, Mao M, Guo L, et al. Clinical and molecular study of a pediatric patient with sodium taurocholate cotransporting polypeptide deficiency[J]. Exp Ther Med, 2016, 12(5): 3294-3300. DOI:10.3892/etm.2016.3752 (  0) 0) |
| [9] |
Van Herpe F, Waterham HR, Adams CJ, et al. NTCP deficiency and persistently raised bile salts:an adult case[J]. J Inherit Metab Dis, 2017, 40(3): 313-315. DOI:10.1007/s10545-017-0031-9 (  0) 0) |
| [10] |
Qiu JW, Deng M, Cheng Y, et al. Sodium taurocholate cotransporting polypeptide (ntcp) defciency:Identifcation of a novel SLC10A1 mutation in two unrelated infants presenting with neonatal indirect hyperbilirubinemia and remarkable hypercholanemia[J]. Oncotarget, 2017, 8(63): 106598-106607. (  0) 0) |
| [11] |
宋元宗, 邓梅. 疑难病研究-钠牛磺胆酸共转运多肽缺陷病表现为婴儿早期胆汁淤积性黄疸[J]. 中国当代儿科杂志, 2017, 19(3): 350-354. DOI:10.7499/j.issn.1008-8830.2017.03.020 (  0) 0) |
| [12] |
宋元宗, 牛饲美晴, 盛建胜, 等. Citrin缺陷导致的新生儿肝内胆汁淤积症家系SLC25A13基因突变研究[J]. 中华儿科杂志, 2007, 45(6): 408-412. (  0) 0) |
| [13] |
Lu YB, Kobayashi K, Ushikai M, et al. Frequency and distribution in east asia of 12 mutations identified in the SLC25A13 gene of japanese patients with citrin deficiency[J]. J Hum Genet, 2005, 50(7): 338-346. DOI:10.1007/s10038-005-0262-8 (  0) 0) |
| [14] |
Tabata A, Sheng JS, Ushikai M, et al. Identification of 13 novel mutations including a retrotransposal insertion in SLC25A13 gene and frequency of 30 mutations found in patients with citrin deficiency[J]. J Hum Genet, 2008, 53(6): 534-545. DOI:10.1007/s10038-008-0282-2 (  0) 0) |
| [15] |
Van Dyke RW, Stephens JE, Scharschmidt BF. Bile acid transport in cultured rat hepatocytes[J]. Am J Physiol, 1982, 243(6): G484-G492. (  0) 0) |
| [16] |
Hagenbuch B, Meier PJ. The superfamily of organic anion transporting polypeptides[J]. Biochim Biophys Acta, 2003, 1609(1): 1-18. (  0) 0) |
| [17] |
Ferdinandusse S, Denis S, Dacremont G, et al. Toxicity of peroxisomal c27-bile acid intermediates[J]. Mol Genet Metab, 2009, 96(3): 121-128. DOI:10.1016/j.ymgme.2008.11.165 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


