2. 华中科技大学同济医学院附属武汉儿童医院呼吸内科, 湖北 武汉 430016
原发性免疫缺陷病(primary immunodeficiency diseases, PID)是由于机体免疫系统中一个或多个要素功能丧失而导致的一类临床表现和遗传背景高度异质性的遗传性疾病,且大部分为单基因遗传病[1-3]。目前已经发现300多个基因与PID相关,这些基因异常所导致的临床表型包括反复感染或条件致病菌感染、自身免疫和炎症反应等多方面[4]。由于PID种类繁多,异质性强,仅根据临床表型确诊较为困难;新一代高通量测序技术的出现为该类疾病的诊断提供了新的方法。本研究利用高通量测序对疑似原发性免疫缺陷病患者及父母进行基因突变分析,帮助确诊并提供遗传咨询,为提高临床医生对免疫缺陷病的认识提供理论基础。
1 资料与方法 1.1 研究对象选取2015年1月至2017年3月湖北省第三人民医院儿科诊断的7例免疫缺陷病患者为研究对象,均为男性,年龄5个月至4岁6个月,均因发热或者肺炎等入院,免疫球蛋白IgG及IgM水平低下,淋巴细胞亚群的绝对值或比例异常(表 1),考虑免疫缺陷病,进一步行高通量测序及Sanger测序验证。
| 表 1 7例免疫缺陷病患儿免疫球蛋白、淋巴细胞亚群的检测结果以及临床诊断 |
|
|
采集先证者及家属的外周静脉血各2 mL,提取基因组DNA。高通量测序(由华大基因公司协助完成),并利用Sanger测序进行验证。BTK基因、IL2RG2基因以及RAG2基因的引物由上海生工合成。PCR反应体系:基因组DNA 50 ng,dNTP 200 μmol/L,MgCl2 1.5 mmol/L,上下游引物各1.0 μmol/L,Taq DNA聚合酶1 U(TAKARA公司),加水至终体积25 μL。94℃预变性3 min,94℃变性30 s,54~58℃退火30 s,72℃延伸30 s,36个循环;72℃延伸10 min。PCR产物经琼脂糖凝胶电泳检测后进行测序分析。研究得到医院医学伦理学委员会批准及患者家属的知情同意。
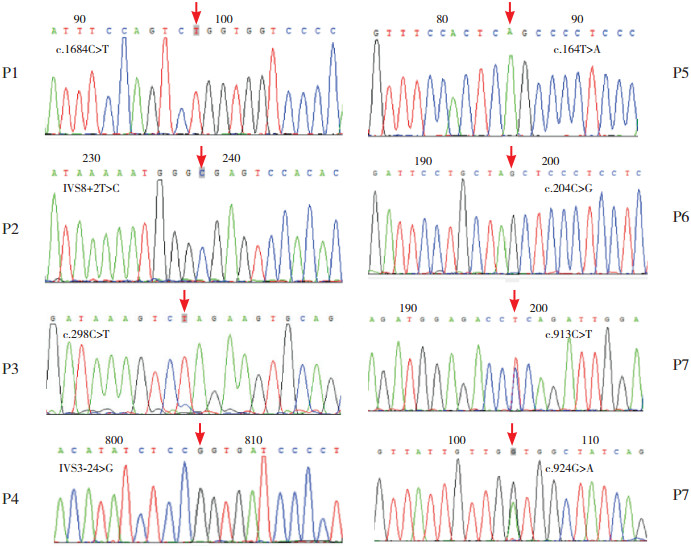
2 结果 2.1 基因检测结果高通量测序(见图 1)及Sanger测序验证发现,病例1的BTK基因15号外显子存在c.1684C>T突变,该突变导致基因编码的蛋白562位氨基酸由精氨酸突变为色氨酸(p.R562W);患儿母亲及姐姐的该位点存在杂合突变(突变携带者)。病例2的BTK基因内含子8存在剪接位点突变(IVS8+2T>C),遗传自患者母亲。患者3的IL2RG基因存在c.298C>T突变,该突变导致IL2RG蛋白100位氨基酸由谷氨酰胺突变为终止密码子(p.Q100X),因而产生截短的蛋白;该突变遗传自患者母亲,其家系成员分析发现患者母亲的妹妹携带该位点突变。患者4发现IL2RG基因存在剪接位点突变(IVS3-2A>G),该突变遗传自患儿母亲。患者5的IL2RG基因存在c.164T>A突变,导致该基因编码的蛋白质的55位氨基酸由亮氨酸突变为谷氨酰胺(p.L55Q),突变来源于患者母亲。病例6经测序发现RAG2基因存在c.204C>G纯合突变,该突变导致其编码的蛋白第68位氨基酸酪氨酸突变为终止密码子(p.W68X),其父母均为该位点的突变携带者。患者7经测序发现RAG2基因存在c.913C>T(p.P305S)和c.824G>A(p.G275D)复杂杂合突变,两个突变位点分别遗传自其父母,其姐姐携带c.913C>T杂合突变。
|
图 1 病例1~7(P1-P7)的基因突变检测结果 患者1 BTK基因存在c.1684C>T突变,患者2 BTK基因存在IVS8+2T>C突变,患者3 IL2RG基因存在c.298C>T突变,患者4 IL2RG基因存在IVS3-2A>G突变,患者5 IL2RG基因存在c.164T>A突变,患者6 RAG2基因存在c.204C>G突变,患者7 RAG2基因存在c.913C>T及c.824G>A复杂杂合突变。突变位点如箭头所示。 |
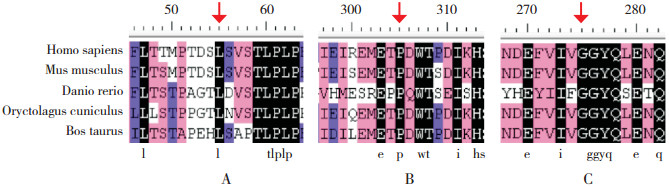
经查阅HGMD、PubMed等数据库,病例5 IL2RG基因的c.164T>A(p.L55Q)突变,以及病例7 RAG2基因的c.913C>T(p.P305S)和c.824G>A(p.G275D)突变均未见报道。IL2RG基因c.164T>A突变的Polyphen2软件预测得分为0.982(分值0~1,越接近1危害越大);SIFT软件预测得分为0.02(分值0~1,越接近0危害越大)。将人IL2RG蛋白的氨基酸序列与家鼠、斑马鱼、家兔、牛的蛋白序列比对,显示IL2RG蛋白第55位氨基酸在物种进化上保守,见图 2A。RAG2基因c.913C>T(p.P305S)突变的Polyphen2软件预测得分为0.687,SIFT软件预测得分为0.13;c.824G>A突变的Polyphen2预测得分1.000,SIFT软件预测得分为0.01。将人RAG2蛋白的氨基酸序列与家鼠、斑马鱼、家兔、牛的蛋白序列比对,显示RAG2蛋白第305位和275位氨基酸在物种进化上保守,见图 2-B、C。
|
图 2 多物种IL2RG蛋白和RAG2蛋白的氨基酸序列比对分析 背景为黑色的氨基酸提示在不同物种之间保守。图A示IL2RG蛋白第55位亮氨酸在不同的物种间保守,图B和C示RAG2蛋白第305位脯氨酸、275位甘氨酸在不同的物种之间保守。突变位点如箭头所示。 |
病例1、2诊断为X连锁无丙种球蛋白血症,定期予以静脉丙种球蛋白治疗,易出现咳嗽等症状。病例3~5诊断为X连锁重症联合免疫缺陷病,入院后利用头孢哌酮钠舒巴坦钠、万古霉素等抗感染治疗,静脉注射丙种球蛋白辅助治疗;P3感染控制后考虑骨髓移植,P4、P5放弃治疗。病例6、7诊断为Omenn综合征,予以抗感染及静脉注射丙种球蛋白,感染控制不佳,1例死亡,另1例患儿情况不详。
3 讨论PID是一种罕见的遗传性疾病,总的发病率约为1/5 000活产婴儿,我国PID患儿约60 000~120 000例,目前我国PID的确诊率不足5%[7]。PID种类较多、异质性强,临床诊断较为困难[8]。自1952年发现X-连锁无丙种球蛋白血症(X-lingked agammaglobulinemia, XLA)以来,目前已经报道了300多种基因缺陷导致的PID[4]。而Sanger测序技术和高通量测序技术对于PID的早期诊断及治疗具有重要意义。
XLA是原发性免疫缺陷病中最常见的类型之一,表现为免疫球蛋白水平降低、外周血成熟B淋巴细胞显著减少及反复感染[9]。研究[10]发现XLA的致病基因为BTK基因,该基因编码酪氨酸激酶相关的蛋白,而该蛋白在B淋巴细胞成熟过程中发挥重要作用。目前国内外已经报道了800多种BTK基因突变,包括错义突变、无义突变、插入/缺失突变和剪接位点突变等。本研究病例1、2的免疫球蛋白水平低下且外周血B淋巴细胞计数显著降低,BTK基因分别存在c.1684C>T突变和IVS8+2T>C剪接位点突变,这两种突变均为已知的XLA致病性变异,因此病例1、2确诊为XLA。
X-连锁严重联合免疫缺陷病(X-linked severe combined immunodeficiency, X-SCID)是原发性免疫缺陷病中最严重的一型,发病率约为1/5~10万,表现为细胞免疫和体液免疫联合受损、T细胞分化障碍伴B淋巴细胞功能缺失(数目正常或增多)[11]。X-SCID可由多种基因缺陷所致,最常见的是位于X染色体的IL2RG基因即白细胞介素-2、4、7、9、15和21共用受体γ链的基因突变,约占SCID的50%[12]。本研究病例3、4、5表现为反复感染、免疫球蛋白水平低下,CD3+、CD4+及CD8+ T淋巴细胞以及NK细胞计数均显著降低、CD19+ B淋巴细胞计数正常,3例患儿均携带IL2RG基因突变:分别为c.298C>T、IVS3-2A>G以及c.164T>A突变,其中c.164T>A突变未见报道,但生物信息学分析提示可能为致病性变异。目前X-SCID的治疗主要是造血干细胞移植和基因治疗,尽早接受干细胞移植患者的生存率可达90%以上,基因治疗尚不成熟[13-14]。
Omenn综合征属于SCID的一种,目前已经发现RAG1和RAG2基因突变可导致Omenn综合征,其机理为RAG1或RAG2基因突变可影响V(D)J重组,而V(D)J重组过程对维持免疫球蛋白及T淋巴细胞受体的多样性至关重要[15]。不同类型的RAG1和RAG2突变可不同程度地影响V(D)J重组,从而导致临床表现不同。Omenn综合征表现为反复感染、长期腹泻、中耳炎、表皮剥脱的红皮病等,实验室检查可见嗜酸性粒细胞增多、血清IgE水平升高[16]。本研究病例6、7有反复感染、腹泻以及发育落后,免疫球蛋白IgG均降低,IgE水平轻度升高,RAG2基因均存在突变,虽然病例7的RAG2基因复杂杂合突变文献和数据库未见报道,但生物信息学软件预测为有害性突变。Omenn综合征的治疗与X-SCID相似,需要早期进行干细胞移植,帮助免疫重建,降低死亡率。
大多数的PID为单基因遗传病,对该类疾病进行分子遗传学检测,可帮助患儿尽早确诊,辅助遗传咨询和产前诊断。本研究发现3个未见报道的PID新突变,丰富了PID基因突变数据库,加深了临床医生对该病的认识。
| [1] |
Geha RS, Notarangelo LD, Casanova JL, et al. Primary immunodeficiency diseases:an update from the International Union of Immunological Societies Primary Immunodeficiency Diseases Classification Committee[J]. J Allergy Clin Immunol, 2007, 120(4): 776-794. DOI:10.1016/j.jaci.2007.08.053 (  0) 0) |
| [2] |
Kohn DB, Kuo CY. New frontiers in the therapy of primary immunodeficiency:from gene addition to gene editing[J]. J Allergy Clin Immunol, 2017, 139(3): 726-732. DOI:10.1016/j.jaci.2017.01.007 (  0) 0) |
| [3] |
Picard C, Al-Herz W, Bousfiha A, et al. Primary immunodeficiency diseases:an update on the classification from the International Union of Immunological Societies Expert Committee for Primary Immunodeficiency 2015[J]. J Clin Immunol, 2015, 35(8): 696-726. DOI:10.1007/s10875-015-0201-1 (  0) 0) |
| [4] |
赵晓东. 原发性免疫缺陷病:精准医学的典型适应证[J]. 中国实用儿科杂志, 2017, 32(7): 481-483. (  0) 0) |
| [5] |
江载芳, 申昆玲, 沈颖. 诸福棠实用儿科学[M]. 第8版. 北京: 人民卫生出版社, 2015, 619-620.
(  0) 0) |
| [6] |
袁建涛, 雷婷. Omenn综合征临床表型及分子诊断[J]. 临床儿科杂志, 2018, 36(2): 117-120. (  0) 0) |
| [7] |
毛华伟, 赵晓东. 进一步加强免疫球蛋白G替代治疗原发性免疫缺陷病[J]. 中华儿科杂志, 2017, 55(1): 1-3. (  0) 0) |
| [8] |
Stray-Pedersen A, SorteHS, Samarakoon P, et al. Primary immunodeficiency diseases:Genomic approaches delineate heterogeneous Mendelian disorders[J]. J Allergy Clin Immunol, 2017, 139(1): 232-245. DOI:10.1016/j.jaci.2016.05.042 (  0) 0) |
| [9] |
Tsukada S, Saffran DC, Rawlings DJ, et al. Deficient expression of a B cell cytoplasmic tyrosine kinase in human X-linked agammaglobulinemia[J]. J Immunol, 2012, 188(7): 2936-2947. (  0) 0) |
| [10] |
Chen XF, Wang WF, Zhang YD, et al. Clinical characteristics and genetic profiles of 174 patients with X-linked agammaglobulinemia:Report from Shanghai, China (2000-2015)[J]. Medicine, 2016, 95(32): e4544. DOI:10.1097/MD.0000000000004544 (  0) 0) |
| [11] |
Michos A, Tzanoudaki M, Villa A, et al. Severe combined immunodeficiency in Greek children over a 20 year period:rarity of γ-chain deficiency (X-linked) type[J]. J Clin Immunol, 2011, 31(5): 778-783. DOI:10.1007/s10875-011-9564-0 (  0) 0) |
| [12] |
Buckley RH. Molecular defects in human severe combined immunodeficiency and approaches to immune reconstitution[J]. Annu Rev Immunol, 2004, 22: 625-655. DOI:10.1146/annurev.immunol.22.012703.104614 (  0) 0) |
| [13] |
Mukherjee S, Thrasher AJ. Gene therapy for PIDs:progress, pitfalls and prospects[J]. Gene, 2013, 525(2): 174-181. DOI:10.1016/j.gene.2013.03.098 (  0) 0) |
| [14] |
Myers LA, Patel DD, Puck JM, et al. Hematopoietic stem cell transplanation for severe combined immunodeficiency in the neonatal period leads to superior thymic output and improved survival[J]. Blood, 2002, 99(3): 872-878. DOI:10.1182/blood.V99.3.872 (  0) 0) |
| [15] |
Bai XM, Liu J, Zhang Z, et al. Clinical, immunologic, and genetic characteristics of RAG mutations in 15 Chinese patients with SCID and Omenn syndrome[J]. Immunol Res, 2016, 64(2): 497-507. DOI:10.1007/s12026-015-8723-4 (  0) 0) |
| [16] |
Kato M, Kimura H, Seki M, et al. Omenn syndrome-review of several phenotypes of Omenn syndrome and RAG1/RAG2 mutations in Japan[J]. Allergol Int, 2006, 55(2): 115-119. DOI:10.2332/allergolint.55.115 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20

