特应性皮炎(atopic dermatitis, AD)是一种与遗传相关的慢性、复发性、炎症性的皮肤病[1],其发病率呈现逐年上升趋势[2],严重影响患儿及其家庭的生活质量,甚至还是未来出现食物过敏、过敏性鼻炎和哮喘的危险因素[3],因此有效预测和积极预防AD的发生成为近年来的研究热点。
既往研究显示,维生素D除了经典的调节钙磷平衡的作用外,还具有调节免疫功能的作用[4]。近年来的研究显示25羟基维生素D3 [25(OH)D3]水平与新生儿免疫、败血症、支气管肺发育不良和急性下呼吸道感染等密切相关[5-8]。然而,目前国内尚未见25(OH)D3水平与AD关系的报道。本研究通过检测脐血25(OH)D3水平,探讨其与婴儿早期AD的相关性,为AD的一级预防提供参考指征,继而早期预防和治疗AD。
1 资料与方法 1.1 研究对象选取2015年7~9月在复旦大学附属上海市第五人民医院产科由健康孕妇生产的正常单胎足月新生儿为研究对象,随访至生后6个月。所有入选对象均由监护人签署知情同意书。
1.2 脐血标本的采集在严格的无菌操作下,于新生儿娩出后2 min内迅速抽取脐静脉血5 mL,室温放置2~4 h,然后3 000 r/min离心10 min,将分离血清置于1.5 mL EP管中收集,贴上标签,置于-20℃冰箱保存,直至检测。
1.3 脐血25(OH)D3水平检测采用德国西门子Centuar XP全自动电化学发光免疫分析仪检测脐血25(OH)D3水平。将脐血25(OH)D3<30 nmol/L定义为诊断试验阳性。
1.4 临床资料随访在婴儿出生后6周、3个月、6个月时,进行门诊随访,记录AD的发生情况,诊断标准采用Williams标准[9]。以问卷方式采集婴儿的一般情况。
1.5 统计学分析采用SPSS 19.0统计软件包对数据进行统计学分析。计量资料采用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料采用百分率(%)表示,两组间比较采用χ2检验;采用受试者工作特征曲线(ROC)法评估脐血25(OH)D3对AD的诊断价值;采用logistic逐步回归分析AD发生的危险因素。P<0.05为差异有统计学意义。
2 结果 2.1 一般情况最终有67例婴儿全部完成了为期6个月的随访过程,纳入本研究,其中男36例(54%),女31例(46%);胎龄37~42周,平均胎龄279±7 d;出生体重2.56~4.63 kg,平均出生体重3.5±0.4 kg。出生时产妇的年龄为17~38岁,平均年龄为27±4岁。
根据Williams标准,有23例婴儿被诊断为AD,发病率为34%(23/67),其中21例(91%)出现在生后的第1个月。我们将67例婴儿分为AD组(n=23)和健康对照组(n=44),两组在胎龄、性别、出生体重、出生季节、有无兄弟姐妹、有无被动吸烟史、母亲年龄、母亲学历及母孕期是否高蛋白饮食等方面比较差异均无统计学意义(P>0.05),而在有无特应性家族史、居住地、喂养方式、母孕期是否喜食海鲜或辛辣食物、脐血25(OH)D3水平等方面比较差异有统计学意义(P<0.05)。见表 1。
| 表 1 AD组和健康对照组婴儿一般情况比较 |
|
|
67例婴儿中,脐血25(OH)D3<30 nmol/L 21例,发生AD 12例(57%),脐血25(OH)D3≥30 nmol/L46例,发生AD 11例(24%),不同水平脐血25(OH)D3婴儿在AD发病率方面比较差异有统计学意义(χ2=7.062,P=0.008)。ROC分析结果显示:曲线下面积(AUC)为0.648,标准误为0.075,95%CI为0.502~0.795,灵敏度为52.2%,特异度为79.5%,阳性预测值为57.1%,阴性预测值为76.1%,故脐血25(OH)D3对AD的诊断价值较低。见图 1。
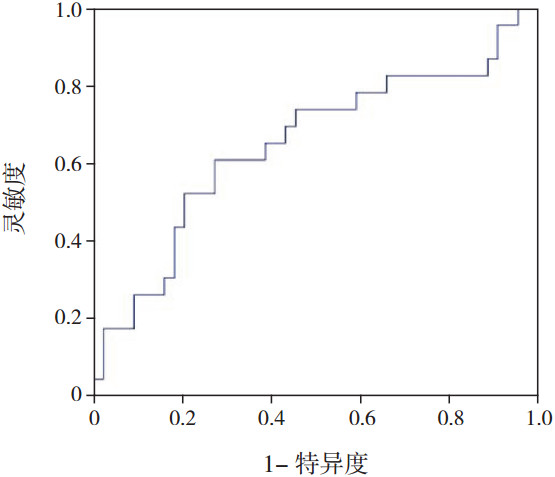
|
图 1 脐血25(OH)D3对婴儿AD诊断价值的ROC曲线 |
由表 1可知,在有无特应性家族史、喂养方式、居住地、母孕期是否喜食海鲜或辛辣食物、脐血25(OH)D3水平方面,AD组和健康对照组间比较差异有统计学意义(P<0.05)。将以上6个影响AD的因素作为自变量进行logistic逐步回归分析,结果显示,居住地为城市和母孕期喜食辛辣食物两个因素不进入回归方程(P>0.05),低脐血25(OH)D3水平、母孕期喜食海鲜、特应性家族史阳性、混合喂养4个因素是影响AD发生的危险因素(P<0.05)。见表 2。
| 表 2 AD影响因素的多因素logistic分析 |
|
|
AD是西方发达国家儿童最常见的疾病之一,其发病率呈现逐年上升的趋势,在发展中国家也是如此[10]。AD常常出现于生后的第1年,瘙痒是主要表现,夜间明显,患儿常常由于抓挠影响睡眠,进而影响患儿及其家庭的生活质量,此外,AD的慢性和复发性还会给家庭和社会带来巨大的经济负担。有研究显示,AD可发生于新生儿早期,提示在母体子宫内已经启动了致敏过程[11]。因此,寻找AD的早期监测指标,从而早期发现,及时干预,减少或预防婴儿AD的发生就显得尤为重要。
AD的发病机制包括免疫调节功能异常,皮肤屏障功能受损和对病原菌易感性增加[12],而维生素D对这些异常具有一定的调节作用[13]。维生素D的活化形式1, 25(OH)2D3可以促进巨噬细胞产生抗菌肽,可以减少树突状细胞的增殖和迁移,还可以促进CD4+ T细胞分化为调节性T细胞,进而调节Th1/Th2的平衡,抑制Th2反应,减少IL-4的产生,使B细胞合成的IgE减少,降低特应性疾病的发生风险[14]。因此,早期维生素D缺乏是导致AD发生的重要因素。这些生物学效应与既往观察性研究结果是一致的,进一步说明了维生素D水平与AD的关系,包括维生素D水平越低,AD发病率越高以及症状越严重[14]。
在本研究的67例婴儿中,脐血25(OH)D3水平为7.5~98.57 nmol/L,脐血25(OH)D3<30 nmol/L的有21例,占31%,其中有12例(57%)出现AD,而脐血25(OH)D3≥30 nmol/L的46例婴儿中,仅有11例(24%)出现AD,经统计学分析发现,两组AD的发病率比较差异有统计学意义,说明脐血25(OH)D3水平越低,其AD的发病率越高,这与Baiz等[15]、Jones等[16]的研究结果是一致的。本研究ROC结果显示灵敏度、特异度、阳性预测值、阴性预测值和AUC分别为52.2%、79.5%、57.1%、76.1%、0.648,因此,脐血25(OH)D3水平对AD的预测能力不高,尚不能作为一级预防的参考指征。
综上所述,脐血25(OH)D3水平与AD间呈现负性相关关系,但其对AD的预测能力较低。本研究由于时间限制,样本量太小、随访时间较短,以及实验设计等方面存在缺陷,其结果有待进一步确定。
| [1] |
Wallach D, Taieb A. Atopic dermatitis/atopic eczema[J]. Chem Immunol Allergy, 2014, 100: 81-96. DOI:10.1159/000358606 (  0) 0) |
| [2] |
Bieber T. Atopic dermatitis[J]. Ann Dermatol, 2010, 22(2): 125-137. DOI:10.5021/ad.2010.22.2.125 (  0) 0) |
| [3] |
Halken S, Host A, Hansen LG, et al. Effect of an allergy prevention programme on incidence of atopic symptoms in infancy. A prospective study of 159"high-risk" infants[J]. Allergy, 1992, 47(5): 545-553. DOI:10.1111/all.1992.47.issue-5 (  0) 0) |
| [4] |
White JH. Vitamin D signaling, infectious diseases, and regulation of innate immunity[J]. Infect Immun, 2008, 76(9): 3837-3843. DOI:10.1128/IAI.00353-08 (  0) 0) |
| [5] |
Sava F, Treszl A, Hajdú J, et al. Plasma vitamin D levels at birth and immune status of preterm infants[J]. Immunobiology, 2016, 221(11): 1289-1292. DOI:10.1016/j.imbio.2016.06.001 (  0) 0) |
| [6] |
Cizmeci MN, Kanburoglu MK, Akelma AZ, et al. Cord-blood 25-hydroxyvitamin D levels and risk of early-onset neonatal sepsis:a case-control study from a tertiary care center in Turkey[J]. Eur J Pediatr, 2015, 174(6): 809-815. DOI:10.1007/s00431-014-2469-1 (  0) 0) |
| [7] |
Çetinkaya M, Çekmez F, Erener-Ercan T, et al. Maternal/neonatal vitamin D deficiency:a risk factor for broncho-pulmonary dysplasia in preterms?[J]. J Perinatol, 2015, 35(10): 813-817. DOI:10.1038/jp.2015.88 (  0) 0) |
| [8] |
Dinlen N, Zenciroglu A, Beken S, et al. Association of vitamin D deficiency with acute lower respiratory tract infections in newborns[J]. J Matern Fetal Neonatal Med, 2016, 29(6): 928-932. DOI:10.3109/14767058.2015.1023710 (  0) 0) |
| [9] |
Williams HC, Burney PG, Hay RJ, et al. The U.K. Working Party's Diagnostic Criteria for Atopic Dermatitis. I. Derivation of a minimum set of discriminators for atopic dermatitis[J]. Br J Dermatol, 1994, 131(3): 383-396. DOI:10.1111/bjd.1994.131.issue-3 (  0) 0) |
| [10] |
Asher MI, Montefort S, Björkstén B, et al. Worldwide time trends in the prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and eczema in childhood:ISAAC Phases One and Three repeat multicountry cross-sectional surveys[J]. Lancet, 2006, 368(9537): 733-743. DOI:10.1016/S0140-6736(06)69283-0 (  0) 0) |
| [11] |
Gustafsson D, Sjöberg O, Foucard T. Development of allergies and asthma in infants and young children with atopic dermatitis-a prospective follow-up to 7 years of age[J]. Allergy, 2000, 55(3): 240-245. DOI:10.1034/j.1398-9995.2000.00391.x (  0) 0) |
| [12] |
Sugarman JL. The epidermal barrier in atopic dermatitis[J]. Semin Cutan Med Surg, 2008, 27(2): 108-114. DOI:10.1016/j.sder.2008.04.005 (  0) 0) |
| [13] |
Bikle DD. Vitamin D metabolism and function in the skin[J]. Mol Cell Endocrinol, 2011, 347(1-2): 80-89. DOI:10.1016/j.mce.2011.05.017 (  0) 0) |
| [14] |
Wang SS, Hon KL, Kong AP, et al. Vitamin D deficiency is associated with diagnosis and severity of childhood atopic dermatitis[J]. Pediatr Allergy Immunol, 2014, 25(1): 30-35. DOI:10.1111/pai.12167 (  0) 0) |
| [15] |
Baiz N, Dargent-Molina P, Wark JD, et al. Cord serum 25-hydroxyvitamin D and risk of early childhood transient wheezing and atopic dermatitis[J]. J Allergy Clin Immunol, 2014, 133(1): 147-153. DOI:10.1016/j.jaci.2013.05.017 (  0) 0) |
| [16] |
Jones AP, Palmer D, Zhang G, et al. Cord blood 25-hydroxyvitamin D3 and allergic disease during infancy[J]. Pediatrics, 2012, 130(5): e1128-e1135. DOI:10.1542/peds.2012-1172 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20

