头孢曲松在世界卫生组织基本药物标准清单中是卫生系统所需的最有效和最安全的药物之一[1],属于第三代头孢菌素,通过抑制细菌细胞壁粘肽的合成而起作用,因此常用于治疗呼吸道、泌尿道感染等。但使用头孢曲松也存在一些副作用包括皮疹、腹泻等,由于头孢曲松在儿童中使用频繁,近期有研究发现儿童使用头孢曲松导致溶血性贫血的案例[2],也有研究发现儿童使用头孢曲松可能引起肾后性急性肾功能衰竭[3]。
生命早期是机体生长发育的关键时期,在该阶段受到的影响可能伴随一生,肠道健康是机体正常生长的关键,机体各种生长发育及生理代谢与肠道菌群密切相关。已有众多研究表明,使用抗生素对机体体重[4]、肠道屏障功能[5]、肠道上皮细胞[6]及肠道菌群产生作用[7],并且已有研究发现短期的抗生素使用会造成长期的影响,单一剂量的克林霉素已被证明可诱导小鼠微生物群的组成发生显著变化,并因此赋予机体对艰难梭菌存在长期易感性[8]。流行病学调查也显示在生命第1年接受抗生素治疗会导致后期哮喘风险增加,且广谱头孢菌素的使用在这些儿童中最常见[9]。有动物实验也表明,若从母鼠妊娠期开始,而不是在乳鼠断奶时开始给予低剂量青霉素,小鼠会产生更强的生理改变[10]。
肠道菌群是机体的重要组成部分,菌群失调是某些疾病的重要因素,因此肠道菌群可作为治疗疾病的靶点。许多研究使用抗生素来破坏肠道菌群平衡,进而建立菌群失调模型,其中头孢曲松的应用已很常见[11-13]。研究发现大多数抗生素可从三个方面诱导肠道改变:即微生物群的消耗,抗生素对宿主组织的直接影响以及对抗生素存在耐药性的残留微生物发挥的作用[14],可见菌群在抗生素对肠道的影响上发挥着重要作用。
本课题组之前对1~21 d新生乳鼠进行抗生素灌胃的研究已证实抗生素可对早期肠道组织产生重要影响,对肠道菌群的改变具有重要意义[7]。本研究在之前研究的基础上,考虑到头孢曲松对乳鼠肠道具有更加显著的影响,针对头孢曲松这一种抗生素的作用做进一步探究,通过检测肠道组织结构、肠上皮细胞相关蛋白表达来观察早期头孢曲松干预对机体肠道上皮组织发育的影响;且基于肠道菌群的重要作用,利用最新的二代测序方法重点关注肠道菌群多样性、群落结构及各水平组成上的改变,深入探讨肠道菌群的作用;并且关注停止头孢曲松干预后到达小鼠成年期(56 d)时,早期对肠道组织的影响是否有所恢复。
1 材料与方法 1.1 实验动物及分组6只SPF级BALB/C孕鼠,孕龄13 d,购于四川省医学科学院实验动物研究所,饲养于塑料笼中,自由饮水饮食,环境温度23±1℃,湿度50%~70%,12 h昼夜循环。孕鼠分娩后共36只新生小鼠,随机分成对照组和实验组(n=18),实验组以100 mg/kg溶解于生理盐水的头孢曲松(上海阿拉丁生化科技股份有限公司)灌胃,出生后0~7 d灌胃量为10 μL,8~14 d为100 μL,15~21 d为200 μL,对照组在前21 d灌予等量生理盐水,两组从第22天开始停止灌胃,继续喂养至56 d。
1.2 试剂与仪器无水乙醇、二甲苯(上海国药集团化学试剂有限公司);EDTA(pH9.0)抗原修复液、BSA、苏木素染液、苏木素分化液、苏木素返蓝液、兔抗鼠Ki67单克隆抗体(1 : 500)、HRP标记山羊抗兔二抗、DAB显色试剂盒、EDTA(pH8.0)抗原修复液、自发荧光淬灭剂、抗荧光淬灭封片剂、DAPI(武汉赛维尔生物科技有限公司);兔抗鼠Muc2单克隆抗体(1 : 200)(Abcam, USA);兔抗鼠ZO-1单克隆抗体(1 : 200)、488山羊抗兔荧光二抗(1 : 400)(武汉谷歌生物科技有限公司);SYBR Premix Ex TaqⅡ(宝生物工程大连有限公司);粪便细菌总DNA提取试剂盒(北京天根生化科技北京有限公司);AMPure XT(Beckman Coulter Genomics, USA);Qubit试剂盒(Invitrogen, USA);粪便DNA V6-V8区引物(U968-F:5' -AACGCGAAGAACCTTAC-3' 和L1401-R:5' -CGGTGTGTACAAGACCC-3' ),16srRNA的V3-V4区引物(338F:5' -ACTCCTACGGGAGGCAGCAG-3' 和806R:5' -GGACTACHVGGGTWTCTAAT-3' )(上海生工生物工程股份有限公司)。
脱水机、包埋机、冻台(武汉俊杰电子有限公司),病理切片机(上海徕卡仪器有限公司),组织摊片机(浙江省金华市科迪仪器设备有限公司),脱色摇床、涡旋混合器(武汉赛维尔生物科技有限公司),正置荧光显微镜、成像系统(日本尼康),CFX96 system(Bio-Rad Laboratories, USA),二代测序由成都贝斯拜尔生物科技有限公司完成。
1.3 病理检测分别取生后第21天、第56天新生小鼠的整个肠道组织,10%磷酸盐缓冲溶液固定1 d,进行常规苏木精-伊红染色,显微镜下检测每只小鼠回肠及结肠部位至少12个区域20个绒毛和隐窝的深度。
1.4 免疫组织化学检测石蜡切片依次在二甲苯、酒精、蒸馏水中脱蜡水洗后,将组织切片置于抗原修复液修复盒中,于微波炉内进行抗原修复(Ki67用pH9.0的EDTA,Muc2用pH6.0的柠檬酸抗原修复缓冲液,ZO-1用pH8.0的EDTA),中火8 min,停火8 min,转中低火7 min,自然冷却后将玻片置于PBS(pH7.4)中,在脱色摇床上晃动洗涤3次,每次5 min。Ki67和Muc2需再放入3%双氧水溶液中,室温避光孵育25 min,继续将玻片置于PBS(pH7.4)中,在脱色摇床上晃动洗涤3次,每次5 min以阻断内源性过氧化物酶;ZO-1用组化笔在组织周围画圈,在圈内加入自发荧光淬灭剂5 min,流水冲洗10 min以淬灭荧光;再各自用3%BSA室温封闭30 min,轻轻甩掉封闭液,在切片上滴加按一定比例配好的一抗(Ki67、Muc2、ZO-1),切片平放于湿盒内4℃孵育过夜。脱色洗涤后加相应二抗室温孵育50 min,Ki67和Muc2加DAB显色液显色,再用苏木素和反蓝液复染细胞核,酒精、无水乙醇、二甲苯脱水后中性树胶封片;ZO-1加完抗体后直接用DAPI染液复染细胞核,抗荧光淬灭封片剂封片。最后各自进行镜检和图像采集,Ki67、Muc2阳性表达为棕黄色,ZO-1阳性表达为相应荧光素标记的亮绿色,采用Image-Pro Plus软件检测阳性区域的积分光密度值,每个部位切片至少采集5个视野进行检测,求得积分密度平均值。
1.5 DNA提取及细菌定量收集小鼠粪便冻存于-80℃,采用粪便细菌总DNA提取试剂盒提取DNA,进行实时荧光定量PCR扩增,标准曲线采用大肠杆菌DNA进行绝对定量,引物参考Biasucci等[15]选取V6-V8通用引物序列U968-F:5' -AACGCGAAGAACCTTAC-3' 和L1401-R:5' -CGGTGTGTACAAGACCC-3' ,结合SYBR Premix Ex TaqⅡ聚合酶于相应PCR仪中进行扩增。
1.6 二代测序引物5' 端连上特定的barcode以及通用引物。上游引物:338F:5' -ACTCCTACGGGAGGCA-GCAG-3' ,下游引物:806R:5' -GGACTACHVGGG-TWTCTAAT-3' [16]。反应体系:DNA模板50 ng,上下游引物各2.5 μL,Phusion Hot start flex 2X Master Mix(NEB,M0536L)12.5 μL,用ddH2O添加到25 μL进行PCR扩增;反应条件:98℃ 30 s;98℃ 10 s,54℃ 30 s,72℃ 45 s,35个循环。PCR产物经AMPure XT磁珠纯化后,用Qubit试剂盒定量,用Agilent 2100 Bioanalyzer检测扩增文库的大小,用Library Quantification Kit for Illumina试剂盒定量文库。PhiX Control library(v3)(Illumina)文库与扩增文库按比例(约30%)混合后上机测序。用bcl2fastq(v1.8.4)和FLASH软件(v1.2.11)对原始测序数据进行预处理,采用Qiime(v1.9.1)进一步分析序列,采用de novo UCLUST算法对优质序列按照97%的相似度聚类,得到OTU,并选取代表序列与Greengene数据库比对,得到物种分类信息,并生成OTU表。用PyNAST(v0.1)软件对代表性序列进行比对,然后使用FastTree(v2.1.7)构建进化树,再用qiime脚本计算α多样性指数(Ace、Chao1、Shannon、Simpson、PD_whole_tree)。用Qiime的python脚本DESeq2检测差异OTUs,P<0.01视为差异显著。用R包EDDA来实现Metastats在各分类水平下的物种差异分析,P<0.05视为差异显著。LEfSe分析用LDA算法来鉴定不同处理条件下的差异标志性物种。
1.7 统计学分析采用SPSS 22.0统计软件对数据进行统计学分析,符合正态分布的计量资料用均数±标准差(x±s)表示,两组均数比较采用独立样本t检验;不符合正态分布的计量资料以中位数(四分位间距)[M(P25,P75)]表示,两组间比较采用Wilcoxon秩和检验。P<0.05为差异有统计学意义。
2 结果 2.1 两组小鼠体重变化新生小鼠随着年龄的增长体重也持续上升,但与对照组相比,实验组体重普遍较低,干预的第7天和第21天实验组体重显著低于对照组(P<0.05),停止干预后从第28天持续到第56天,实验组体重未见恢复,均低于对照组(P<0.01),见图 1。

|
图 1 两组小鼠随年龄增长的体重变化 a示与对照组比较,P<0.05。 |
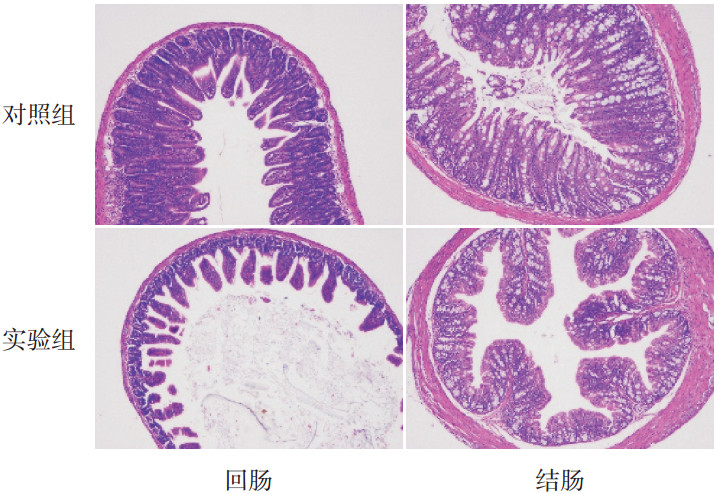
干预21 d时,对照组小鼠回肠和结肠部位绒毛排列整齐、致密且长短一致,结肠部位隐窝明显,大而整齐,深度较长;实验组小鼠回肠和结肠部位绒毛排列稀疏杂乱,且长短不一,隐窝呈现明显皱缩,深度缩短。见图 2。
|
图 2 两组小鼠回肠和结肠肠管绒毛及隐窝的病理组织切片(苏木精-伊红染色,×200) 可见与对照组相比,实验组绒毛长度及隐窝深度(空泡区域)都显著缩短。 |
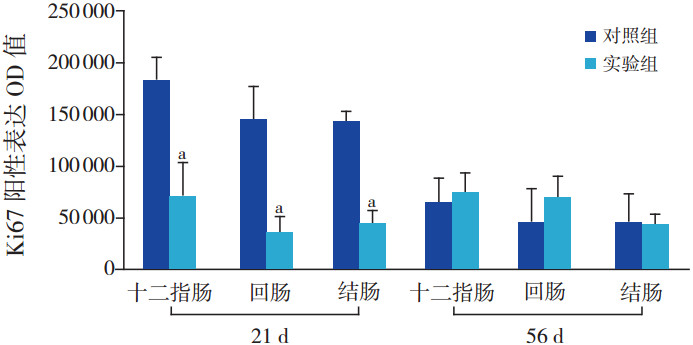
出生后21 d时,实验组小鼠十二指肠、回肠、结肠Ki67的阳性表达显著低于对照组(分别t=2.854、3.011、2.882,P<0.05);出生后56 d时,实验组小鼠十二指肠、回肠、结肠Ki67的阳性表达与对照组比较差异无统计学意义(P>0.05)。见图 3。
|
图 3 两组肠上皮细胞Ki67表达柱形图(21 d时n=6,56 d时n=12) a示与对照组比较,P<0.05。 |
出生后21 d时,实验组小鼠空肠及回肠Muc2黏蛋白的阳性表达显著高于对照组(分别t=-2.296、-2.130,P<0.05);出生后56 d时,实验组小鼠空肠及回肠Muc2黏蛋白的阳性表达与对照组比较差异无统计学意义(P>0.05)。见图 4。

|
图 4 两组肠上皮细胞Muc2表达柱形图(21 d时n=6,56 d时n=12) a示与对照组比较,P<0.05。 |
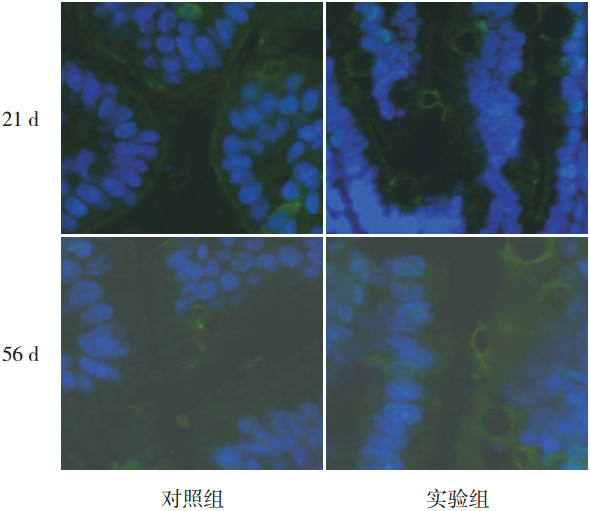
出生后21 d时,实验组小鼠回肠紧密连接蛋白ZO-1的阳性表达(100±29)低于对照组(617±326,t=1.579,P>0.05);出生后56 d时,实验组小鼠回肠紧密连接蛋白ZO-1的阳性表达(1 214±112)与对照组(1 723±212)比较差异无统计学意义(t=2.124,P>0.05),虽差异无统计学意义,但免疫荧光图片可见实验组ZO-1表达分散、稀疏、杂乱,而对照组ZO-1表达整齐紧密,见图 5。
|
图 5 两组回肠部位肠上皮细胞ZO-1的膜定位表达 ZO-1阳性表达呈亮绿色。对照组ZO-1表达整齐紧密,实验组ZO-1表达分散杂乱;21 d时对照组ZO-1表达高于实验组,56 d时两组ZO-1表达无显著差异。 |
实时荧光定量PCR检测结果发现:21 d实验组总细菌浓度显著低于对照组(P<0.01),56 d实验组总细菌浓度显著高于对照组(P<0.05)。
从丰富度指数(Ace和Chao1)和多样性指数(Shannon和Simpson)看,21 d实验组小鼠肠道菌群多样性和丰富度都显著高于对照组(P<0.05),56 d两组小鼠肠道菌群多样性和丰富度比较差异均无统计学意义(P>0.05)。21 d实验组小鼠谱系多样性指数(PD_whole_tree)明显高于对照组(P<0.05),56 d实验组小鼠PD_whole_tree显著低于对照组(P<0.05)。见表 1~2。
| 表 1 两组21 d时总细菌浓度及肠道菌群α-多样性结果比较 [x±s或M(P25,P75)] |
|
|
| 表 2 两组56 d时总细菌浓度及肠道菌群α-多样性结果比较 [x±s或M(P25,P75)] |
|
|
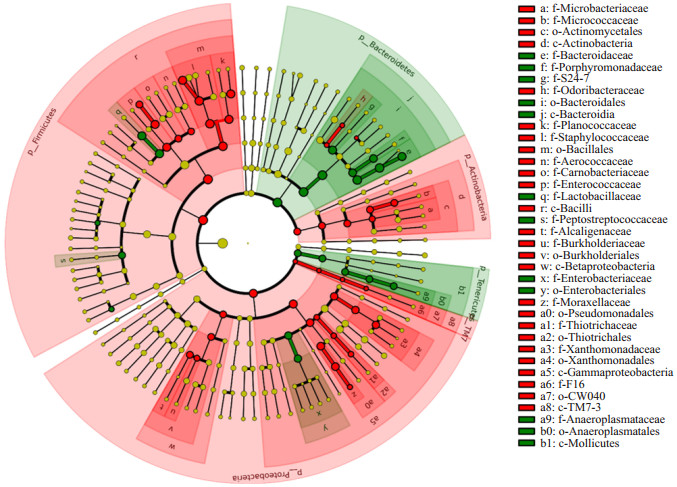
头孢曲松干预21 d的新生小鼠,其粪便细菌结构从门水平到属水平都有明显改变,且与对照组呈现显著差异。根据LEfSe分析,从整个粪便细菌组成看,实验组菌群丰度明显高于对照组,以芽孢杆菌目下的葡萄球菌科为主要特征菌,其次是肠球菌科;对照组以拟杆菌目下的拟杆菌科和乳杆菌目下的乳杆菌科为主要特征菌,见图 6。
|
图 6 两组小鼠生后21 d时粪便细菌结构分支树图 红色为实验组,绿色为对照组。扇形面积大小代表菌群丰富度。由中心向外辐射的扇形区域依次代表界(kingdom, k)、门(phylum, p)、类(class, c)、目(order, o)、科(family, f)、属(genus, g)各个分类水平。树枝中红色节点表示在实验组中起到重要作用的微生物类群,绿色节点表示在对照组中起到重要作用的微生物类群,黄色节点表示在两组中均没有起到重要作用的微生物类群。可见实验组主要节点集中在r区域c-Bacilli(杆菌类),其中m区域o-Bacillales(芽孢杆菌目)下的l区域f-Staphyloccaceae(葡萄球菌科)较突出,p区域f-Enterococcaceae(肠球菌科)(属乳杆菌目)也为特征菌;对照组主要节点集中在i区域o-Bacteroidales(拟杆菌目),其下的e区域f-Bacteroideaceae(拟杆菌科)为主要特征菌,r区域c-Bacilli(杆菌类)下的q区域f-Lactobacillaceae(乳杆菌科)(属乳杆菌目)也在对照组中起到重要作用。 |
相对丰度的组间差异比较可见,21 d时实验组门水平主要以厚壁菌门为主,其次是变形菌门;而对照组以拟杆菌门为主,厚壁菌门次之。实验组属水平上以葡萄球菌属、肠球菌属丰度显著高于对照组(P<0.01),而对照组拟杆菌属和乳酸菌属丰度显著高于实验组(P<0.05)。停止干预后,从第56天两组小鼠的肠道菌群发现,实验组相对对照组仍呈厚壁菌门显著偏高,但其次变为拟杆菌门;对照组无变化。在属水平上相对对照组,实验组出现了占显著优势的Akkermanisia属(P<0.05)。见表 3~4。
| 表 3 受试小鼠粪便细菌在门水平上的平均相对丰度 (x±s,%) |
|
|
| 表 4 受试小鼠粪便细菌在属水平上前5位优势菌的平均相对丰度 (x±s,%) |
|
|
国内外已有不少研究采用抗生素持续灌胃小鼠来作为肠道菌群紊乱模型,且已有研究发现抗生素干预21 d可造成小鼠肠道菌群明显改变[17],考虑到新生小鼠前21 d为其哺乳期与人类生命早期类似,在56 d时小鼠到达成年期,因此本研究以头孢曲松持续灌胃新生小鼠21 d造成其菌群紊乱为模型,推断生命早期使用抗生素造成的具体影响及其到达成年期恢复的可能性。
本研究发现,早期使用头孢曲松对小鼠的体重增加会造成明显影响,且在停止干预后体重未见恢复,到成年阶段实验组体重都显著低于对照组,说明头孢曲松的使用会对机体产生一定的副作用且影响可能持续存在。许多研究表明,抗生素的使用与肥胖有关,抗生素能促进机体生长且早期的作用对后期的影响更加明显[18],但也有研究发现万古霉素在干预期间使小鼠体重降低[19],阿莫西林对小鼠成年期生长无显著影响[20],因此我们推测抗生素对机体的影响与抗生素的类型、施用途径、研究对象生理状况等有关。
本研究中,头孢曲松干预使受试小鼠绒毛长度及隐窝深度缩短,Ki67表达的减少、紧密连接蛋白ZO-1膜定位表达降低,这些结果表明受试小鼠肠上皮细胞组织的构造及功能上均出现损伤,证实头孢曲松干预能显著影响肠上皮细胞增殖及肠黏膜功能的建立。本实验同时还发现头孢曲松干预使Muc2黏蛋白相对对照组呈显著增加趋势。有研究在探讨阿霉素对肠道损伤时指出,阿霉素可能直接作用于肠道细菌,导致快速的生态失调,继而导致对肠上皮的直接损伤,也可能破坏将肠上皮与肠腔细菌分开的物理屏障,如黏蛋白屏障[21],且已有发现抗生素直接作用于肠道的基因主要在隐窝和绒毛上皮中表达[14],也有相关数据表明受抗生素刺激小鼠肠内容物的蛋白质谱改变与肠道菌群失调有关[22]。本研究中发现肠道绒毛及隐窝、紧密连接蛋白受到了损伤,但Muc2黏蛋白表达却升高,提示头孢曲松可能直接作用于肠道组织或通过改变肠道细菌而产生作用,而Muc2黏蛋白的显著增加可认为是伴随头孢曲松干预引起的肠道组织或肠道细菌异常的机体自身的防御反应,从另一侧面再度证实头孢曲松干预能显著的影响肠上皮细胞增殖及肠黏膜功能。在停止干预后,到达小鼠成年期时各蛋白表达与对照组不再呈现显著差异,说明停止使用头孢曲松后其所造成的上皮细胞增殖及菌群损伤得到了一定程度恢复,Muc2黏蛋白相关的防御反应得到缓解。
本研究发现头孢曲松在干预期间小鼠肠道总细菌浓度显著降低;但二代测序结果显示实验组反映细菌丰富度的指数及反映菌群多样性的指数都显著高于对照组;而从群落结构看实验组以厚壁菌门和变形菌门为主,并含有大量的葡萄球菌和肠球菌,而对照组以拟杆菌门占优势,含有较多拟杆菌和乳酸菌。考虑到抗生素的抗菌谱和自身特性,推测头孢曲松可能杀灭了大多数正常菌群而导致总细菌浓度降低,却促进了很多潜在有害菌如葡萄球菌和肠球菌等的异常生长因而提升了肠道菌群的多样性及丰富度,这也与本课题组之前的研究结果一致[7]。有研究指出肠道拟杆菌和乳酸杆菌可发酵食物由来的植物性纤维产生短链脂肪酸,可被肠道上皮细胞吸收从而营养促进上皮细胞发育进而强化肠道屏障功能[23],而肠球菌、葡萄球菌等肠道潜在病原菌则具有诱发炎症的风险[24-25],头孢曲松干预引起的肠内细菌组成的改变,特别是引起的乳酸菌的缺乏,拟杆菌的显著减少,肠球菌、葡萄球菌等肠道潜在病原菌的增多,这可能是导致受试乳鼠肠黏膜损伤及肠上皮细胞功能低下的重要原因之一。停止干预后,第56天的受试小鼠肠道菌群结果显示,实验组总细菌含量上升,厚壁菌门和对照组相比仍显著偏多,拟杆菌门偏少,两组在属水平优势菌群的构成上同样存在显著差异,说明头孢曲松对肠道菌群的影响可部分延续到成年期。而实验组在属水平上出现了占一定优势的Akkermanisia属,Akkermanisia可降解黏蛋白,使肠道黏液层不断更新,并能产生寡糖和短链脂肪酸,对肠上皮细胞起到保护作用并促进其他肠内细菌的定植[26],本研究中头孢曲松干预使Muc2黏蛋白显著增加可认为是停止干预后Akkermanisia属显著上升的重要原因之一,Akkermanisia可能在肠道损伤的恢复中发挥了重要作用,且Akkermansia与肥胖呈负相关[26],这也可部分解释本研究后期实验组体重较对照组低的原因,但还需进一步研究。
综上,本研究证明早期头孢曲松干预可显著影响肠道组织发育和功能分化,头孢曲松引起的肠道菌群异常可能是重要原因之一,停止干预后肠道组织的结构和功能有部分恢复,但考虑到成年期菌群仍存在差异且体重未见恢复,推测头孢曲松早期干预还可能继续影响机体生长发育及各种生理代谢。
| [1] |
Organization WH. WHO model list of essential medicines-19th List[DB/OL]. (2015-04). http://www.who.int/medicines/publications/essentialmedicines/en/.
(  0) 0) |
| [2] |
Vehapoğlu A, Göknar N, Tuna R, et al. Ceftriaxone-induced hemolytic anemia in a child successfully managed with intravenous immunoglobulin[J]. Turk J Pediatr, 2016, 58(2): 216-219. DOI:10.24953/turkjped.2016.02.016 (  0) 0) |
| [3] |
Li N, Zhou X, Yuan J, et al. Ceftriaxone and acute renal failure in children[J]. Pediatrics, 2014, 133(4): e917-e922. DOI:10.1542/peds.2013-2103 (  0) 0) |
| [4] |
Hebert M, Licursi M, Jensen B, et al. Single rapamycin administration induces prolonged downward shift in defended body weight in rats[J]. PLoS One, 2014, 9(5): e93691. DOI:10.1371/journal.pone.0093691 (  0) 0) |
| [5] |
Saleem B, Okogbule-Wonodi AC, Fasano A, et al. Intestinal barrier maturation in very low birth weight infants:relationship to feeding and antibiotic exposure[J]. J Pediatr, 2017, 183: 31-36. DOI:10.1016/j.jpeds.2017.01.013 (  0) 0) |
| [6] |
Li F, Wang H, Liu J, et al. Immunotoxicity of β-diketone antibiotic mixtures to zebrafish (danio rerio) by transcriptome analysis[J]. PLoS One, 2016, 11(4): e0152530. DOI:10.1371/journal.pone.0152530 (  0) 0) |
| [7] |
Cheng RY, Li M, Li SS, et al. Vancomycin and ceftriaxone can damage intestinal microbiota and affect the development of the intestinal tract and immune system to different degrees in neonatal mice[J]. Pathog Dis, 2017, 75(8): 1-9. (  0) 0) |
| [8] |
Buffie CG, Jarchum I, Equinda M, et al. Profound alterations of intestinal microbiota following a single dose of clindamycin results in sustained susceptibility to Clostridium difficile-induced colitis[J]. Infect Immun, 2012, 80(1): 62-73. DOI:10.1128/IAI.05496-11 (  0) 0) |
| [9] |
Kozyrskyj AL, Ernst P, Becker AB. Increased risk of childhood asthma from antibiotic use in early life[J]. Chest, 2007, 131(6): 1753-1759. DOI:10.1378/chest.06-3008 (  0) 0) |
| [10] |
Cox LM, Yamanishi S, Sohn J, et al. Altering the intestinal microbiota during a critical developmental window has lasting metabolic consequences[J]. Cell, 2014, 158(4): 705-721. DOI:10.1016/j.cell.2014.05.052 (  0) 0) |
| [11] |
Luo X, Zheng Y, Wen R, et al. Effects of ceftriaxone induced intestinal dysbacteriosis on lymphocytes in different tissues in mice[J]. Immunobiology, 2016, 221(9): 994-1000. DOI:10.1016/j.imbio.2016.04.003 (  0) 0) |
| [12] |
Li M, Li W, Wen S, et al. Effects of ceftriaxone-induced intestinal dysbacteriosis on dendritic cells of small intestine in mice[J]. Microbiol Immunol, 2013, 57(8): 561-568. DOI:10.1111/mim.v57.8 (  0) 0) |
| [13] |
Gao F, Li M, Liu Y, et al. Intestinal dysbacteriosis induces changes of T lymphocyte subpopulations in Peyer's patches of mice and orients the immune response towards humoral immunity[J]. Gut Pathog, 2012, 4(1): 19. DOI:10.1186/1757-4749-4-19 (  0) 0) |
| [14] |
Morgun A, Dzutsev A, Dong X, et al. Uncovering effects of antibiotics on the host and microbiota using transkingdom gene networks[J]. Gut, 2015, 64(11): 1732-1743. DOI:10.1136/gutjnl-2014-308820 (  0) 0) |
| [15] |
Biasucci G, Benenati B, Morelli L, et al. Cesarean delivery may affect the early biodiversity of intestinal bacteria[J]. J Nutr, 2008, 138(9): 1796S-1800S. DOI:10.1093/jn/138.9.1796S (  0) 0) |
| [16] |
Ren D, Gong S, Shu J, et al. Mixed lactobacillus plantarum strains inhibit staphylococcus aureus induced inflammation and ameliorate intestinal microflora in mice[J]. Biomed Res Int, 2017, 2017: 7476467. (  0) 0) |
| [17] |
Puhl NJ, Uwiera RR, Yanke LJ, et al. Antibiotics conspicuously affect community profiles and richness, but not the density of bacterial cells associated with mucosa in the large and small intestines of mice[J]. Anaerobe, 2012, 18(1): 67-75. DOI:10.1016/j.anaerobe.2011.12.007 (  0) 0) |
| [18] |
Trasande L, Blustein J, Liu M, et al. Infant antibiotic exposures and early-life body mass[J]. Int J Obes (Lond), 2013, 37(1): 16-23. DOI:10.1038/ijo.2012.132 (  0) 0) |
| [19] |
Murphy EF, Cotter PD, Hogan A, et al. Divergent metabolic outcomes arising from targeted manipulation of the gut microbiota in diet-induced obesity[J]. Gut, 2013, 62(2): 220-226. DOI:10.1136/gutjnl-2011-300705 (  0) 0) |
| [20] |
Morel FB, Oosting A, Piloquet H, et al. Can antibiotic treatment in preweaning rats alter body composition in adulthood?[J]. Neonatology, 2013, 103(3): 182-189. DOI:10.1159/000345201 (  0) 0) |
| [21] |
Rigby RJ, Carr J, Orgel K, et al. Intestinal bacteria are necessary for doxorubicin-induced intestinal damage but not for doxorubicin-induced apoptosis[J]. Gut Microbes, 2016, 7(5): 414-423. DOI:10.1080/19490976.2016.1215806 (  0) 0) |
| [22] |
Tan L, Wen S, Sun MZ, et al. Changes in protein profile in cecum of mouse with intestinal dysbacteriosis induced by ceftriaxone sodium[J]. J Hard Tissue Biol, 2011, 20(2): 93-98. DOI:10.2485/jhtb.20.93 (  0) 0) |
| [23] |
Wang S, Li Q, Zang Y, et al. Apple polysaccharide inhibits microbial dysbiosis and chronic inflammation and modulates gut permeability in HFD-fed rats[J]. Int J Biol Macromol, 2017, 99: 282-292. DOI:10.1016/j.ijbiomac.2017.02.074 (  0) 0) |
| [24] |
Strickertsson JA, Desler C, Martin-Bertelsen T, et al. Enterococcus faecalis infection causes inflammation, intracellular oxphos-independent ROS production, and DNA damage in human gastric cancer cells[J]. PLoS One, 2013, 8(4): e63147. DOI:10.1371/journal.pone.0063147 (  0) 0) |
| [25] |
Hong SW, Kim MR, Lee EY, et al. Extracellular vesicles derived from Staphylococcus aureus induce atopic dermatitis-like skin inflammation[J]. Allergy, 2011, 66(3): 351-359. DOI:10.1111/all.2011.66.issue-3 (  0) 0) |
| [26] |
秦倩倩, 张玲, 王国庆. 肠道细菌Akkermansia muciniphila及其与宿主疾病的关系[J]. 卫生研究, 2017, 46(5): 856-860. (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


