早产儿脑损伤大多因缺氧缺血、感染、围产期并发症等造成,胎龄23~32周是白质发育的高峰期,此阶段脑白质中多数为晚期少突胶质前体细胞(oligodendrocyte precursor cells, OPCs),OPCs是少突胶质细胞(oligodendrocytes, OLs)的幼稚阶段,其对氧化应激等损伤具有高度敏感性,因此早产儿脑损伤多以OPCs丢失造成的脑白质损伤为主要病理损伤类型[1-2]。OLs是形成髓鞘的主要细胞,髓鞘的功能除了实现生物电信号的传导,亦对轴突提供营养支持[3-4],持续的脱髓鞘会造成轴突的丢失,进而导致运动和感觉功能障碍。目前早产儿脑白质损伤尚无有效的治疗措施,幸存的患儿大多会经受神经发育后遗症如脑瘫、认知及行为功能障碍等,对家庭和社会造成极大负担[1]。研究发现细胞移植是治疗脑损伤极有前景的治疗措施之一,移植的细胞不仅可替代损伤的细胞发挥生物功能,还可通过旁分泌作用改变组织的微环境,发挥神经保护作用[5]。虽然足月儿及成年脑损伤动物模型的细胞移植实验已广泛开展,但对于细胞移植治疗早产儿脑损伤的报道甚少[6-8]。OPCs兼有迁移和髓鞘化能力,是治疗白质损伤最佳的种子细胞,其他细胞,即便是可产生OPCs的神经干细胞,其体内分化为OLs并形成髓鞘的比例非常低,而间充质干细胞等也很难在中枢神经系统生成髓鞘,移植到脑内很难发挥细胞替代作用[9]。一些临床前实验报道了OPCs移植在脑白质营养不良、多发性硬化、脊髓损伤等白质损伤中具有良好的疗效,因此OPCs有望成为治疗早产儿脑白质损伤理想的移植细胞[6-7]。
1 OLs成熟与髓鞘化调控OLs由神经前体细胞分化而来,神经前体细胞最先分化为OPCs,OPCs进而增殖分化,形成幼稚OLs,进一步成熟形成表达髓鞘蛋白的成熟OLs[2]。
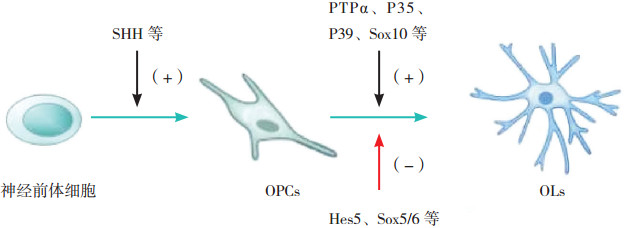
OLs的成熟及髓鞘形成受一系列细胞内外信号的调控,如SHH因子(sonic hedgehog)由神经脊索和底板分泌,其可与神经前体细胞上的Notch-1受体结合,诱导神经前体细胞向OPCs分化[10];蛋白酪氨酸磷酸酶α(protein tyrosine phosphatase alpha, PTPα)广泛存在于脑组织中,它能抑制OPCs的增殖,诱导OPCs退出细胞周期并促进其分化。进一步研究发现,OPCs内PTPα的主要作用是促进髓鞘的延伸,而神经元中的PTPα主要作用是促进髓鞘成熟[11]。Luo等[12]报道了细胞周期蛋白依赖性激酶5的激活剂P35及P39是调节髓鞘形成的重要因子:当P35或P39缺失时可导致OLs成熟障碍,而两者均缺失则完全抑制了OLs的成熟与髓鞘化。除此之外,髓鞘成熟受一些转录因子的调节,如Hes5、Sox5/6等负性调节髓鞘的成熟分化,而Sox10、髓鞘基因调控因子等对髓鞘成熟具有积极作用[2];一些调节表观遗传的分子如组蛋白去乙酰化酶及MicroRNA等还可通过转录及转录后水平调控髓鞘的发育[2, 13-15]。见图 1。
|
图 1 OLs的成熟及髓鞘化调控 少突胶质细胞(OLs)的成熟及髓鞘化受一系列信号的调控,例如SHH因子可诱导神经前体细胞向少突胶质前体细胞(OPCs)分化;PTPα、P35、P39、Sox10等对OPCs的分化及髓鞘成熟具有促进作用;Hes5、Sox5/6等负性调节OPCs的分化及髓鞘成熟。 |
OPCs极易受感染或缺氧缺血等氧化应激的影响,当发生弥漫性脑白质损伤时,白质中炎症区的OPCs数量可增加数倍,但由于受活化的星型胶质细胞及小胶质细胞等导致的炎症反应及局部酸性微环境的影响,即使存在大量完整的轴突,增殖的OPCs也不能按正常的分化轨迹发育成熟为OLs[1-2, 16]。Xie等[17]报道了在感染造成的新生鼠脑室周围白质损伤中,小胶质细胞来源的IL-1β可抑制OPCs的增殖与成熟,导致轴突髓鞘化的比例降低且髓鞘的厚度变薄。Shiow等[18]发现在炎症造成的白质损伤中,活化的星型胶质细胞可诱导COX2-PGE2信号通路,抑制少突胶质细胞的成熟。
2 OPCs的获取OPCs的获取方法有:(1)由多功能干细胞分化而来。多功能干细胞的来源有胚胎干细胞及体细胞诱导的诱导型多功能干细胞[19-20],胚胎干细胞来源的OPCs属于同种异体细胞,有发生免疫排斥的可能,另外胚胎干细胞的应用存在伦理学争议。诱导型多功能干细胞是通过对人体细胞加工,使其重新获得干细胞表型[21],由于来源于自体细胞,因此降低了免疫排斥的可能性[22],一些研究通过多功能干细胞3D培养模式或过表达转录因子Sox10及Olig2等方法[23-24],可以加速OPCs的形成并提高产量,因此由诱导型多功能干细胞获取OPCs是具有前景的策略。但这种方法亦有局限性,从多功能干细胞形成OPCs需要较长的时间,过程十分繁琐,并且得到的细胞有可能发生突变[6],需要利用基因编辑等技术纠正潜在的突变[18, 25]。
(2)由胚胎脑组织诱导形成的神经干细胞中获得。Lu等[26]报道了用流产的孕10~13周的人胚胎脑组织,经传代扩增得到神经干细胞,再经体外诱导培养获得OPCs,这种方式的优点是一旦由胚胎脑组织获得神经干细胞,通过传代能使神经干细胞的数量剧增,因此由一个胚胎的脑组织就能得到大量的OPCs[27]。另外,该方法的流程相对简单,具有良好的重复性。
(3)从体细胞直接诱导形成。该方法直接跳过了多功能干细胞阶段,极大的节约了OPCs获取所需的时间,并且降低了致瘤风险,同时,采用自体细胞亦使免疫排斥的风险降低。但是目前仅通过此方法得到了小鼠的OPCs,该技术尚未实现人源性OPCs的制备[19, 25]。
(4)从胚胎脑组织中直接分离。目前该方法具有很大的局限性,因为脑组织中OPCs数量极为有限,采用该方法所得到的OPCs产量及纯度较低,难以开展后续的研究与治疗[25]。因此,还需进一步改进分离方法以获得更多的细胞。
3 OPCs移植对白质损伤的保护作用OPCs移植最主要的作用是替代白质中受损的OPCs及OLs。研究发现OPCs还可保护血脑屏障的完整性、降低神经元的凋亡。另外,早期的OPCs还可以分化为星型胶质细胞,其在白质中形成细胞支架,有利于OPCs的迁移与成熟。
3.1 成髓鞘作用OPCs具有良好的增殖迁移能力,移植的OPCs通过整合到脑组织中,进一步成熟为成髓鞘OLs并包绕轴突,恢复白质结构与功能。研究发现白质损伤后进行OPCs移植,移植的细胞会快速作出反应:OPCs能产生基质蛋白金属酶9,该酶可增加血脑屏障的通透性,使OPCs能够通过血脑屏障进入脑组织,替代受损的细胞形成髓鞘[28]。Chen等[9]在新生大鼠脑室周围白质损伤模型中进行了鼠源OPCs的侧脑室移植,发现移植后OPCs可迁移至胼胝体、脑室周围白质以及扣带回,并形成了髓鞘,经治疗后大鼠的空间学习及记忆能力得到了明显的改善,表明移植的OPCs成功整合到了宿主脑组织中。吴成君等[29]也在白质损伤大鼠模型中移植了人源性OPCs,结果发现移植后髓鞘的厚度增加,受损的白质结构得到了恢复,说明OPCs具有良好的成髓鞘作用。
3.2 血脑屏障保护缺氧缺血等损伤会造成血脑屏障通透性增加,外周免疫细胞可通过受损的血脑屏障进入脑组织,加重神经炎症反应。研究发现OPCs除了可以修复髓鞘结构,还可与血脑屏障的血管内皮细胞及周细胞相互作用,保护血脑屏障的完整性[2, 30]。Yuen等[31]发现OPCs中的缺氧诱导因子可通过刺激内皮细胞增殖,促进中枢神经系统血管生成,血脑屏障的血管也由此得到修复[2]。Seo等[32]发现OPCs通过激活TGF-β信号通路促进紧密结合蛋白的表达并降低血脑屏障的通透性,从而保护血脑屏障的完整性。
3.3 神经保护作用OPCs还可发挥神经保护作用:在脑白质损伤模型中观察到,移植的OPCs可刺激损伤侧海马齿状回及脑室下区的神经干细胞发生内源性增生,并且明显降低了神经元的凋亡[9, 33]。他们亦发现OPCs促进了海马及皮质的脑源性神经营养因子及Bcl-2的表达,而这两种因子与降低神经元凋亡以及促进神经元增殖密切相关。除了OPCs能刺激脑组织产生神经保护因子外,OPCs亦可分泌各种活性因子参与神经功能的修复[9]。
3.4 多向分化潜能Wang等[34]发现对脱髓鞘小鼠进行OPCs移植后,OPCs在体内还可分化为星形胶质细胞,这些星型胶质细胞最先发育成熟并形成细胞支架,OPCs可依靠这些支架进行排列,分化为成熟的OLs,重塑白质结构。星形胶质细胞除了细胞支持作用,还可产生脑源性神经营养因子等,这些营养因子有利于OPCs的增殖与分化,提供了促进白质损伤修复的微环境[35]。但也有研究认为移植的OPCs在体内并不能分化形成星型胶质细胞,这可能与OPCs的不同阶段有关,早期OPCs仍有多向分化能力,因此能分化为星型胶质细胞[9]。
4 OPCs移植在脑白质损伤中的应用OPCs移植在早产脑白质损伤模型中的实验研究显示移植后白质损伤得到修复、髓鞘形成增加、神经元凋亡减少,实验动物的学习及记忆能力有所改善。除此之外,在其他脑白质损伤模型中的研究也发现OPCs移植能修复白质结构,延长生存时间。总结见表 1。
| 表 1 OPCs移植治疗脑白质损伤的研究 |
|
|
来源于多功能干细胞的OPCs中可能混杂有未分化的残余细胞,并且OPCs本身作为一种干细胞,理论上具有潜在的致瘤风险[6]。但现有的研究尚未发现OPCs移植的致瘤作用及基因型的不稳定,即使实验动物在接受OPCs移植后两年,也未观察到肿瘤形成[34]。可能因为由多功能干细胞分化为OPCs需要较长的时间,这期间足以有效的消除残余的未分化细胞。虽然似乎OPCs移植并无致瘤风险,但对于应用小分子重组等技术以及加速OPCs获取的实验方法,其致瘤风险仍需谨慎探究[19]。对于OPCs的临床应用,还需要有更长时间的观测,更高细胞密度的移植以及更多的动物实验来验证其安全性[19]。
5.2 免疫耐受相对于成人,新生儿的免疫系统不成熟,更易诱导形成免疫耐受。在新生鼠免疫系统中,新生的T细胞通常产生Th2型免疫应答,相比Th1及Th17型的促炎效应,Th2型免疫应答有助于保护供体细胞不受免疫排斥反应的损伤[38];另外,胸腺在免疫耐受中起到了重要作用,研究发现胸腺切除后将会造成急性的细胞排斥反应并导致耐受诱导的失败,由于成年后胸腺将逐渐退化消失,新生儿及婴幼儿期相对强大的胸腺使其拥有更强的免疫耐受能力,这可能与胸腺能产生的T细胞有关[39]。但是,对于不同的移植物其免疫耐受的机制各有不同,现有的研究尚不能阐明新生儿细胞移植中免疫耐受的机理,并且不同个体及不同发育阶段所能引起的免疫耐受程度各不相同,未来还需在相关领域进行大量的研究,从而为新生儿脑白质损伤的细胞移植提供可靠的参考[38]。
5.3 疗效白质损伤后,局部胶质细胞的激活及免疫细胞的浸润会形成炎性微环境,细胞外基质的成分也会发生改变,在这种环境下OPCs的存活及分化会受到很大的影响,移植的OPCs即使能迁移到脑组织中,也难以发挥显著的疗效。因此,若要提高OPCs移植的疗效,还需要阐明微环境抑制髓鞘形成的机制,并探索有效的微环境干预的方法[35, 40]。另外,研究报道OPCs的基因修饰或联合外源性因子治疗可以促进OPCs的成熟与分化[41-43],将来还应在这一领域进行大量的研究,以提供一个能最大化促进OPCs成髓鞘的治疗方案。
6 小结OPCs移植是目前治疗早产脑白质损伤最具潜力的治疗策略之一,外源的OPCs不仅可以迁移整合到受损脑组织,促进白质结构的恢复,还能抑制神经元的凋亡并促进内源性神经干细胞的增殖。但目前OPCs治疗早产脑白质损伤的研究还处于早期阶段,OPCs移植的致瘤以及免疫排斥等安全性问题还需要开展大量实验进行监测。OPCs移植的治疗机制、剂量、途径、移植时间以及移植对象的选择等问题还有待更深入的研究,以确定最佳的移植方案。另外,移植的OPCs可能会受到炎性微环境的损伤,导致OPCs无法存活并形成髓鞘,因此致力于改变炎性微环境状态的研究亦十分重要。总之,OPCs移植是治疗早产脑白质损伤较有前景的方法,其临床应用还面临着许多挑战,尚需大量的前期工作以确定OPCs移植的安全性及有效性。
| [1] |
Back SA. White matter injury in the preterm infant:pathology and mechanisms[J]. Acta Neuropathol, 2017, 134(3): 331-349. DOI:10.1007/s00401-017-1718-6 (  0) 0) |
| [2] |
van Tilborg E, Heijnen CJ, Benders MJ, et al. Impaired oligodendrocyte maturation in preterm infants:Potential therapeutic targets[J]. Prog Neurobiol, 2016, 136: 28-49. DOI:10.1016/j.pneurobio.2015.11.002 (  0) 0) |
| [3] |
Lee Y, Morrison BM, Li Y, et al. Oligodendroglia metabolically support axons and contribute to neurodegeneration[J]. Nature, 2012, 487(7408): 443-448. DOI:10.1038/nature11314 (  0) 0) |
| [4] |
Shimizu T, Osanai Y, Ikenaka K. Oligodendrocyte-neuron interactions:Impact on myelination and brain function[J]. Neurochem Res, 2018, 43(1): 181-185. DOI:10.1007/s11064-017-2387-5 (  0) 0) |
| [5] |
岳艳, 屈艺, 母得志. 间充质干细胞源性外泌体在脑损伤治疗中的研究进展[J]. 中国当代儿科杂志, 2017, 19(12): 1285-1290. (  0) 0) |
| [6] |
Scolding NJ, Pasquini M, Reingold SC, et al. Cell-based therapeutic strategies for multiple sclerosis[J]. Brain, 2017, 140(11): 2776-2796. DOI:10.1093/brain/awx154 (  0) 0) |
| [7] |
Assinck P, Duncan GJ, Plemel JR, et al. Myelinogenic plasticity of oligodendrocyte precursor cells following spinal cord contusion injury[J]. J Neurosci, 2017, 37(36): 8635-8654. DOI:10.1523/JNEUROSCI.2409-16.2017 (  0) 0) |
| [8] |
Chang YS, Ahn SY, Sung S, et al. Stem cell therapy for neonatal disorders:prospects and challenges[J]. Yonsei Med J, 2017, 58(2): 266-271. DOI:10.3349/ymj.2017.58.2.266 (  0) 0) |
| [9] |
Chen LX, Ma SM, Zhang P, et al. Neuroprotective effects of oligodendrocyte progenitor cell transplantation in premature rat brain following hypoxic-ischemic injury[J]. PLoS One, 2015, 10(3): e115997. (  0) 0) |
| [10] |
Itoh K, Maki T, Lok J, et al. Mechanisms of cell-cell interaction in oligodendrogenesis and remyelination after stroke[J]. Brain Res, 2015, 1623: 135-149. DOI:10.1016/j.brainres.2015.04.039 (  0) 0) |
| [11] |
Shih Y, Ly PTT, Wang J, et al. Glial and neuronal protein tyrosine phosphatase alpha (PTPα) regulate oligodendrocyte differentiation and myelination[J]. J Mol Neurosci, 2017, 62(3-4): 329-343. DOI:10.1007/s12031-017-0941-x (  0) 0) |
| [12] |
Luo F, Zhang J, Burke K, et al. The activators of cyclin-dependent kinase 5 p35 and p39 are essential for oligodendrocyte maturation, process formation, and myelination[J]. J Neurosci, 2016, 36(10): 3024-3037. DOI:10.1523/JNEUROSCI.2250-15.2016 (  0) 0) |
| [13] |
Xiao D, Qu Y, Pan L, et al. microRNAs participate in the regulation of oligodendrocytes development in white matter injury[J]. Rev Neurosci, 2018, 29(2): 151-160. (  0) 0) |
| [14] |
Tauheed AM, Ayo JO, Kawu MU. Regulation of oligodendrocyte differentiation:Insights and approaches for the management of neurodegenerative disease[J]. Pathophysiology, 2016, 23(3): 203-210. DOI:10.1016/j.pathophys.2016.05.007 (  0) 0) |
| [15] |
Huang J, Zhang L, Qu Y, et al. Histone acetylation of oligodendrocytes protects against white matter injury induced by inflammation and hypoxia-ischemia through activation of BDNF-TrkB signaling pathway in neonatal rats[J]. Brain Res, 2017. [Epub ahead of print] http://europepmc.org/abstract/MED/29155093
(  0) 0) |
| [16] |
Buser JR, Maire J, Riddle A, et al. Arrested preoligodendrocyte maturation contributes to myelination failure in premature infants[J]. Ann Neurol, 2012, 71(1): 93-109. DOI:10.1002/ana.v71.1 (  0) 0) |
| [17] |
Xie D, Shen F, He S, et al. IL-1β induces hypomyelination in the periventricular white matter through inhibition of oligodendrocyte progenitor cell maturation via FYN/MEK/ERK signaling pathway in septic neonatal rats[J]. Glia, 2016, 64(4): 583-602. DOI:10.1002/glia.22950 (  0) 0) |
| [18] |
Shiow LR, Favrais G, Schirmer L, et al. Reactive astrocyte COX2-PGE2 production inhibits oligodendrocyte maturation in neonatal white matter injury[J]. Glia, 2017, 65(12): 2024-2037. DOI:10.1002/glia.v65.12 (  0) 0) |
| [19] |
Goldman SA, Kuypers NJ. How to make an oligodendrocyte[J]. Development, 2015, 142(23): 3983-3995. DOI:10.1242/dev.126409 (  0) 0) |
| [20] |
Sharp J, Hatch M, Nistor G, et al. Derivation of oligodendrocyte progenitor cells from human embryonic stem cells[J]. Methods Mol Biol, 2011, 767: 399-409. DOI:10.1007/978-1-61779-201-4 (  0) 0) |
| [21] |
Li M, Suzuki K, Kim NY, et al. A cut above the rest:targeted genome editing technologies in human pluripotent stem cells[J]. J Biol Chem, 2014, 289(8): 4594-4599. DOI:10.1074/jbc.R113.488247 (  0) 0) |
| [22] |
Fox IJ, Daley GQ, Goldman SA, et al. Stem cell therapy. Use of differentiated pluripotent stem cells as replacement therapy for treating disease[J]. Science, 2014, 345(6199): 1247391. DOI:10.1126/science.1247391 (  0) 0) |
| [23] |
Rodrigues GMC, Gaj T, Adil MM, et al. Defined and scalable differentiation of human oligodendrocyte precursors from pluripotent stem cells in a 3D culture system[J]. Stem Cell Reports, 2017, 8(6): 1770-1783. DOI:10.1016/j.stemcr.2017.04.027 (  0) 0) |
| [24] |
Li P, Li M, Tang X, et al. Accelerated generation of oligodendrocyte progenitor cells from human induced pluripotent stem cells by forced expression of Sox10 and Olig2[J]. Sci China Life Sci, 2016, 59(11): 1131-1138. DOI:10.1007/s11427-016-0165-3 (  0) 0) |
| [25] |
Goldman SA, Nedergaard M, Windrem MS. Glial progenitor cell-based treatment and modeling of neurological disease[J]. Science, 2012, 338(6106): 491-495. DOI:10.1126/science.1218071 (  0) 0) |
| [26] |
Lu Y, Yang Y, Wang Z, et al. Isolation and culture of human oligodendrocyte precursor cells from neurospheres[J]. Brain Res Bull, 2015, 118: 17-24. DOI:10.1016/j.brainresbull.2015.08.008 (  0) 0) |
| [27] |
Wang C, Luan Z, Yang Y, et al. High purity of human oligodendrocyte progenitor cells obtained from neural stem cells:suitable for clinical application[J]. J Neurosci Methods, 2015, 240: 61-66. DOI:10.1016/j.jneumeth.2014.10.017 (  0) 0) |
| [28] |
Seo JH, Miyamoto N, Hayakawa K, et al. Oligodendrocyte precursors induce early blood-brain barrier opening after white matter injury[J]. J Clin Invest, 2013, 123(2): 782-786. (  0) 0) |
| [29] |
吴成君, 汪兆艳, 杨印祥, 等. 少突胶质前体细胞移植治疗早产儿脑白质损伤大鼠模型[J]. 中国当代儿科杂志, 2017, 19(9): 1003-1007. DOI:10.7499/j.issn.1008-8830.2017.09.014 (  0) 0) |
| [30] |
Maki T, Maeda M, Uemura M, et al. Potential interactions between pericytes and oligodendrocyte precursor cells in perivascular regions of cerebral white matter[J]. Neurosci Lett, 2015, 597: 164-169. DOI:10.1016/j.neulet.2015.04.047 (  0) 0) |
| [31] |
Yuen TJ, Silbereis JC, Griveau A, et al. Oligodendrocyte-encoded HIF function couples postnatal myelination and white matter angiogenesis[J]. Cell, 2014, 158(2): 383-396. DOI:10.1016/j.cell.2014.04.052 (  0) 0) |
| [32] |
Seo JH, Maki T, Maeda M, et al. Oligodendrocyte precursor cells support blood-brain barrier integrity via TGF-β signaling[J]. PLoS One, 2014, 9(7): e103174. DOI:10.1371/journal.pone.0103174 (  0) 0) |
| [33] |
Webber DJ, van Blitterswijk M, Chandran S. Neuroprotective effect of oligodendrocyte precursor cell transplantation in a long-term model of periventricular leukomalacia[J]. Am J Pathol, 2009, 175(6): 2332-2342. DOI:10.2353/ajpath.2009.090051 (  0) 0) |
| [34] |
Wang S, Bates J, Li X, et al. Human iPSC-derived oligodendrocyte progenitor cells can myelinate and rescue a mouse model of congenital hypomyelination[J]. Cell Stem Cell, 2013, 12(2): 252-264. DOI:10.1016/j.stem.2012.12.002 (  0) 0) |
| [35] |
Dooves S, van der Knaap MS, Heine VM. Stem cell therapy for white matter disorders:don't forget the microenvironment![J]. J Inherit Metab Dis, 2016, 39(4): 513-518. DOI:10.1007/s10545-016-9925-1 (  0) 0) |
| [36] |
Xu L, Ryu J, Hiel H, et al. Transplantation of human oligodendrocyte progenitor cells in an animal model of diffuse traumatic axonal injury:survival and differentiation[J]. Stem Cell Res Ther, 2015, 6: 93. DOI:10.1186/s13287-015-0087-0 (  0) 0) |
| [37] |
Givogri MI, Galbiati F, Fasano S, et al. Oligodendroglial progenitor cell therapy limits central neurological deficits in mice with metachromatic leukodystrophy[J]. J Neurosci, 2006, 26(12): 3109-3119. DOI:10.1523/JNEUROSCI.4366-05.2006 (  0) 0) |
| [38] |
Pan H, Gazarian A, Dubernard JM, et al. Transplant tolerance induction in newborn infants:mechanisms, advantages, and potential strategies[J]. Front Immunol, 2016, 7: 116. (  0) 0) |
| [39] |
Griesemer AD, Sorenson EC, Hardy MA. The role of the thymus in tolerance[J]. Transplantation, 2010, 90(5): 465-474. DOI:10.1097/TP.0b013e3181e7e54f (  0) 0) |
| [40] |
Alizadeh A, Karimi-Abdolrezaee S. Microenvironmental regulation of oligodendrocyte replacement and remyelination in spinal cord injury[J]. J Physiol, 2016, 594(13): 3539-3552. DOI:10.1113/JP270895 (  0) 0) |
| [41] |
Yao ZF, Wang Y, Lin YH, et al. Transplantation of PDGF-AA-overexpressing oligodendrocyte precursor cells promotes recovery in rat following spinal cord injury[J]. Front Cell Neurosci, 2017, 11: 79. (  0) 0) |
| [42] |
Jantzie LL, Miller RH, Robinson S. Erythropoietin signaling promotes oligodendrocyte development following prenatal systemic hypoxic-ischemic brain injury[J]. Pediatr Res, 2013, 74(6): 658-667. DOI:10.1038/pr.2013.155 (  0) 0) |
| [43] |
Kataria H, Alizadeh A, Shahriary GM, et al. Neuregulin-1 promotes remyelination and fosters a pro-regenerative inflammatory response in focal demyelinating lesions of the spinal cord[J]. Glia, 2018, 66(3): 538-561. DOI:10.1002/glia.v66.3 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20

