2. 郑州大学基础医学院, 河南 郑州 450001
早产具有较高的发生率,国外资料显示早产占分娩总数的5%~15%,多中心研究显示中国早产的发生率为8%[1-2]。当前我国二孩政策全面开放,高龄产妇增多,早产儿出生率呈增高趋势。随着围产医学发展及新生儿重症救护水平提高,早产儿存活率较前显著改善,但存活早产儿尤其极早、超早早产儿往往遗留有不同程度神经系统后遗症,如脑性瘫痪、视听障碍等,严重影响早产儿的生存质量。脑白质损伤是早产儿脑损伤最常见的类型[3]。目前早产儿脑损伤除对症支持治疗外尚缺乏有效的神经保护疗法。促红细胞生成素(erythropoietin, EPO)最初被用来防治早产儿贫血,后来被证实有神经保护作用[4-5]。本课题组发现早期重组人红细胞生成素(recombinant human erythropoietin, rhEPO)治疗能降低极早早产儿神经功能障碍的发生率并改善预后,且未见副作用[6]。目前国内外尚缺乏从形态学角度评价EPO对早产儿脑发育的影响。磁共振弥散张量成像(diffusion tensor imaging, DTI)可无创描述白质的走行方向及发育情况,DTI的常用参数部分各项异性(fractional anisotropy, FA)参数与髓鞘完整性、纤维致密性以及平行性呈正相关,可用于评估早产儿脑白质髓鞘化及脑白质细微结构变化[7-8]。本研究采用rhEPO对早产儿进行早期干预,应用DTI对早产儿脑白质髓鞘化及脑灰质发育进行定量评价,探讨rhEPO对早产儿脑白质发育的影响。
1 资料与方法 1.1 研究对象以2016年8月至2017年8月胎龄≤32周、出生体重 < 1 500 g、生后24 h内在郑州大学第三附属医院NICU住院的早产儿120例为研究对象,随机分为rhEPO组和对照组,2组早产儿均于纠正胎龄35~37周完成头部MRI、弥散加权成像(diffusion weighted imaging, DWI)、DTI检查。rhEPO组在对症支持治疗基础上于生后72 h内给予rhEPO(成都地奥九泓制药厂,批号:S19980007),每次500 IU/kg,静脉注射,隔日一次,持续2周(累积剂量3 500 IU/kg);对照组静脉注射等体积生理盐水,用法同rhEPO组。排除标准:有先天性发育异常、遗传代谢性疾病、严重感染、红细胞增多症、血小板减少症、惊厥等疾病的早产儿。入组后剔除未完成头颅核磁检查的早产儿:rhEPO组18例,其中死于新生儿呼吸窘迫综合征3例,死于重度支气管肺发育不良2例,因新生儿坏死性小肠结肠炎手术治疗1例,因支气管肺发育不良离氧不耐受无法行MRI检查4例,因经济条件受限拒绝MRI检查3例,纠正胎龄不足35周治愈出院5例;对照组21例,其中死于新生儿呼吸窘迫综合征4例,死于重度支气管肺发育不良2例,因新生儿坏死性小肠结肠炎手术治疗2例,因支气管肺发育不良离氧不耐受无法行MRI检查6例,因经济条件受限拒绝MRI检查2例,纠正胎龄不足35周治愈出院5例。最终81例纳入研究,rhEPO组42例、对照组39例。本研究获医院伦理委员会批准及知情同意,批准文号:2017伦理审第(62)号。
1.2 资料收集收集资料:(1)早产儿的基本情况如性别、出生胎龄、出生体重、MRI检查时的纠正胎龄及体重、1 min Apgar评分、5 min Apgar评分,以及肺表面活性物质使用 > 1次和机械通气情况;(2)母孕期情况;(3)是否存在并发症如支气管肺发育不良(bronchopulmonary dysplasia, BPD)、新生儿坏死性小肠结肠炎(necrotizing enterocolitis, NEC)、早产儿视网膜病(retinopathy of prematurity, ROP)、肺炎、败血症、新生儿胆汁淤积症、颅内出血(intracranial hemorrhage, ICH)、脑室周围白质软化(periventricular leukomalacia, PVL)、局灶性脑白质损伤(cerebral white matter damage, CWMD)、广泛性CWMD等。BPD定义为生后超过28天仍有氧依赖(吸入氧浓度 > 21%)[9]。败血症诊断依据2003年中华医学会儿科学分会新生儿学组制定的新生儿败血症诊疗方案[10]。新生儿胆汁淤积症、肺炎、NEC、ICH、PVL、ROP诊断参考第4版《实用新生儿学》[11]。局灶性CWMD即侧脑室前后角、半卵圆中心白质有单个或多个(< 3处)局灶性损伤;广泛性CWMD指病灶数 > 3处或深层脑白质受累,而不伴有皮层下白质受累[12]。
1.3 头部MRI检查及DTI图像处理分析患儿镇静(静脉注射苯巴比妥钠5 mg/kg)入睡后接受头颅MRI、DWI及DTI检查,头部采用海绵垫固定,外耳道置入棉球以减低扫描时噪音。应用Siemens SKYRA 3.0T超导核磁共振扫描仪,采用Head 20线圈。先行常规MRI扫描,扫描序列包括t2_qtse_tra_p2、t2_qtirm_tra_dark-fluid、t1_tir_tra、t1_qfl2d_sag及ep2d_diff_3scan_trace_p2。DTI扫描序列包括t1_mprage_sag_p2_iso、ep2d_diff_mddw_20_p2。t1_mprage_sag扫描参数为:TR 2 000 ms,TE 2.32 ms,层厚0.9 mm,FOV 240 mm,翻转角为8°,分辨率256×256,采集次数1,扫描时间4′40″。ep2d_diff_mddw扫描参数为:TR 3 700 ms,TE 92.0 ms,B值为0 mm2/s和1 000 mm2/s,层厚4.0 mm,层数25,间隔0 mm,FOV 220 mm,分辨率128×128,激励次数1,扩散敏感梯度场的方向为20,扫描时间4′39″。
扫描完成后,图像资料自动导入Siemens syngo.via后处理站,生成FA图。严格选择同一层面上相对应解剖结构作为感兴趣区(region of interest, ROI),为避免邻近组织的影响,所选ROI小于所分析的解剖结构大小,包括内囊后肢、胼胝体压部、额叶白质、顶叶白质、枕叶白质、丘脑、豆状核及尾状核。手动绘制上述ROI,每个ROI大小控制在10±2 mm2,均放置于所测量解剖位置的中央(见图 1)。为了减少测量误差,每个部位FA值均测量3次,取平均值。双侧大脑半球对称部位FA值测量后取双侧FA值的平均值。
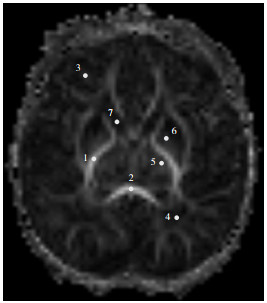
|
图 1 FA图ROI的选择 1.内囊后肢;2.胼胝体压部;3.额叶白质;4.枕叶白质;5.丘脑;6.豆状核;7.尾状核。注:[FA]部分各项异性;[ROI]感兴趣区。 |
采用SPSS 21.0软件进行数据处理。计量资料采用均数±标准差(x±s)表示,组间比较采用t检验;计数资料以率(%)表示,组间比较采用χ2检验或校正χ2检验。P < 0.05为差异有统计学意义。
2 结果 2.1 两组早产儿基本情况比较rhEPO组和对照组在性别、出生胎龄、出生体重、检查时胎龄、检查时体重、1 min Apgar评分、5 min Apgar评分、肺表面活性物质应用 > 1次所占比例、机械通气所占比例及机械通气时间方面的差异均无统计学意义(P > 0.05),见表 1。
| 表 1 两组早产儿基本情况比较 |
|
|
rhEPO组与对照组母孕期情况的差异无统计学意义(P > 0.05),见表 2。
| 表 2 两组早产儿母孕期情况比较 [例(%)] |
|
|
rhEPO组与对照组BPD、NEC、ROP、肺炎、败血症、新生儿胆汁淤积症等并发症发生率的差异无统计学意义(P > 0.05),见表 3。
| 表 3 两组早产儿并发症比较 [例(%)] |
|
|
根据头部MRI常规序列和DWI序列,rhEPO组和对照组的ICH、PVL、局灶性CWMD、广泛性CWMD等脑损伤发生率的差异无统计学意义(P > 0.05),见表 4。
| 表 4 两组早产儿脑损伤情况比较 [例(%)] |
|
|
rhEPO组内囊后肢、胼胝体压部、额叶白质、枕叶白质FA值高于对照组(P < 0.05);两组早产儿顶叶白质、丘脑、豆状核、尾状核FA值的差异无统计学意义(P > 0.05)。见表 5。
| 表 5 rhEPO组与对照组相同感兴趣区的FA值比较(x±s) |
|
|
新生儿脑损伤是导致新生儿死亡及神经系统后遗症的常见原因,目前缺乏有效的干预措施。对足月或近足月儿脑损伤可于生后6小时内采用相对特异性的亚低温治疗,但亚低温并不适用于早产儿脑损伤。
EPO是一种在缺氧诱导下肾脏产生的内源性糖蛋白,能作用于骨髓中的红系造血祖细胞,促进其增殖、分化。rhEPO最初广泛用于防治早产儿贫血[13]。近年来研究显示rhEPO通过抗氧化、抗凋亡、抗炎、促干细胞迁移、促血管生长等机制对脑损伤有保护作用[14-15]。此外,rhEPO还能促进神经再生、修复,保护少突胶质细胞[16]。本课题组曾用rhEPO对足月儿缺氧缺血性脑病和极早早产儿干预,发现其具有防治围产期脑损伤和改善远期神经预后的作用,且临床应用安全[6, 14]。因此,EPO有可能成为新型的多功能神经保护剂,有效改善早产儿脑损伤预后。
DTI是近年来在磁共振扩散成像的基础上发展起来的一种研究分子扩散特性的影像学方法,是目前唯一能够观察活体组织结构、髓鞘发育情况的无创性检查方法。DTI常用参数有FA和表观弥散系数。而在脑白质损伤评价方面,FA比表观弥散系数更准确[17]。一般认为,FA值的变化与轴突的完整性和髓鞘成熟度有关,FA值在脑损伤时降低,并且随着早产儿胎龄增大逐渐升高,反映的是脑白质髓鞘化程度[18]。应用DTI不仅能观察髓鞘成熟后的脑结构,对髓鞘化之前的脑结构同样可以定量评价[19-20]。因此,DTI对于反映脑内神经纤维的走行、髓鞘化程度有明显优势,通过FA值测定能定量评估白质纤维髓鞘发育及损伤情况。
早产儿脑白质主要由少突胶质前体细胞(premyelinating oligodendrocytes, pre-OLs)与神经元轴突构成,前者参与白质轴突髓鞘的形成,也是脑白质损伤时的主要靶细胞[21-22]。少突胶质细胞(oligodendrocyte, OL)的易损性是成熟依赖性的[12],小于32周早产儿的脑白质pre-OLs较多,损伤后可导致髓鞘化不良,引起白质减少及脑室扩大。本研究两组早产儿ICH、PVL、局灶性CDWD、广泛性CDWD等脑损伤发生率的差异无统计学意义;而rhEPO组内囊后肢、胼胝体压部、额叶白质、枕叶白质FA值高于对照组,提示rhEPO组脑白质髓鞘化程度高,rhEPO可促进早产儿脑白质髓鞘形成。有研究[23]通过动物实验也证实EPO可降低小胶质细胞活化并减少少突胶质细胞损伤,促进髓鞘形成。国外学者[24-25]使用大剂量rhEPO对早产儿行早期干预,通过弥散张量成像及基于纤维束示踪的空间统计学分析得出:早期使用rhEPO可促进早产儿脑白质的发育;但随访至2岁时两组的神经发育结局未见明显差异。因此,本研究团队拟进一步长期随访以确定rhEPO对早产儿远期神经预后的影响。丘脑、豆状核、尾状核属于灰质核团,主要由神经元和血管构成,轴突髓鞘和纤维含量少,本研究rhEPO组与对照组的丘脑、豆状核、尾状核FA值差异无统计学意义,可能rhEPO对灰质发育影响不大,也可能与样本量不足有关。
综上所述,通过弥散张量成像FA测定分析得出rhEPO对早产儿脑白质发育有保护性作用,可能与保护少突胶质细胞避免损伤并促进其成熟有关。后期需对这些纳入研究的早产儿进行长期随访,以进一步确定rhEPO对早产儿远期神经预后的影响。
| [1] |
Lawn JE, Blencowe H, Oza S, et al. Every newborn:progress, priorties, and potential beyond survival[J]. Lancet, 2014, 384(9938): 189-205. DOI:10.1016/S0140-6736(14)60496-7 (  0) 0) |
| [2] |
Zhao X, Chen Y, Qiu G, et al. Reducing preterm births in China[J]. Lancet, 2012, 380(9848): 1144-1145. (  0) 0) |
| [3] |
Woodward LJ, Anderson PJ, Austin NC, et al. Neonatal MRI to predict neurodevelopmental outcomes in preterm infants[J]. N Engl J Med, 2006, 355(7): 685-694. DOI:10.1056/NEJMoa053792 (  0) 0) |
| [4] |
Juul S. Recombinant erythropoietin as a neuroprotective treatment:in vitro and in vivo models[J]. Clin Perinatol, 2004, 31(1): 129-142. DOI:10.1016/j.clp.2004.03.004 (  0) 0) |
| [5] |
van der Kooij MA, Groenendaal F, Kavelaars A, et al. Neuroprotective properties and mechanisms of erythropoietin in in vitro and in vivo experimental models for hypoxia/ischemia[J]. Brain Res Rev, 2008, 59(1): 22-33. DOI:10.1016/j.brainresrev.2008.04.007 (  0) 0) |
| [6] |
Song J, Sun H, Xu F, et al. Recombinant human erythropoietin improves neurological outcomes in very preterm infants[J]. Ann Neurol, 2016, 80(1): 24-34. DOI:10.1002/ana.24677 (  0) 0) |
| [7] |
Pandit AS, Ball G, Edwards AD, et al. Diffusion magnetic resonance imaging in preterm brain injury[J]. Neuroradiology, 2013, 55(Suppl 2): 65-95. (  0) 0) |
| [8] |
李冰肖, 柳国胜, 凌雪英, 等. MRI和DTI评价早产儿脑白质髓鞘发育[J]. 中国当代儿科杂志, 2016, 18(6): 476-481. DOI:10.7499/j.issn.1008-8830.2016.06.002 (  0) 0) |
| [9] |
Jobe AH, Bancalari E. Bronchopulmonary dysplasia[J]. Am J Respir Crit Care Med, 2001, 163(7): 1723-1729. DOI:10.1164/ajrccm.163.7.2011060 (  0) 0) |
| [10] |
中华医学会儿科学分会新生儿学组. 新生儿败血症治疗方案[J]. 中华儿科杂志, 2003, 41(2): 897-899. (  0) 0) |
| [11] |
邵肖梅, 叶鸿瑁, 邱小汕. 实用新生儿科学[M]. 第4版. 北京: 人民卫生出版社, 2011, 110, 401-408, 477-483, 706-713, 715-719, 887-892.
(  0) 0) |
| [12] |
陈丹, 毛健, 李娟, 等. 晚期早产儿CWMD临床特点及磁共振影像学发现[J]. 中国当代儿科杂志, 2010, 12(5): 321-326. (  0) 0) |
| [13] |
Ohlsson A, Aher SM. Early erythropoietin for preventing red blood cell transfusion in preterm and/or low birth weight infants[J]. Cochrane Database Syst Rev, 2006, 5(3): CD004863. (  0) 0) |
| [14] |
Zhu C, Kang W, Xu F, et al. Erythropoietin improved neurologic outcomes in newborns with hypoxic-ischemic encephalopathy[J]. Pediatrics, 2009, 124(2): e218-226. DOI:10.1542/peds.2008-3553 (  0) 0) |
| [15] |
Juul SE, Pet GC. Erythropoietin and neonatal neuroprotection[J]. Clin Perinatol, 2015, 42(3): 469-481. DOI:10.1016/j.clp.2015.04.004 (  0) 0) |
| [16] |
Juul S. Neuroprotective role of erythropoietin in neonates[J]. J Matern Fetal Neonatal Med, 2012, 25(4): 105-107. (  0) 0) |
| [17] |
刘骁, 毛健, 李娟, 等. 早产儿微小型脑白质损伤的MRI-DTI评价[J]. 中国当代儿科杂志, 2015, 17(6): 554-559. DOI:10.7499/j.issn.1008-8830.2015.06.004 (  0) 0) |
| [18] |
Arfanakis K, Haughton VM, Carew JD, et al. Diffusion tensor MR imagine in diffuse axonal injury[J]. AJNR Am J Neuroradiol, 2002, 23(5): 794-802. (  0) 0) |
| [19] |
王淑霞. 3. 0 T MRI、扩散加权成像和扩散张量成像在早产儿脑病的应用研究[D]. 武汉: 华中科技大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10487-1013013096.htm
(  0) 0) |
| [20] |
Ling X, Tang W, Liu G, et al. Assessment of brain maturation in the preterm infants using diffusion tensor imaging (DTI) and enhanced T2 star weighted angiography (ESWAN)[J]. Eur J Radiol, 2013, 82(9): e476-483. DOI:10.1016/j.ejrad.2013.04.003 (  0) 0) |
| [21] |
Robinson S, Li Q, Dechant A, et al. Neonatal loss of gammaaminobutyric acid pathway expression after human perinatal brain injury[J]. J Neurosurg, 2006, 104(6): 396-408. (  0) 0) |
| [22] |
Back SA, Luo NL, Mallinson RA, et al. Selective vulnerability of preterm white matter to oxidative damage defined by F2-isoprostanes[J]. Ann Neurol, 2005, 58(1): 108-120. DOI:10.1002/ana.v58:1 (  0) 0) |
| [23] |
Liu W, Shen Y, Plane JM, et al. Neuroprotective potential of erythro-poietin and its derivative carbamylated erythropoietin in periventricular leukomalacia[J]. Experiment Neurol, 2011, 230(2): 227-239. DOI:10.1016/j.expneurol.2011.04.021 (  0) 0) |
| [24] |
O'Gorman RL, Bucher HU, Held U, et al. Tract-based spatial statistics to assess the neuroprotective effect of early erythropoietin on white matter development in preterm infants[J]. Brain, 2015, 138(Pt2): 388-397. (  0) 0) |
| [25] |
Natalucci G, Latal B, Koller B, et al. Effect of early prophylactic high-dose recombinant human erythropoietin in very preterm infants on neurodevelopmental outcome at 2 Years:A randomized clinical trial[J]. JAMA, 2016, 315(19): 2079-2085. DOI:10.1001/jama.2016.5504 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


