新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy, HIE)是新生儿期的常见病,重度HIE患儿的病死率较高,存活患儿容易出现认知、运动功能障碍,甚至脑瘫等严重神经系统后遗症[1-3]。
外泌体是细胞胞吐形成的细胞外囊泡,直径约30~200 nm,不仅可携带蛋白质、脂质、核酸等进行细胞间的信号传递,还具有载药功能,可应用于多种疾病的治疗。直径30~110 nm的外泌体可以通过血脑屏障,可能成为治疗HIE的新方法[4]。有研究发现星形胶质细胞可分泌多种物质来保护中枢神经系统[5],但这种保护作用是否是通过分泌外泌体来实现还需要进一步研究证实。本研究通过检测星形胶质细胞外泌体对缺氧神经元的保护作用,为探索缺氧缺血脑病新的治疗方法提供新策略。
1 材料与方法 1.1 主要试剂与仪器试剂:DMEM高糖培养基、DMEM无糖培养基、Neurobasal培养基、胎牛血清、PBS、B27、双抗和0.25%胰蛋白酶液(美国GIBCO公司);多聚赖氨酸、DNA酶I(DNAseI)、乳酸脱氢酶(LDH)试剂盒、PKH67染料(美国SIGMA公司);无外泌体胎牛血清(美国SBI公司);TUNEL凋亡检测试剂盒(美国PROMEGA公司);BCA试剂盒(上海碧云天生物技术有限公司);抗β-actin抗体、辣根过氧化物酶标记山羊抗兔和山羊抗小鼠IgG抗体(成都正能生物技术有限责任公司);小鼠抗大鼠ALIX单克隆抗体、小鼠抗大鼠CD63单克隆抗体(美国BIO-RAD公司);ECL发光液(北京全式金生物技术有限公司)。
仪器:生物安全柜(德国贝克公司);二氧化碳恒温培养箱(日本三洋公司);荧光显微镜(日本Nickon公司);微量移液器、低温离心机(德国Eppendorf公司);高速离心机、超高速离心机、离心管(美国贝克曼公司);外泌体粒径检测仪(英国Malvern公司);聚丙烯酰胺凝胶电泳(SDS-PAGE),垂直电泳系统及湿式膜转移系统(美国BIO-RAD公司)。
1.2 细胞培养取新生1 d Sprague-Dawley(SD)大鼠大脑皮层,剪碎,用0.25%胰蛋白酶以及30 μg/mL的DNAse I在恒温培养箱中消化15 min后吸去消化液,并加入提前配置的星形胶质细胞培养基(高糖DMEM+10%胎牛血清+1%双抗)终止消化,用1 mL移液器轻柔吹打后静置,待大块组织沉淀后吸取上清液过滤(70 μm细胞滤网),重复以上过程2次。以上过程均在冰上操作。将过滤后的细胞悬液反复轻柔吹打至单细胞悬液,以2.0×106个/mL的密度接种到多聚赖氨酸包被后的T-75培养瓶(星形胶质细胞)和24孔板(神经元)中,放入37℃、5% CO2培养箱中,2 d半量换液1次。
1.3 外泌体提取用PBS将星形胶质细胞清洗2次,用10%的无外泌体血清培养基替代10%的胎牛血清培养基继续培养48~72 h后收集细胞上清液,采用差速离心法提取出其中的外泌体,所有离心步骤均在4℃条件下完成,其他步骤均在冰上操作。具体过程如下:采用低温离心机1 200 r/min 10 min和3 200 r/min 20 min除去细胞碎片和死细胞;上清液采用贝克曼离心机15 000 r/min 45 min除去细胞碎片和大的细胞外囊泡;采用0.22 μm的过滤器过滤上清液;贝克曼离心机30 000 r/min 90 min提取外泌体;用PBS重悬离心后的沉淀重复离心1次;最后用50~100 μL PBS重悬沉淀保存于-80℃备用[6]。
1.4 外泌体鉴定透射电镜:用4%多聚甲醛重悬外泌体,滴5 μL于电镜网格,在干燥环境中固定20 min;PBS清洗,1%戊二醛孵育5 min;蒸馏水清洗共8次,每次2 min,铀酰草酸溶液(pH=7)孵育5 min,羟丙基甲基纤维素冰上孵育10 min;吸去多余液体,放置5~10 min后电镜下观察[6]。
Nanosight粒径分析:选择一次性干净的样品池,缓慢注入PBS重悬的外泌体溶液,避免气泡产生,用盖子遮住样品池并放入仪器,按照仪器操作规范上机检测。
Western blot:将提取的外泌体进行SDS-PAGE,随后转移至PVDF膜,脱脂奶粉封闭1 h后分别加入抗ALIX、CD63和β-actin抗体,4℃孵育过夜,清洗后加入辣根过氧化物酶标记的二抗,采用ECL发光液显色,用化学发光系统拍照分析。
1.5 BCA法检测外泌体蛋白浓度取10 μL外泌体与等量双蒸水混匀,加到96孔板中;取标准蛋白按0、1、2、4、8、12、16、20 μL量加到96孔板,不足20 μL的用双蒸水补足,最大浓度为0.5 μg/μL。将蛋白定量工作液B和A以50 : 1的比例混匀,以每孔200 μL量加入标准品和待测样品中(加液过程中避免气泡产生),放入30℃水浴锅孵育20~30 min后置于酶标仪,设置吸光度为A562 nm,测定吸光度值。根据标准品吸光度值绘制标准曲线,再根据标准曲线计算外泌体样品蛋白浓度(mg/mL)。
1.6 神经元氧糖剥夺模型建立与分组神经元贴壁生长6~7 d后分为对照组、外泌体组、氧糖剥夺(OGD)组和OGD+外泌体组。OGD组和OGD+外泌体组吸去培养基,用预缺氧(1% O2,5% CO2)的无糖DMED培养基清洗2次,在无糖DMEM培养基条件下放入37℃缺氧培养箱中培养2 h后,采用正常培养基清洗2次并给予正常神经元培养基[7]。外泌体组和OGD+外泌体组均加入终浓度22 μg/mL的外泌体,其他两组采用等体积PBS处理。之后均在正常条件下继续培养。
1.7 ELISA法检测LDH水平反映神经元死亡情况神经元经外泌体处理24 h后,取细胞上清以每孔50 μL量加入96孔板,每组3个复孔。将NADH以0、2、4、6、8、10 μL量加入96孔板,不足50 μL的用LDH分析缓冲液补足。将LDH分析缓冲液和基质混合液以24 : 1的比例混合均匀,以每孔50 μL量加入待测样品和标准品中,2~3 min后放置于酶标仪中,设置吸光度为A450 nm,测定起始吸光度值,之后每5 min测定1次,直到样品吸光度值超过标准品最高值,将倒数第2次定为最终值。根据标准品吸光度值绘制标准曲线,再根据标准曲线计算样品LDH值。每批细胞重复3次取其均数,共做3批细胞。
1.8 TUNEL检测神经元凋亡神经元经外泌体处理24 h后,吸去上清液,按照TUNEL试剂盒说明书检测神经元凋亡情况。具体过程如下,PBS清洗,4%多聚甲醛固定细胞,PBS清洗,0.2%Triton穿膜,PBS清洗,平衡缓冲液处理细胞,滴加rTdT孵育缓冲避光放置1 h,滴加TUNEL终止液15 min终止反应,PBS清洗,加入DAPI孵育5~10 min,PBS清洗,封片,荧光显微镜下观察。每批细胞重复3次取其均数,共做3批细胞。
1.9 统计学分析采用SPSS 24.0统计软件对数据进行统计学分析。计量资料采用均数±标准差(x ±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。方差不齐时,多组间比较采用Kruskal-Wallis H检验,组间两两比较采用Bonferroni法。P < 0.05为差异有统计学意义。
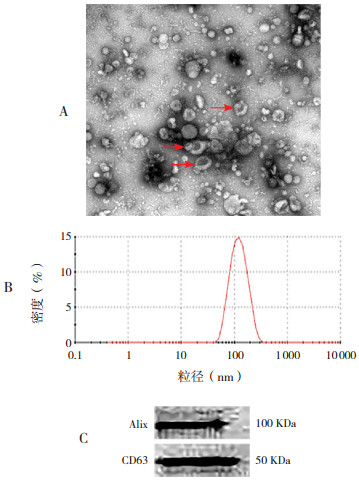
2 结果 2.1 外泌体鉴定透射电镜结果显示外泌体呈经典的杯口状形态[6];Nanosight结果显示外泌体粒径平均值为113.9 nm,且92.7%位于20~200 nm范围内;Western blot结果显示外泌体表面包含外泌体经典标记物CD63和Alix。见图 1。
|
图 1 星形胶质细胞外泌体鉴定结果 图A:透射电镜(×42 000)结果显示提取的外泌体符合经典的杯口状形态(箭头所示);图B:Nanosight结果显示外泌体粒径92.7%位于20~200 nm范围内;图C:Western blot结果显示外泌体表面携带有CD63和Alix。 |
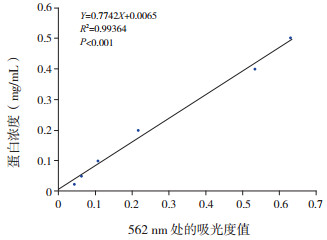
根据标准蛋白测定得到线性回归方程为Y=0.7742X+0.0065,R2=0.99364,回归方程有统计学意义(F=780.565,P < 0.001),可以认为562 nm处的吸光度值和蛋白浓度之间有直线回归关系。见图 2。
|
图 2 BCA法测定蛋白浓度 R2表示标准曲线拟合度的实际效果,R2=0.99364表示吸光度值可以推算99.36%的蛋白浓度。 |
通过此回归方程计算的外泌体蛋白浓度为1.11 mg/mL。
2.3 神经元死亡情况检测各组神经元LDH值比较差异有统计学意义(P < 0.001)。与对照组相比,OGD组LDH值显著增加(P < 0.05),说明OGD模型制作成功;外泌体组与对照组相比,LDH值差异无统计学意义(P > 0.05),说明外泌体在神经元未受OGD损伤时作用效果可能不明显;与OGD组相比,OGD+外泌体组LDH值显著降低(P < 0.05),说明外泌体能显著减少OGD神经元的损伤。见表 1。
| 表 1 各组大鼠大脑皮层神经元LDH水平及凋亡指数比较 |
|
|
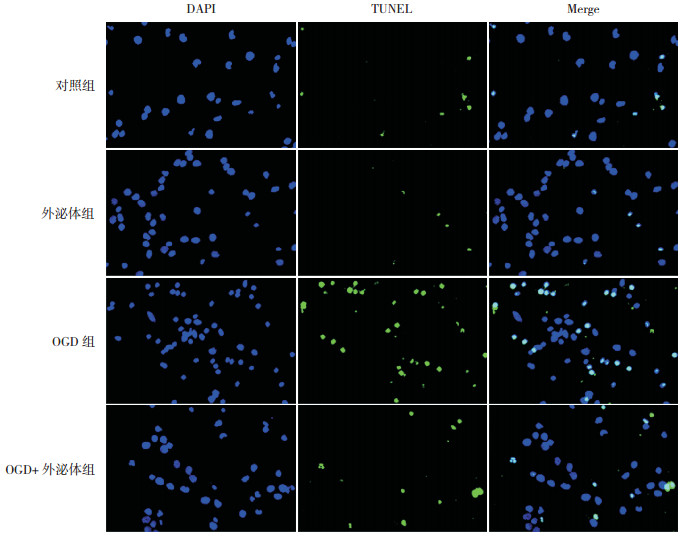
各组神经元凋亡指数比较差异有统计学意义(P < 0.001)。与对照组相比,OGD组凋亡指数显著增加(P < 0.05),说明OGD模型制作成功;外泌体组与对照组相比,凋亡指数差异无统计学意义(P > 0.05),说明外泌体在神经元未受OGD损伤时作用效果可能不明显;与OGD组相比,OGD+外泌体组凋亡指数显著降低(P < 0.05),说明外泌体能显著减少OGD神经元的损伤。见表 1,图 3。
|
图 3 TUNEL法检测神经元凋亡(×100) 蓝色为细胞核;绿色为TUNEL+细胞;蓝色和绿色的混合色表示TUNEL+ DAPI+细胞。混合色代表细胞凋亡。与对照组比较,OGD组凋亡数增加,OGD组经外泌体处理后,凋亡数减少。 |
发育期神经系统在缺氧缺血条件下,容易引起神经细胞的死亡,研究表明,神经细胞的死亡方式主要包括自噬、凋亡、坏死性凋亡等[8]。近年来,越来越多的研究发现凋亡参与了HIE的发生发展过程,抑制神经元凋亡对HIE治疗具有重要意义[9]。
Ophelders等[10]指出,缺氧缺血发生后,静脉注射神经源性间充质干细胞外泌体可改善大脑的功能,从而减少HIE带来的后遗症。Zhang等[11]发现间充质干细胞外泌体可以促进神经元轴突生成,这可能和miR-17-92相关。还有研究显示,牙源性干细胞外泌体可降低创伤性脑损伤导致的神经炎性反应,减少皮质损伤面积,改善脑损伤大鼠的运动功能[12],也有研究发现,创伤性脑损伤条件下,小胶质细胞外泌体miR-124-3p含量增加,可以抑制神经炎性反应,促进神经轴突生长[13]。上述研究证实了外泌体对神经系统具有保护作用。而作为神经系统的支持细胞,星形胶质细胞外泌体对缺氧缺血神经元产生保护作用及机制,是我们重点关注的问题。
既往研究显示星形胶质细胞通过多种途径释放神经营养因子等信号分子与中枢神经系统的其他细胞相互作用,这些信号分子对维持中枢神经系统的稳态起重要作用[5]。Zhang等[14]发现癌细胞转移至脑后,可释放信号分子诱导星形胶质细胞增生,而增生的星形胶质细胞可释放包含miR-19的外泌体,通过抑制同源性磷酸酶-张力蛋白(phosphatase and tensin homolog, PTEN)信号通路,增加趋化因子CCL-2的表达,进而抑制癌细胞的凋亡。还有研究显示,X线照射后的星形胶质细胞外泌体可以诱导肺细胞自噬[15],β样淀粉蛋白暴露的星形胶质细胞可释放携带热休克蛋白B1的外泌体,这可能对神经退行性变有保护作用[16]。这些研究提示星形胶质细胞外泌体可以发挥多种功能,而这些作用机制是否在缺氧缺血神经元中发挥功能还需要进一步研究。
本研究预实验发现神经元经OGD处理2 h能产生明显损伤,而星形胶质细胞则没有明显损伤。因此,我们认为星形胶质细胞经OGD处理2 h与对照没有明显的差异,故而从中提取的外泌体也没有明显的差异,从无OGD的星型胶质细胞中获取外泌体用于实验是符合缺氧缺血脑损伤的病理发展的。本研究采用差速离心法提取原代培养星形胶质细胞上清液中的外泌体,并分别将外泌体作用于神经元OGD组和对照组,检测结果显示OGD神经元经外泌体处理后LDH值和细胞凋亡数与对照组比较显著降低。因此,本研究结果提示,星形胶质细胞产生的外泌体可能运载信号分子对神经元产生保护作用,但星形胶质细胞外泌体如何激活下游分子还需要进一步研究。
综上所述,星形胶质细胞外泌体可减少缺氧缺血诱导的神经元凋亡。这一研究发现为HIE神经损伤提供了新的修复机制,外泌体的应用可望成为HIE治疗的新策略。
| [1] |
Shankaran S, Laptook AR, Ehrenkranz RA, et al. Wholebody hypothermia for neonates with hypoxic-ischemic encephalopathy[J]. N Engl J Med, 2005, 353(15): 1574-1584. DOI:10.1056/NEJMcps050929 (  0) 0) |
| [2] |
Edwards AD, Brocklehurst P, Gunn AJ, et al. Neurological outcomes at 18 months of age after moderate hypothermia for perinatal hypoxic ischaemic encephalopathy:synthesis and meta-analysis of trial data[J]. BMJ, 2010, 340: c363. DOI:10.1136/bmj.c363 (  0) 0) |
| [3] |
Pappas A, Shankaran S, McDonald SA, et al. Cognitive outcomes after neonatal encephalopathy[J]. Pediatrics, 2015, 135(3): e624-e634. DOI:10.1542/peds.2014-1566 (  0) 0) |
| [4] |
黄静兰, 康冰瑶, 屈艺, 等. 外泌体对缺血再灌注器官损伤的保护作用[J]. 中国修复重建外科杂志, 2017, 31(6): 751-754. (  0) 0) |
| [5] |
Verkhratsky A, Matteoli M, Parpura V, et al. Astrocytes as secretory cells of the central nervous system:idiosyncrasies of vesicular secretion[J]. EMBO J, 2016, 35(3): 239-257. DOI:10.15252/embj.201592705 (  0) 0) |
| [6] |
Théry C, Amigorena S, Raposo G, et al. Isolation and characterization of exosomes from cell culture supernatants and biological fluids[J]. Curr Protoc Cell Biol, 2006, 30(1): 3.22.1-3.22.29. DOI:10.1002/0471143030.2006.30.issue-1 (  0) 0) |
| [7] |
Qu Y, Mao M, Zhao F, et al. Proapoptotic role of human growth and transformation-dependent protein in the developing rat brain after hypoxia-ischemia[J]. Stroke, 2009, 40(8): 2843-2848. DOI:10.1161/STROKEAHA.109.553644 (  0) 0) |
| [8] |
Qu Y, Shi J, Tang Y, et al. MLKL inhibition attenuates hypoxiaischemia induced neuronal damage in developing brain[J]. Exp Neurol, 2016, 279: 223-231. DOI:10.1016/j.expneurol.2016.03.011 (  0) 0) |
| [9] |
Zhu J, Qu Y, Lin Z, et al. Loss of PINK1 inhibits apoptosis by upregulating α-synuclein in inflammation-sensitized hypoxicischemic injury in the immature brains[J]. Brain Res, 2016, 1653: 14-22. DOI:10.1016/j.brainres.2016.10.009 (  0) 0) |
| [10] |
Ophelders DR, Wolfs TG, Jellema RK, et al. Mesenchymal stromal cell-derived extracellular vesicles protect the fetal brain after hypoxia-ischemia[J]. Stem Cells Transl Med, 2016, 5(6): 754-763. DOI:10.5966/sctm.2015-0197 (  0) 0) |
| [11] |
Zhang Y, Chopp M, Liu XS, et al. Exosomes derived from mesenchymal stromal cells promote axonal growth of cortical neurons[J]. Mol Neurobiol, 2017, 54(4): 2659-2673. DOI:10.1007/s12035-016-9851-0 (  0) 0) |
| [12] |
Li Y, Yang YY, Ren JL, et al. Exosomes secreted by stem cells from human exfoliated deciduous teeth contribute to functional recovery after traumatic brain injury by shifting microglia M1/M2 polarization in rats[J]. Stem Cell Res Ther, 2017, 8(1): 198. DOI:10.1186/s13287-017-0648-5 (  0) 0) |
| [13] |
Huang S, Ge X, Yu J, et al. Increased miR-124-3p in microglial exosomes following traumatic brain injury inhibits neuronal inflammation and contributes to neurite outgrowth via their transfer into neurons[J]. FASEB J, 2018, 32(1): 512-528. DOI:10.1096/fj.201700673R (  0) 0) |
| [14] |
Zhang L, Zhang S, Yao J, et al. Microenvironment-induced PTEN loss by exosomal microRNA primes brain metastasis outgrowth[J]. Nature, 2015, 527(7576): 100-104. DOI:10.1038/nature15376 (  0) 0) |
| [15] |
Cai S, Shi GS, Cheng HY, et al. Exosomal miR-7 mediates bystander autophagy in lung after focal brain irradiation in mice[J]. Int J Biol Sci, 2017, 13(10): 1287-1296. DOI:10.7150/ijbs.18890 (  0) 0) |
| [16] |
Nafar F, Williams JB, Mearow KM. Astrocytes release HspB1 in response to amyloid-β exposure in vitro[J]. J Alzheimers Dis, 2016, 49(1): 251-263. (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


