支气管肺发育不良(bronchopulmonary dysplasis, BPD)是一种慢性肺部疾病,常见于长期氧疗、机械通气早产儿[1]。目前BPD发病机制尚未完全清楚,亦缺乏特异有效治疗手段。因此探讨BPD发病机制及防治手段,对指导临床治疗具有重要意义。
CCAAT增强子结合蛋白(CCAAT/enhancer-binding proteins, C/EBP)属碱性亮氨酸拉链蛋白转录因子超家族,现已发现6种C/EBP家族成员,包括C/EBPα、C/EBPβ、C/EBPγ、C/EBPδ、C/EBPε及C/EBPζ。其中,C/EBPα在妊娠晚期呼吸道上皮细胞成熟中起重要作用,并参与肺泡表面活性物质合成[2]。C/EBPα基因缺失新生小鼠在出生时即引起呼吸衰竭及肺结构成熟障碍[3]。
小泛素相关修饰物(small ubiquitin-related modifier, SUMO)化修饰是新近发现的一种蛋白质翻译后修饰。哺乳动物体内现已发现4种SUMO蛋白亚型,在肺脏中起主要调控作用的是SUMO1。相关研究表明,抑制SUMO特异性蛋白酶1可减轻急性肺损伤,提示SUMO化修饰可能对肺损伤发生发展起重要调节作用[4]。研究发现,C/EBPα可被SUMO化修饰,C/EBPα序列中协同调控基序SCM(synery control motifs)为SUMO结合位点。文献报道,C/EBPα的SUMO化修饰导致肝细胞增殖抑制功能失活,并抑制C/EBPα抗有丝分裂能力[5]。在SUMO敲除胚胎中,加入SUMO-C/EBPα融合蛋白可恢复正常造血功能[6]。目前,有关C/EBPα的SUMO化修饰研究较少,本课题组前期研究表明,在肺发育过程中,C/EBPα的SUMO化修饰可能与肺分化、肺泡表面活性蛋白表达及磷脂酰胆碱分泌息息相关,提示SUMO化修饰参与C/EBPα介导的分化与增殖[7]。但C/EBPα的SUMO化修饰是否影响高氧暴露所致早产大鼠肺组织细胞分化及增殖,是否参与了BPD的病理生理过程,目前尚不明确。本研究以高氧暴露所致早产大鼠BPD模型为对象,探索SUMO化修饰C/EBPα在BPD中的表达及其动态改变与肺分化及增殖的关系。
1 材料与方法 1.1 实验材料RIPA裂解液(强)、NP40裂解液(上海碧云天生物技术有限公司),SDS-PAGE配胶试剂盒(长沙艾佳生物技术有限公司),兔抗大鼠SUMO1单克隆抗体、兔抗大鼠Ki67多克隆抗体(Abcam公司,美国),山羊抗大鼠C/EBPα多克隆抗体(Santa cruz公司,美国),小鼠抗大鼠β-actin多克隆抗体(CST公司,美国),辣根过氧化物酶标记山羊抗兔单克隆IgG、兔抗山羊单克隆IgG、山羊抗鼠单克隆IgG(CST公司,美国),ECL检测试剂盒(Millipore公司,美国),预染蛋白Marker(Fermentas公司,立陶宛),Protein A/G Plus-Agarose(Santa cruz公司,美国),糖原PAS染色试剂盒(Solarbio公司,美国)。
1.2 高氧暴露早产大鼠BPD模型建立及分组Sprague-Dawley(SD)孕鼠孕19 d(预产期为22 d)行剖宫产,提前娩出的新生大鼠为早产鼠。将早产鼠随机分为空气组及高氧组;利用高氧暴露复制BPD模型[8],高氧组大鼠置于氧箱中,氧浓度维持在85%,空气组大鼠置于同一室内常压空气中;代母鼠每24 h在空气组和高氧组间更换一次,以避免氧中毒并排除不同组间代母鼠的影响,每日观察大鼠情况并记录。分别于空气或高氧暴露后4 d、7 d及14 d每组各取3只大鼠麻醉,气管插管,4%多聚甲醛气管内注射原位固定,取出肺组织,左肺用于制作石蜡切片,观察肺组织形态,右肺组织冰冻保存用于相关蛋白检测。
1.3 糖原染色检测肺组织分化取标本切片以过碘酸雪夫氏染色法(PAS)处理,切片脱腊至水,室温置于过碘酸溶液中10 min,Schiff Reagent溶液反应至变色后双蒸水冲洗,苏木素染核,光镜下观测,IPP软件评估组织中糖原含量,了解肺细胞分化情况。
1.4 免疫组化技术检测肺组织中Ki67表达以细胞增殖标记物Ki67观察肺组织细胞增殖情况。切片常规脱蜡至水,抗原修复后血清封闭30 min,滴加兔抗大鼠Ki67多克隆一抗(1 : 500),4℃过夜,PBS充分洗涤后加入辣根过氧化物酶标记的山羊抗兔单克隆IgG,室温孵育30 min,DAB显色,苏木素染核,1%盐酸乙醇分化返蓝,梯度酒精脱水,二甲苯透明,中性树胶固定封片后镜下观察,IPP软件分析Ki67表达量,了解肺细胞增殖情况。
1.5 Western blot技术检测肺组织中SUMO1及C/EBPα蛋白表达RIPA裂解液(含PMSF、蛋白酶抑制剂)提取各组肺组织细胞总蛋白,按每泳道取15 μg总蛋白进行SDS-PAGE凝胶电泳,湿式电转至PVDF膜上,5%脱脂奶粉37℃封闭1 h后,分别加入兔抗大鼠SUMO1单克隆抗体(1 : 1 000)、山羊抗大鼠C/EBPα多克隆抗体(1 : 1 000)、小鼠抗大鼠β-actin多克隆抗体(1 : 1 000)一抗,4℃孵育过夜。洗膜,以辣根过氧化物酶标记的单克隆IgG(1 : 5 000)孵育1 h,ECL化学发光显色。以目的蛋白与β-actin条带积分吸光度的比值表示目的蛋白相对表达水平。
1.6 免疫共沉淀技术(CO-IP)检测肺组织中SUMO化C/EBPα表达利用NP40裂解液(含PMSF、NEM和蛋白酶抑制剂)分别提取各组肺组织细胞总蛋白,4℃12 000 r/min离心取上清。取20 µL裂解液作为input,加入5×SDS电泳上样缓冲液煮沸10 min,用于检测免疫沉淀的蛋白量。向剩余裂解液中加入0.5 µg山羊抗大鼠C/EBPα多克隆抗体(1 : 100),4℃温和摇摆4 h,加入20 µL protein A/G beads,4℃孵育过夜,2 500 r/min离心,去上清,反复洗涤后加5×SDS电泳上样缓冲液煮沸,后续参照上述操作行SUMO1的免疫印迹实验,了解SUMO化C/EBPα表达情况。实验结果以SUMO化C/EBPα与β-actin的比值表示。
1.7 统计学分析采用SPSS 18.0统计软件对数据进行统计学分析,计量资料以均数±标准差( x±s)表示,两组样本间比较采用t检验;组内各时间点比较采用单因素方差分析,两两时间点比较采用SNK-q检验;两样本间相关性采用Pearson相关分析。P < 0.05为差异有统计学意义。
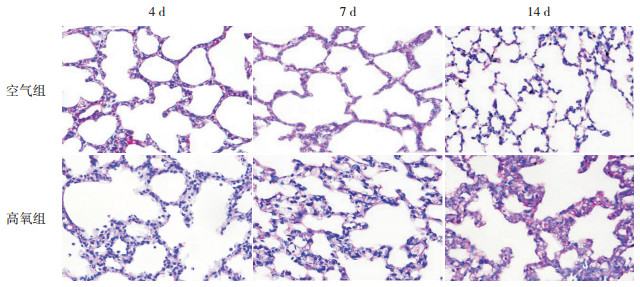
2 结果 2.1 肺组织分化情况肺上皮细胞内糖原经过PAS染色后呈紫红色,定位在胞浆。空气组大鼠肺组织糖原染色强度在生后逐渐减弱;与同时间点空气组相比,高氧组糖原染色强度4 d时减弱,7 d时增强,14 d时肺泡上皮细胞以立方上皮为主,胞浆内糖原染色强度明显增强。见图 1。
|
图 1 糖原染色检测两组大鼠肺组织分化情况(PAS,×200) 空气组糖原染色强度随时间递减。与空气组比较,高氧组4 d时糖原染色强度减弱,7 d及14 d逐渐增强,提示肺损伤晚期存在肺泡上皮细胞分化成熟障碍。糖原染色后呈紫红色。 |
Ki67阳性信号表现为定位于胞核的棕黄色颗粒,主要表达在呼吸道和肺泡上皮细胞,肺泡间隔内也可见表达。空气组Ki67于4 d时表达最弱,以后逐渐增加;高氧组肺组织中Ki67表达呈逐渐升高趋势,且均高于同时间点空气组。见图 2。

|
图 2 免疫组化检测肺组织Ki67表达(DAB,×200;左下角方框内,×400) 空气组Ki67表达随时间逐渐增加;高氧组随时间亦呈升高趋势,且均高于同时间点空气组。Ki67阳性信号表现为定位于胞核的棕黄色颗粒。 |
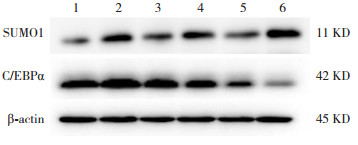
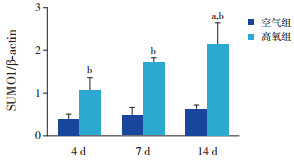
Western blot结果表明,空气组SUMO1蛋白表达在各个时间点比较差异无统计学意义(P > 0.05)。随高氧暴露时间延长,高氧组SUMO1蛋白表达呈逐渐上升趋势(P < 0.05),且均明显高于同时间点空气组(P < 0.05)。空气组与高氧组C/EBPα蛋白表达均呈逐渐下降趋势(P < 0.05);与空气组相比,高氧组4 d时C/EBPα蛋白表达增加,7 d及14 d时表达降低(P < 0.05)。见图 3~5及表 1。
|
图 3 Western blot检测C/EBPα、SUMO1蛋白表达 1:空气组4 d;2:高氧组4 d;3:空气组7 d;4:高氧组7 d;5:空气组14 d;6:高氧组14 d。 |
|
图 4 两组各时间点SUMO1蛋白表达比较(n=3) a示与同组4 d比较,P < 0.05;b示与同时间空气组比较,P < 0.05。 |

|
图 5 两组各时间点C/EBPα蛋白表达比较(n=3) a示与同组4 d比较,P < 0.05;b示与同组7 d比较,P < 0.05;c示与同时间空气组比较,P < 0.05。 |
| 表 1 两组各时间点C/EBPα及SUMO1蛋白相对表达量比较 (x±s,n=3) |
|
|
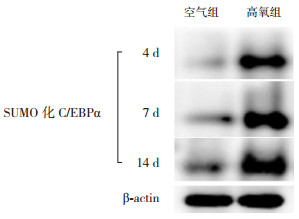
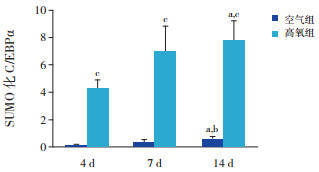
CO-IP结果显示,生后4 d、7 d及14 d时,空气组SUMO化C/EBPα表达量少,但随着时间延长逐渐增加(P < 0.05),14 d时表达水平高于4 d及7 d时;高氧组SUMO化C/EBPα表达呈逐渐上升趋势(P < 0.05),14 d时表达水平高于4 d时,且均明显高于同时间点空气组(P < 0.05)。见图 6~7及表 2。
|
图 6 CO-IP检测SUMO化C/EBPα蛋白表达 |
|
图 7 两组各时间点SUMO化C/EBPα蛋白相对表达量比较(n=3) a示与同组4 d比较,P < 0.05;b示与同组7 d比较,P < 0.05;c示与同时间空气组比较,P < 0.05。 |
| 表 2 两组各时间点SUMO化C/EBPα蛋白相对表达量比较(x ±s,n=3) |
|
|
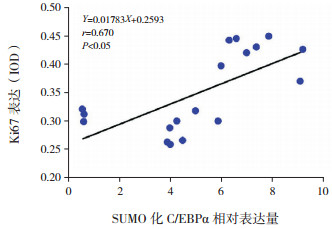
高氧暴露BPD模型中,肺组织SUMO化C/EBPα表达与糖原染色强度及核增殖抗原Ki67表达均呈正相关(r=0.529、0.671,均P < 0.05)。见图 8~9。

|
图 8 SUMO化C/EBPα表达与糖原含量相关分析图 |
|
图 9 SUMO化C/EBPα表达与Ki67表达相关分析图 |
Pan等[9]利用新生大鼠BPD模型研究发现,BPD组大鼠肺泡间隔中断增多,肺泡分化阻滞。糖原富集于不成熟肺泡上皮细胞内,随着肺发育,糖原逐渐消耗,当肺泡上皮细胞分化受阻时出现糖原累积,因此糖原代谢情况可作为肺分化重要参考指标之一。本实验研究结果显示,高氧暴露后,早产大鼠发生肺泡数目减少,体积变大,肺泡结构简单化等改变,与BPD病理改变相似。高氧肺损伤晚期,肺泡上皮细胞内糖原堆积,提示高氧可致肺泡上皮细胞分化成熟障碍。与同时间点空气组比较,高氧组Ki67表达均明显增加,说明高氧诱导肺组织细胞增殖。
近年研究发现,C/EBPα作为调节细胞增殖与分化的关键转录因子,在呼吸道上皮细胞增殖和分化过程中发挥至关重要作用,并参与肺泡表面活性蛋白(surfactant protein, SP)、板层小体相关蛋白及前体脂肪酸的合成,维持肺功能稳态[10]。利用原代培养肺泡上皮细胞(AEC)Ⅱ高氧暴露细胞损伤模型,前期研究发现[11],高氧暴露后C/EBPα表达呈先增加后减少趋势,提示C/EBPα在损伤早期可能通过代偿增加参与保护性应激机制,而随着损伤加重,最终表现为后期失代偿。本实验研究结果显示,在高氧暴露BPD模型中,4 d时C/EBPα表达增加,Torres等[12]发现高氧环境下,早期肺组织中SP-A及SP-B mRNA表达增加,与C/EBPα表达时空一致,提示早期肺损伤时C/EBPα代偿性增加可能通过上调SP表达,保护肺泡上皮细胞。随着高氧暴露时间延长,C/EBPα表达减少,肺泡上皮细胞以立方上皮为主,肺泡上皮细胞内糖原堆积,提示AECⅡ向AECⅠ分化障碍,肺泡化不能顺利完成,C/EBPα表达减少与肺组织发育成熟障碍趋势一致,提示高氧暴露导致的肺分化障碍与C/EBPα表达减少有关。
SUMO化修饰可通过与目标靶蛋白结合发挥调节作用,并与许多肺脏疾病的发生发展有所关联。低氧肺动脉高压大鼠模型中,SUMO1 mRNA及蛋白表达均升高,提示SUMO1可能在低氧肺动脉高压中发挥作用[13]。本实验研究结果显示,高氧组大鼠肺组织中SUMO1表达较空气组显著增加,且随高氧暴露时间延长而逐步升高,提示SUMO1过表达可能参与BPD发生发展。研究发现,C/EBPα可发生SUMO化修饰,SUMO1可修饰C/EBPα Lys159的赖氨酸残基,并抑制其转录活性[14-15]。Hankey等[16]证实,在嗜中性粒细胞发育过程中,C/EBPα的SUMO化修饰水平改变可能有助于调节其转录活性。另外,Sato等[5]发现,SWI/SNF染色质重塑复合物BRG1可增强C/EBPα介导的反式激活,而SUMO化修饰可抑制此过程减少C/EBPα转录。前期研究发现,肺发育过程中,随着肺分化,SUMO化C/EBPα表达逐渐降低,并与肺表面活性物质表达呈负相关,暗示SUMO化修饰可能抑制C/EBPα介导的肺分化[7]。本实验中,高氧肺损伤早期,C/EBPα及SUMO化C/EBPα表达均增加,随着氧暴露时间延长,SUMO化C/EBPα继续呈现增加趋势,而C/EBPα表达降低,提示SUMO化修饰可能抑制C/EBPα的转录活性,导致后期C/EBPα表达量减少。为进一步明确SUMO化C/EBPα是否与BPD肺分化障碍有关,利用相关分析,本研究发现,高氧暴露下,SUMO化C/EBPα表达与糖原含量呈正相关,提示SUMO化C/EBPα可能与BPD中肺泡分化阻滞存在密切关系。
已有研究表明,C/EBPα是一种强有力的细胞增殖抑制剂[17],C/EBPα缺陷新生小鼠AECⅡ增殖旺盛[18]。SUMO化修饰可破坏C/EBPα与其他蛋白质相互作用,从而减少增殖抑制复合物形成[19],促进细胞增殖。本实验中,生理状态下SUMO化C/EBPα表达量极低,高氧暴露后SUMO化C/EBPα表达明显增加,且随高氧暴露时间延长,SUMO化C/EBPα表达逐渐升高,并与Ki67表达呈显著正相关,进一步证明高氧下SUMO化C/EBPα表达增加,可能钝化C/EBPα介导的增殖抑制,促进细胞增殖。
综上所述,高氧暴露所致早产大鼠BPD中,肺泡上皮细胞过度增殖与分化障碍可能与SUMO化C/EBPα表达增加相关。应用基因敲除技术或拮抗剂抑制SUMO功能,或调控SUMO化修饰C/EBPα水平,对于高氧暴露所致BPD肺损伤是否具有保护作用有待进一步研究。
| [1] |
Kalikkot Thekkeveedu R, Guaman MC, Shivanna B. Bronchopulmonary dysplasia:A review of pathogenesis and pathophysiology[J]. Respir Med, 2017, 132: 170-177. DOI:10.1016/j.rmed.2017.10.014 (  0) 0) |
| [2] |
Xue M, Li X, Chen W. Hypoxia regulates the expression and localization of CCAAT/enhancer binding protein α by hypoxia inducible factor-1α in bladder transitional carcinoma cells[J]. Mol Med Rep, 2015, 21(3): 345-351. (  0) 0) |
| [3] |
Yang G, Hinson MD, Bordner JE, et al. Silencing hyperoxiainduced C/EBPα in neonatal mice improves lung architecture via enhanced proliferation of alveolar epithelial cells[J]. Am J Physiol Lung Cell Mol Physiol, 2011, 301(2): L187-L196. DOI:10.1152/ajplung.00082.2011 (  0) 0) |
| [4] |
马禕文, 吕翔. 抑制SUMO特异性蛋白酶1在小鼠急性肺损伤中的保护作用[J]. 中国临床医学, 2015, 22(6): 738-740. (  0) 0) |
| [5] |
Sato Y, Miyake K, Kaneoka H, et al. Sumoylation of CCAAT/enhancer-binding protein alpha and its functional roles in hepatocyte differentiation[J]. J Biol Chem, 2006, 281(31): 21629-21639. DOI:10.1074/jbc.M600852200 (  0) 0) |
| [6] |
Yuan H, Zhang T, Liu X, et al. Sumoylation of CCAAT/enhancer-binding protein α is implicated in hematopoietic stem/progenitor cell development through regulating runx1 in zebrafish[J]. Sci Rep, 2015, 5: 9011. DOI:10.1038/srep09011 (  0) 0) |
| [7] |
Chen YD, Liu JY, Lu YM, et al. Functional roles of C/EBPα and SUMO-modification in lung development[J]. Int J Mol Med, 2017, 40(4): 1037-1046. DOI:10.3892/ijmm.2017.3111 (  0) 0) |
| [8] |
Warner BB, Stuart LA, Papes RA, et al. Functional and pathological effects of prolonged hyperoxia in neonatal mice[J]. Am J Physiol, 1998, 275(1 Pt 1): L110-L117. (  0) 0) |
| [9] |
Pan B, Xue X, Zhang D, et al. SOX4 arrests lung development in rats with hyperoxia-induced bronchopulmonary dysplasia by controlling EZH2 expression[J]. Int J Mol Med, 2017, 40(6): 1691-1698. (  0) 0) |
| [10] |
Roos AB, Berg T, Barton JL, et al. Airway epithelial cell differentiation during lung organogenesis requires C/EBPα and C/EBPβ[J]. Dev Dyn, 2012, 241(5): 911-923. DOI:10.1002/dvdy.23773 (  0) 0) |
| [11] |
卢衍敏, 卢红艳, 刘姜艳, 等. 高氧调节早产大鼠肺泡Ⅱ型上皮细胞CCAAT增强子结合蛋白α和肺泡表面活性蛋白的表达[J]. 细胞与分子免疫学杂志, 2017, 33(6): 767-771. (  0) 0) |
| [12] |
Torres F, González-Candia A, Montt C, et al. Melatonin reduces oxidative stress and improves vascular function in pulmonary hypertensive newborn sheep[J]. J Pineal Res, 2015, 58(3): 362-373. DOI:10.1111/jpi.2015.58.issue-3 (  0) 0) |
| [13] |
Jiang Y, Wang J, Tian H, et al. Increased SUMO-1 expression in response to hypoxia:Interaction with HIF-1α in hypoxic pulmonary hypertension[J]. Int J Mol Med, 2015, 36(1): 271-281. DOI:10.3892/ijmm.2015.2209 (  0) 0) |
| [14] |
Geletu M, Balkhi MY, Peer Zada AA, et al. Target proteins of C/EBPalphap30 in AML:C/EBPalphap30 enhances sumoylation of C/EBPalphap42 via up-regulation of Ubc9[J]. Blood, 2007, 110(9): 3301-3309. DOI:10.1182/blood-2007-01-071035 (  0) 0) |
| [15] |
Mackert JR, Qu P, Min Y, et al. Dual negative roles of C/EBPα in the expansion and pro-tumor fuctions of MDSCs[J]. Sci Rep, 2017, 7(1): 14048. DOI:10.1038/s41598-017-12968-2 (  0) 0) |
| [16] |
Hankey W, Silver M, Sun BS, et al. Differential effects of sumoylation on the activities of CCAAT enhancer binding protein alpha (C/EBPα) p42 versus p30 may contribute in part, to aberrant C/EBPα activity in acute leukemias[J]. Hematol Rep, 2011, 3(1): e5. DOI:10.4081/hr.2011.e5 (  0) 0) |
| [17] |
Gerlach JC, Over P, Foka HG, et al. Role of transcription factor CCAAT/enhancer-binding protein alpha in human fetal liver cell types in vitro[J]. Hepatol Res, 2015, 45(8): 919-932. DOI:10.1111/hepr.12420 (  0) 0) |
| [18] |
Xu Y, Saegusa C, Schehr A, et al. C/EBPalpha is required for pulmonary cytoprotection during hyperoxia[J]. Am J Physiol Lung Cell Mol Physiol, 2009, 297(2): L286-L298. DOI:10.1152/ajplung.00094.2009 (  0) 0) |
| [19] |
Lu GD, Leung CH, Yan B, et al. C/EBPalpha is up-regulated in a subset of hepatocellular carcinomas and plays a role in cell growth and proliferation[J]. Gastroenterology, 2010, 139(2): 632-643. DOI:10.1053/j.gastro.2010.03.051 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


