2. 深圳市光明新区人民医院新生儿科, 广东 深圳 518106
支气管肺发育不良(bronchopulmonary dysplasia, BPD)是常见于早产儿的慢性肺部疾病。该病治疗周期长,治愈率低,严重者常遗留肺功能障碍、生长发育迟缓等多种远期并发症,给家庭和社会造成沉重负担。
BPD的致病因素错综复杂,发病机制亦尚未完全阐明。然而,随着针对该病的临床和实验研究的不断深入,发现氧化应激和炎症反应在BPD的发生发展中发挥重要作用[1-2]。机械通气和氧疗是BPD患儿的常见治疗手段。新生儿尤其是未成熟早产儿,肺组织发育不完善,对氧化应激更为敏感,且抗氧化能力较弱。因此,长期氧疗极易导致患者肺部损伤。细胞经过高氧刺激可产生大量活性氧簇(reactive oxygen specie, ROS),引发脂质过氧化反应,最终导致细胞结构和功能的异常[3]。另外,炎症在BPD的发生发展中扮演重要角色。目前认为,不成熟肺暴露于高氧后,炎症细胞聚集于肺部,释放大量炎症因子,触发炎症级联反应,最终可导致BPD患儿肺组织结构的异常发育[4]。
近年来,中药大黄被广泛应用于实验研究,认为其可通过抑制机体氧化应激水平,减少炎症因子的分泌,防治急性肺损伤[5]。大黄素可通过抑制核因子-κB的活性,减轻脂多糖介导的急性肺损伤,减少支气管肺泡灌洗液中炎症细胞和前炎性因子的水平[6]。另有研究发现,大黄可通过降低丙二醛(malondialdehyde, MDA)水平,提高谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)及超氧化物歧化酶(superoxide dismutase, SOD)的水平,改善百草枯中毒大鼠的肺损伤[7]。而大黄对BPD的保护作用目前尚未见报道。本课题组假设在高氧致新生大鼠BPD模型中,大黄可以通过抑制肺组织中氧化应激及炎症反应发挥保护作用。因此,本研究拟建立60%高氧致新生大鼠BPD动物模型,探讨大黄对BPD的影响。
1 材料与方法 1.1 材料与试剂Sprague-Dawley(SD)大鼠由南方医科大学实验动物中心提供[动物许可证号:SCXK(粤)2011-0015]。大黄提取物(湖北盛天恒创公司)。MDA、SOD检测试剂盒(南京建成生物工程研究所)。RNA提取试剂盒、实时荧光定量PCR(real-time PCR)试剂盒(TaKaTa,日本)。全蛋白提取试剂盒、BCA蛋白含量检测试剂盒(南京凯基公司)。小鼠抗大鼠肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)多克隆抗体(Abcam,英国),兔抗大鼠白细胞介素-6(interleukin-6,IL-6)多克隆抗体、兔抗大鼠GAPDH多克隆抗体(Affinity,美国)。
1.2 动物模型制备动物模型制备参考文献[8-9]:将64只生后4 d SD大鼠,按随机数字表法分成空气对照组、大黄对照组、高氧模型组、高氧+大黄组,每组16只。两高氧组大鼠暴露于60%氧浓度中构建BPD模型,温度维持于25~26℃,CO2浓度 < 0.5%,湿度50%~70%;两对照组大鼠暴露于空气中,余实验条件同高氧组。造模同时,大黄对照组及高氧+大黄组每天给予大鼠600 mg/kg大黄提取物混悬液灌胃1次,其余两组予以等量生理盐水灌胃。
1.3 标本的采集和处理生后第14、21天,每组分别随机抽取8只SD大鼠,行腹腔注射麻醉后,立即打开胸腔,分离周围组织,暴露支气管,结扎右支气管;取右肺速冻于液氮中,而后转移至-80℃冰箱保存,用于肺组织中SOD活性、MDA水平的检测,以及RNA和蛋白的提取;取左肺经4%多聚甲醛溶液固定过夜后,行逐级酒精脱水、透明、浸蜡、包埋制成石蜡切片(厚5 μm),用于苏木素-伊红(hematoxylin-easine, HE)染色。
1.4 肺组织形态学观察石蜡切片经HE染色后,光学显微镜下观察各组大鼠肺组织形态学改变。放射状肺泡计数(radical alveolar counts, RAC)评估肺泡发育程度:从呼吸性细支气管的中心,绘制垂直线到最近的胸膜,并且计算与该线相交肺泡数即为RAC。每组取8只大鼠标本,每个标本随机取5张切片,每张切片随机观察5个视野。
1.5 肺组织中SOD活性、MDA水平的检测取肺组织4℃匀浆制成10%匀浆液后,离心取上清,BCA法检测蛋白浓度,遵循试剂盒说明书,采用分光光度计法测定SOD活性及MDA水平。
1.6 肺组织中TNF-α、IL-6 mRNA表达水平的检测采用real-time PCR法检测mRNA的表达。提取肺组织RNA后,采用紫外分光光度计测定RNA的纯度及浓度。遵循TaKaTa试剂盒操作说明,行逆转录合成cDNA单链。TNF-α、IL-6以及GAPDH引物均由上海捷瑞生物工程有限公司设计合成,TNF-α引物序列:上游:5' -GAGCATCGTAG-TTGTTGGAAAT-3' ,下游:5' -CAGGTCTACTTTGG-AGTCATTG-3' ,片段长度:210 bp;IL-6引物序列:上游:5' -TACTGGTCTGTTGTGGGTGGT-3' ,下游:5' -TTGCCTTCTTGGGACTGATGT-3' ,片段长度:101 bp;GAPDH引物序列:5' -TCTCTGCTCCTCCC-TGTTC-3' ,下游:5' -ACACCGACCTTCACCATCT-3' ,片段长度:87 bp。反应体系(20 μL):上、下游引物各0.5 μL,SYBR Premix Ex TaqⅡ 10 μL,cDNA单链模板2 μL,ddH2O 7 μL。反应条件:95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环。于罗氏480仪器上行RT-PCR反应后收集数据,采用2-△△CT相对定量法进行计算。
1.7 肺组织中TNF-α、IL-6蛋白表达水平的检测采用Western blot法检测蛋白的表达。提取肺组织总蛋白,BCA法检测蛋白浓度。将蛋白与上样缓冲液以1 : 4的比例混合,煮沸5 min,使其变性;变性蛋白经电泳、转膜,5% BSA室温封闭1 h,加入一抗(TNF-α抗体浓度1 : 500,IL-6抗体浓度1 : 1 000,GAPDH抗体浓度1 : 3 000)4℃孵育过夜;洗膜,再加入HRP标记的二抗(抗体浓度1 : 3 000)室温孵育1 h;洗膜,最后经ECL化学发光后采集图像。利用Image J软件对各组条带行灰度值分析,以目的蛋白与GAPDH的比值作为该目的蛋白的半定量结果。
1.8 统计学分析采用SPSS 19.0统计软件对数据进行统计学分析。计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q法,P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠肺组织形态学改变在生后第14、21天,空气对照组与大黄对照组大鼠肺组织结构完整,肺泡大小均匀,间隔无明显破坏,并随日龄增加,大鼠肺形态学发育逐渐成熟。高氧模型组于生后14 d可见肺泡间隔厚薄不均,肺泡数量明显减少;于生后21 d可见肺组织发育进一步受阻,肺泡数量减少的同时,体积明显增大,结构简单化,形成肺大疱;且肺组织形态学测量指标RAC在两时间点均明显低于空气对照组及大黄对照组(P < 0.01)。相比高氧模型组,高氧+大黄组大鼠肺组织病理改变于两时间点均明显减轻,RAC也相应增加(P < 0.05)。见图 1,表 1。
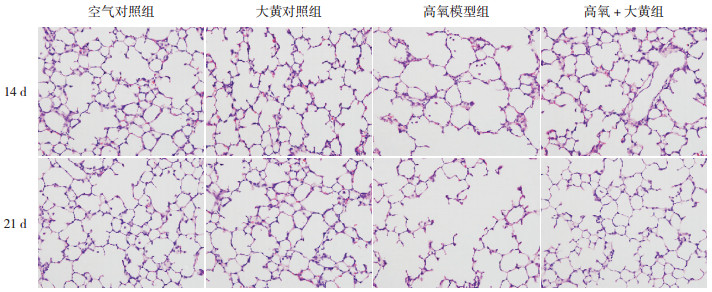
|
图 1 各组大鼠肺组织形态学改变(苏木精-伊红染色,×400) 空气对照组和大黄对照组大鼠随日龄增加肺组织结构发育渐成熟,肺泡结构规整,间隔较薄。高氧模型组大鼠于生后14 d时可见肺泡数量减少,体积增大;于生后21 d时可见肺泡数目明显减少,结构简单化,肺泡壁破裂融合形成肺大疱。与高氧模型组比较,高氧+大黄组病理改变显著减轻,肺泡数目增多,肺泡结构较完整。 |
| 表 1 各组大鼠放射状肺泡计数比较 (x±s) |
|
|
与空气对照组、大黄对照组相比,高氧模型组大鼠生后14、21 d时SOD活性明显降低(P < 0.05),MDA水平明显升高(P < 0.01)。与高氧模型组比较,高氧+大黄组大鼠SOD活性于两时间点显著升高(P < 0.01),MDA水平显著降低(P < 0.05)。见表 2。
| 表 2 各组大鼠肺组织中SOD活性和MDA水平比较 (x±s) |
|
|
在生后第14、21天,空气对照组与大黄对照组TNF-α、IL-6 mRNA及其蛋白表达水平比较差异无统计学意义(P > 0.05)。与空气对照组、大黄对照组比较,高氧模型组TNF-α、IL-6 mRNA及其蛋白表达水平于两时间点均明显升高(P < 0.01)。与高氧模型组比较,高氧+大黄组TNF-α、IL-6 mRNA及其蛋白表达水平于生后14、21 d时均明显降低(P < 0.05)。见表 3~4,图 2~4。
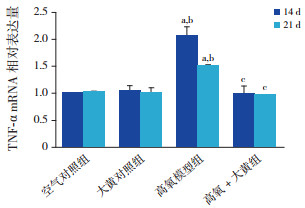
|
图 2 各组大鼠肺组织TNF-α mRNA相对表达量(n=8) a示与空气对照组比较,P < 0.01;b示与大黄对照组比较,P < 0.01;c示与高氧模型组比较,P < 0.01。 |
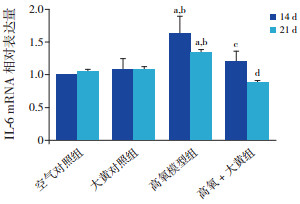
|
图 3 各组大鼠肺组织IL-6 mRNA相对表达量(n=8) a示与空气对照组比较,P < 0.01;b示与大黄对照组比较,P < 0.01;c示与高氧模型组比较,P < 0.05;d示与高氧模型组比较,P < 0.01。 |
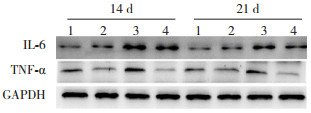
|
图 4 Western blot检测各组大鼠肺组织TNF-α和IL-6蛋白表达 1:空气对照组;2:大黄对照组;3:高氧模型组;4:高氧+大黄组。 |
| 表 3 各组大鼠肺组织中TNF-α mRNA和蛋白表达水平比较 (x±s) |
|
|
| 表 4 各组大鼠肺组织中IL-6 mRNA和蛋白表达水平比较 (x±s) |
|
|
近年来,随着围生医学的快速发展和新生儿救治技术的不断提高,如产前糖皮质激素的使用、产后肺表面活性物质的替代治疗等,使得早产儿生存率增加的同时BPD的发病率也显著增加。BPD的主要病理特征是肺泡和微血管的发育不良[10]。有研究经过长期随访发现,生命早期肺功能发育受阻的BPD患儿,存活后其呼吸道对外界刺激的敏感性明显增加,且成年后更易罹患慢性阻塞性肺疾病[11]。因此,寻求更为有效的治疗手段显得极为重要。本研究将生后4 d SD大鼠暴露于60%高氧中构建BPD模型,暴露于高氧后的大鼠肺组织形态出现明显异常,肺泡数目减少,体积增大,肺组织结构简单化,RAC减少,并随时间的延长损伤加重,甚至出现肺大疱,表明高氧致新生大鼠BPD动物模型构建成功。经大黄干预后,上述病理损伤得到明显改善,提示大黄可减轻高氧诱导的肺损伤。
有研究认为,氧化和抗氧化系统的失衡是BPD的发病机制之一[1]。MDA是脂质过氧化的主要代谢产物,机体内MDA的水平作为细胞氧化损伤的一个重要检测指标,可反映组织氧化损伤的程度。SOD是机体内主要的抗氧化酶,可以清除氧自由基,检测SOD的活性可以反映体内抗氧化水平[12]。Xu等[13]将新生鼠暴露于90%高氧14 d后发现肺组织中MDA水平明显增加,而SOD活性及GSH水平明显降低。本研究同样发现,相比空气对照组,未经药物干预的高氧模型组大鼠肺组织中SOD活性降低,MDA水平升高,证实高氧可通过诱导机体氧化和抗氧化的失衡引起BPD肺损伤。
文献报道[2],在肺发育的关键时期,由感染、机械通气、氧疗等引起的肺部炎症反应可导致肺泡数量减少,结构简单化和气体交换面积的减少。TNF-α、IL-6是一类主要由巨噬细胞分泌的前炎症细胞因子,可介导机械通气相关性肺损伤[14]。Hsiao等[15]发现,BPD患儿生后第1天血清及气管吸出物中IL-6和8-羟基-2' -脱氧鸟苷的水平明显高于正常早产儿,并且气管吸出物中两者的水平在生后第28天仍持续增加。早产儿气管吸出物中高水平的IL-6被认为是BPD的独立危险因素[16]。本实验结果发现,高氧暴露14 d、21 d时大鼠肺组织中TNF-α、IL-6 mRNA和蛋白的表达水平较两对照组均明显升高,提示高氧诱导BPD模型大鼠肺组织中出现明显的炎症反应。
大黄为常用中药,多用于治疗腹痛、便秘等临床症状。近年来越来越多的研究发现,大黄具有减轻氧化应激和炎症反应、改善微循环障碍以及维持免疫平衡等广泛的药理作用[17]。本实验结果表明,生后4 d SD大鼠暴露于60%高氧后,肺组织发育明显受阻。与此同时,与空气对照组相比,高氧模型组大鼠肺组织中炎症细胞因子TNF-α、IL-6 mRNA和蛋白的表达水平、脂质过氧化产物MDA水平均明显升高,抗氧化酶SOD活性明显降低。高氧组大鼠给予大黄后,炎症因子及氧化应激水平均明显降低,且高氧诱导的肺组织损伤也得到明显改善。
综上所述,大黄可能通过减少炎症因子水平,抑制氧化应激反应发挥BPD大鼠的肺组织保护作用。因此,本研究为临床大黄防治BPD提供了一定的实验基础。
| [1] |
Poggi C, Dani C. Antioxidant strategies and respiratory disease of the preterm newborn:an update[J]. Oxid Med Cell Longev, 2014, 2014: 721043. (  0) 0) |
| [2] |
Shahzad T, Radajewski S, Chao CM, et al. Pathogenesis of bronchopulmonary dysplasia:when inflammation meets organ development[J]. Mol Cell Pediatr, 2016, 3(1): 23. DOI:10.1186/s40348-016-0051-9 (  0) 0) |
| [3] |
Husari A, Khayat A, Bitar H, et al. Antioxidant activity of pomegranate juice reduces acute lung injury secondary to hyperoxia in an animal model[J]. BMC Res Notes, 2014, 7: 664. DOI:10.1186/1756-0500-7-664 (  0) 0) |
| [4] |
Balany J, Bhandari V. Understanding the impact of infection, inflammation, and their persistence in the pathogenesis of bronchopulmonary dysplasia[J]. Front Med (Lausanne), 2015, 2: 90. (  0) 0) |
| [5] |
郭丽纳, 孙燕妮. 大黄素对急性肺损伤保护作用研究进展[J]. 中国中医急症, 2017, 26(4): 663-665. (  0) 0) |
| [6] |
Xiao M, Zhu T, Zhang W, et al. Emodin ameliorates LPSinduced acute lung injury, involving the inactivation of NF-κB in mice[J]. Int J Mol Sci, 2014, 15(11): 19355-19368. DOI:10.3390/ijms151119355 (  0) 0) |
| [7] |
龙勇, 姜英, 李长罗, 等. 大黄对百草枯中毒大鼠肺损伤的保护作用[J]. 中国中医急症, 2016, 25(9): 1734-1736. (  0) 0) |
| [8] |
黄铃沂, 段江, 封志纯. 支气管肺发育不良小鼠模型的建立[J]. 中国实验动物学报, 2009, 17(3): 186-188. (  0) 0) |
| [9] |
Han W, Guo C, Liu Q, et al. Aberrant elastin remodeling in the lungs of O2-exposed newborn mice; primarily results from perturbed interaction between integrins and elastin[J]. Cell Tissue Res, 2015, 359(2): 589-603. DOI:10.1007/s00441-014-2035-1 (  0) 0) |
| [10] |
崔换金, 黄为民, 何嘉裕. 高氧暴露新生大鼠肺组织转录因子CASZ1的表达及其与肺微血管发育的关系[J]. 中华儿科杂志, 2016, 54(1): 37-42. (  0) 0) |
| [11] |
Merritt T A, Deming D D, Boynton B R. The 'new' bronchopulmonary dysplasia:challenges and commentary[J]. Semin Fetal Neonatal Med, 2009, 14(6): 345-357. DOI:10.1016/j.siny.2009.08.009 (  0) 0) |
| [12] |
王艳, 江来. 红景天苷对机械通气致小鼠急性肺损伤的保护作用研究[J]. 国际麻醉学与复苏杂志, 2017, 38(3): 193-197. (  0) 0) |
| [13] |
Xu W, Zhao Y, Zhang B, et al. Resveratrol attenuates hyperoxiainduced oxidative stress, inflammation and fibrosis and suppresses Wnt/β-catenin signalling in lungs of neonatal rats[J]. Clin Exp Pharmacol Physiol, 2015, 42(10): 1075-1083. DOI:10.1111/cep.2015.42.issue-10 (  0) 0) |
| [14] |
Bhandari V. Postnatal inflammation in the pathogenesis of bronchopulmonary dysplasia[J]. Birth Defects Res A Clin Mol Teratol, 2014, 100(3): 189-201. DOI:10.1002/bdra.23220 (  0) 0) |
| [15] |
Hsiao CC, Chang JC, Tsao LY, et al. Correlates of elevated interleukin-6 and 8-hydroxy-2'-deoxyguanosine levels in tracheal aspirates from very low birth weight infants who develop bronchopulmonary dysplasia[J]. Pediatr Neonatol, 2017, 58(1): 63-69. DOI:10.1016/j.pedneo.2016.01.004 (  0) 0) |
| [16] |
Choi CW, Kim BI, Kim HS, et al. Increase of interleukin-6 in tracheal aspirate at birth:a predictor of subsequent bronchopulmonary dysplasia in preterm infants[J]. Acta Paediatr, 2006, 95(1): 38-43. DOI:10.1080/08035250500404085 (  0) 0) |
| [17] |
Lai F, Zhang Y, Xie DP, et al. A systematic review of rhubarb (a traditional chinese medicine) used for the treatment of experimental sepsis[J]. Evid Based Complement Alternat Med, 2015, 2015: 131283. (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


