先天性巨结肠(Hirschsprung's disease, HSCR)又称先天性肠无神经节细胞症,是导致儿童便秘及低位不完全肠梗阻的常见外科疾病,发病率为1/2 000~5 000。胚胎5~12周时,肠自主神经系统的外胚层神经嵴细胞(nerual crest cell, NCC)沿肠壁迁移异常终止,导致部分肠壁肌间神经丛和粘膜下神经丛神经节细胞缺如、不能产生有效肠蠕动,迁移中断的时间越早,受累肠管越长,因而目前认为先天性巨结肠是神经嵴疾病的一种[1-2]。NCC起源于胚胎干细胞(embryonic stem cell, ESC)。干细胞替代技术成为许多疾病的重要治疗手段,但ESC移植替代治疗HSCR受到技术、伦理等因素制约,发展缓慢,使得诱导多能干细胞移植(induced pluripotent steam cells, iPSC)替代治疗HSCR成为研究热点[3]。有研究通过分析HSCR患儿P75NTR阳性肠神经元的分布,探讨肠神经嵴干细胞或前体细胞在HSCR患儿肠管的分布情况,为实现HSCR患儿自体移植提供依据[4]。
先天性巨结肠的发病率有明显的种族差异和性别倾向,多数为散发病例,5%~20%表现为家族发病,尤其是累及长度超过乙状结肠近端的长段型巨结肠(long-segment, L-HSCR)和累及全部结肠的全结肠型巨结肠(total colonic ananglionosis, TCA)[5-6]。先天性巨结肠属于多因素参与的畸形,遗传变异可致先天性巨结肠,但仅30%的病例检出遗传变异,目前发现多种基因异常与巨结肠的发病相关,以RET基因表达异常与先天性巨结肠相关性的研究较多,近50%的家族性和3%~7%的散发性HSCR是由RET基因突变所致[1-2, 5-6]。RET基因编码的酪氨酸激酶受体表达于包括肠神经元在内的多种神经元,在神经嵴细胞的分化、增殖、迁移等生物学过程中发挥重要作用[7]。
多数先天性巨结肠为单发畸形,5%~32%的先天性巨结肠伴发其他畸形,主要是合并其他神经嵴发育异常性疾病,从而构成先天性巨结肠综合征或综合征性先天性巨结肠[1-2]。目前已知的明确与巨结肠相关的合并症有Down's综合征、感觉神经性耳聋、神经母细胞瘤、神经节细胞瘤、嗜铬细胞瘤等[1-2, 5]。
在此对先天性巨结肠相关综合征的临床表现和致病基因及遗传方式做一综述。
1 与神经嵴疾病相关的巨结肠综合征与神经嵴疾病相关的巨结肠综合征包括2型多发内分泌瘤(multiple neuroendocrine neoplasia type 2, MEN2)、Mowat-Wilson综合征(Mowat-Wilson syndrome, MWS)、Waardenburg综合征4型(Waardenburg syndrome, WS4)、家族性自主神经功能障碍综合征(familial dysautonomia, FD)、Fryns综合征、先天性中枢通气不良综合征(congenital central hypoventilation syndrome, CCHS)[8-13]等。
1.1 2型多发内分泌瘤MEN2是一组遗传性肿瘤综合征,为常染色体显性遗传,表现为甲状腺髓样癌、原发性甲状旁腺功能亢进和嗜铬细胞瘤等症状,常合并肠道发育异常[7, 14]。1982年Verdy等[7]首次报道一个HSCR、MEN2并发的家系,自此,人们认识到这两种疾病并发的风险和原因。MEN2是由RET基因突变引起,多数是由于RET基因5个密码子中的一个发生了碱基对替换,导致半胱氨酸残基的改变从而影响蛋白活性。MEN2A或家族性甲状腺髓样癌(FMTC)家族中,存在RET基因密码子609、611、618或620等位点突变的患者均患有HSCR。MEN2B很少合并HSCR,患者表现为胃肠道散在的神经节瘤、骨骼畸形、MTC、嗜铬细胞瘤等,90%由于RET基因突变(Met918Thr)所致,受累患者在新生儿期间可出现肠梗阻,目前仅发现1例MEN2B患者伴发HSCR[14]。
1.2 Mowat-Wilson综合征MWS于1998年由Mowat等首次报道,男性略多,临床特点包括小头畸形、中至重度智力障碍、HSCR、染色体2q22-q23突变等,超过40%的患者合并HSCR[15]。ZEB2基因突变与本病关系密切,该基因在胚胎发育过程中通过诱导上皮间充质转化而参与多种器官形成,因而MWS患儿常常合并心血管、泌尿生殖、中枢神经系统、骨骼肌肉系统的先天畸形[11]。ZEB2对于神经嵴细胞的发育至关重要,因此MWS几乎所有的临床症状均与神经嵴细胞的诱导、迁移和分化缺陷有关[1]。MWS的遗传方式为常染色体显性遗传,存在基因-表型差异,尚缺乏有效的产前诊断方法[11]。
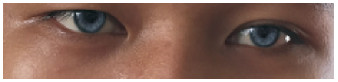
1.3 Waardenburg综合征4型WS是一种罕见的神经嵴疾病,表现为感觉神经性耳聋,皮肤毛发脱色素,虹膜色素沉着异常(图 1)等[1, 10, 16],病因主要是神经嵴来源的黑色素细胞异常增殖、迁移和分化。根据伴发疾病WS又分为4个亚型,合并HSCR的为WS4型,又称为Shah-Waardenburg综合征。WS具有遗传异质性,目前发现SOX10、EDN3和EDNRB基因与WS4关系密切。李颖等[17]发现,SOX10基因及EDNRB基因参与人胚胎后肠神经系统的发育。半数以上WS4型患者可检出SOX10基因异常,遗传方式为常染色体显性遗传,而EDN3和EDNRB导致的WS4型主要为常染色体隐性遗传[10]。SOX10基因在胚胎发育期首先表达于神经嵴细胞,对神经嵴来源细胞的发育具有重要调控作用,其表达下调可以导致施万细胞、少突胶质细胞、黑色素细胞、肠神经节细胞等一系列神经嵴来源细胞发育异常。多数WS4型患者的SOX10突变为移码、错义突变或者终止密码提前等,导致相应蛋白功能异常[16]。最近研究[18]发现,SOX10基因的异常扩增也可导致WS4型。SOX10突变患儿还可能有中枢神经系统受累表现,如癫癎、共济失调和中枢及外周神经的脱髓鞘病变等[16, 18]。
|
图 1 Waardenburg综合征患者的蓝色巩膜[16] |
FD综合征或者Riley-Day综合征是一种遗传性感觉和自主神经病变,是由于IKBKAP(又称ELP1)基因突变导致的常染色体隐性遗传性疾病,特点为神经元发育异常及渐进性神经元变性,60%合并胃肠功能异常[11]。FD患者的肠神经系统中神经节细胞和神经元密度减低[19-21],部分HSCR患者基因组中也检测到了IKBKAP基因的突变。Cohen-Kupiec等[22]将人神经母瘤细胞的IKBKAP基因敲除,发现RET基因表达下调,认为IKBKAP可能通过RET基因调节肠神经系统的发育。Cheng等[23]发现,IKBKAP蛋白表达被阻断的斑马鱼的肠胚胎ENS神经节细胞缺失、神经元数量减少,与人类HSCR的病理表现一致,而且PHOX2B基因和RET基因表达均下调。FD特征性症状源于感觉神经元和自主神经元的功能丧失,表现为痛觉和温度觉减低,以及自主神经异常如恶心、呕吐、高血压、心动过速、皮肤瘀斑等,这些症状多由儿茶酚胺异常分泌所致,FD患者常见睡眠中猝死,但得到密切监护的患者能存活到30岁左右[24-25]。FD神经变性不仅局限于外周神经,病情恶化的重要标志是视网膜神经节细胞渐进性死亡导致的眼盲,多数患者还有脊柱侧后凸和消瘦[26-28]。
1.5 Fryns综合征Fryns综合征是一种少见的常染色体隐性遗传病,与PIGN基因异常有关,典型临床表现包括以下方面[1, 10, 12, 29]:(1)膈肌缺损(膈疝、膈膨升等);(2)特殊面容(面部皮肤粗糙、眼距宽、鼻根低而宽、长人中、嘴唇厚、耳位低且发育不良、帐篷状上唇伴巨口、小颌);(3)末梢肢体发育不良(如指甲和/或指骨);(4)肺发育不良;(5)以下表现的至少一种:羊水过多、角膜混浊和/或小眼球、颜面裂、脑畸形、心血管畸形、肾发育不良、肾皮质囊肿、胃肠道畸形(巨结肠、肛门闭锁、肠旋转不良等)、外生殖器畸形等。有研究在1例临床诊断为Fryns综合征的患者中发现1q41-q42.12头端5Mb缺失[11]。
1.6 先天性中枢通气不良综合征CCHS是一种罕见的常染色体显性遗传性疾病,由于自主神经调节功能异常,不能根据血气做出相应的呼吸调整,表现为睡眠状态下肺泡通气不足、呼吸暂停,严重者清醒状态下也可出现通气不足,典型患者新生儿期发病且终生需要呼吸机[13, 30]。CCHS常常与先天性巨结肠和神经嵴来源的肿瘤如神经母细胞瘤、神经节细胞瘤、神经节母细胞瘤等伴发,被认为是神经嵴疾病的一种[13]。CCHS患者还可出现视力缺陷、心率异常、癫癎、体温调节异常等症状,合并HSCR时被称为Haddad综合征[1]。PHOX2B基因的显性突变是CCHS最常见的基因异常。PHOX2B基因缺失的小鼠和斑马鱼模型可表现为全肠段的无神经节细胞症[31]。多数CCHS患者存在PHOX2B基因第三个外显子polyA序列过度扩增,一些非polyA重复序列突变患者的症状更为严重[30]。PHOX2B基因突变降低了其转录活性,使RET基因表达下调,导致先天性巨结肠[13]。
2 其他巨结肠相关综合征其他巨结肠相关综合征主要为一些常染色体隐性遗传性综合征(除L1综合征外)[32-37]。
2.1 Smith-Lemli-Opitz综合征Smith-Lemli-Opitz综合征(Smith-Lemli-Opitz syndrom, SLOS)是7-脱氢胆固醇(7-DHC)还原酶缺乏导致7-DHC升高及胆固醇降低的一种先天性代谢性疾病,是编码7-DHC还原酶的基因DHCR7突变所致的常染色体隐性遗传性疾病,表现为智力障碍、面部畸形、小颅畸形、先天性心脏病、肢体畸形、胆汁淤积性肝病和肾上腺功能不全等[32, 38]。16%~26%的SLOS患者合并HSCR,这些患儿多在婴儿期手术治疗[32]。目前SLOS主要的治疗方法是口服胆固醇,由于血脑屏障口服胆固醇并不能完全改善患者的行为及认知症状[38]。
2.2 软骨-毛发发育不良综合征软骨-毛发发育不良综合征(Cartilage-hair hypoplasia, CHH)是一种罕见的常染色体隐性遗传性疾病,于1964年由McKusik首次报道[33]。CHH特征性表现为干骺端软骨发育不良和毛发发育不良等,还可出现身材矮小和骨骼发育不全(关节松弛、肘部伸展受限、下肢内翻、短肢侏儒等)、再生障碍性贫血、免疫缺陷、癌症倾向、皮肤和指甲发育异常、生长发育障碍、胃肠道畸形(包括HSCR、食管闭锁、肛门狭窄等)等[39]。CHH患者生长发育障碍是渐进性的(尤其是在青春期)。CHH伴发HSCR的发生率为7%~9%,畸形越严重伴发HSCR的风险越高[33]。CHH致病基因是9p12的RMRP基因,是线粒体中负责核糖核酸酶加工的RNA亚基[40]。
2.3 Bardet-Biedl综合征Bardet-Biedl综合征(Bardet-Biedl syndrome, BBS)是作为细胞感觉触角的原始纤毛的结构和/或功能缺失导致的,具有视网膜色素变性、肥胖、多指、认知能力障碍、泌尿生殖系统发育异常等特征性表现,以及面部宽大、前额突出和牙齿异常等面部畸形[34, 41]。12种基因突变与BBS相关,且存在明显基因型-表型相关性,其遗传方式为常染色体隐性遗传[41-42]。BBS蛋白可影响神经嵴细胞的迁移从而影响肠神经系统发育,说明BBS可伴发HSCR[34]。
2.4 Goldberg-Shprintzen综合征Goldberg和Shprintzen等于1981年首次报道了两例巨结肠合并身材矮小、小头畸形、眼距过宽、下腭裂的患者,命名为Goldberg-Shprintzen综合征[43]。10q22.1染色体上的驱动蛋白结合蛋白基因突变与Goldberg-Shprintzen综合征密切相关,该基因编码驱动蛋白家族成员的结合蛋白,调节神经元微管的动力,影响轴突的发育和神经元功能[43-44],其遗传方式为常染色体隐性遗传[35]。
2.5 1型神经纤维瘤病1型神经纤维瘤病(nurofibromatosis type 1, NF1)是一种神经外胚层病变,属常染色体显性遗传,表现为认知功能障碍、全身皮肤散在咖啡斑、巨颅畸形、骨骼畸形以及神经纤维瘤、视神经胶质瘤等,胃肠道表现为肌间神经丛肥大的肠神经元发育不良及先天性巨结肠[38]。NF1基因和先天性巨结肠相关基因GDNF可相互增强,使两种疾病同时发生[36, 46-47]。
2.6 L1综合征L1综合征是由L1细胞粘连分子基因突变导致的神经功能异常及严重智力障碍,表现为智力低下、脑积水、痉挛性截瘫、拇指内收、胼胝体发育不全及皮质脊髓束发育异常等,遗传方式为X连锁隐性遗传[1-2, 37]。L1综合征较少伴发巨结肠,HSCR可伴发X-连锁脑积水[37]。
综上所述,先天性巨结肠常常与其他先天性畸形相伴发生,比例高达30%,长期预后主要取决于伴发综合征的严重程度。对这些综合征的充分认知对于先天性巨结肠的正确诊断、预后评估具有重要意义。
| [1] |
Bahrami A, Joodi M, Moetamani-Ahmadi M, et al. Genetic background of Hirschsprung disease:A bridge between basic science and clinical application[J]. J Cell Biochem, 2018, 119(1): 28-33. DOI:10.1002/jcb.26149 (  0) 0) |
| [2] |
Amiel J, Lyonnet S. Hirschsprung disease, associated syndromes, and genetics:a review[J]. J Med Genet, 2001, 38(11): 729-739. DOI:10.1136/jmg.38.11.729 (  0) 0) |
| [3] |
崔钊, 刘雪来. iPSC移植替代治疗巨结肠前期研究的现状及应用前景[J]. 中华小儿外科杂志, 2013, 34(11): 862-865. (  0) 0) |
| [4] |
黄强, 段怡涛, 高亚, 等. 先天性巨结肠患儿p75NTR免疫阳性肠神经元的时空分布研究[J]. 中华小儿外科杂志, 2014, 35(12): 956-958. DOI:10.3760/cma.j.issn.0253-3006.2014.12.0.018 (  0) 0) |
| [5] |
Friedmacher F, Puri P. Classification and diagnostic criteria of variants of Hirschsprung's disease[J]. Pediatr Surg Int, 2013, 29(9): 855-872. DOI:10.1007/s00383-013-3351-3 (  0) 0) |
| [6] |
Nakamura H, Henderson D, Puri P. A meta-analysis of clinical outcome of intestinal transplantation in patients with total intestinal aganglionosis[J]. Pediatr Surg Int, 2017, 33(4): 1-5. (  0) 0) |
| [7] |
Verdy M, Weber AM, Roy CC, et al. Hirschsprung's disease in a family with multiple endocrine neoplasia type 2[J]. J Pediatr Gastroenterol Nutr, 1982, 1(4): 603-607. DOI:10.1097/00005176-198212000-00027 (  0) 0) |
| [8] |
Garavelli L, Ivanovski I, Caraffi SG, et al. Neuroimaging findings in Mowat-Wilson syndrome:a study of 54 patients[J]. Genet Med, 2016, 19(6): 691-700. (  0) 0) |
| [9] |
Doubaj Y, Pingault V, Elalaoui SC, et al. A novel mutation in the endothelin B receptor gene in a moroccan family with shahwaardenburg syndrome[J]. Mol Syndromol, 2015, 6(1): 44-49. (  0) 0) |
| [10] |
Lefcort F, Mergy M, Ohlen SB, et al. Erratum to:Animal and cellular models of familial dysautonomia[J]. Clin Auton Res, 2017, 27(4): 235-243. DOI:10.1007/s10286-017-0438-2 (  0) 0) |
| [11] |
Mcinerney AM, Harris JE, Gattas M, et al. Fryns syndrome associated with recessive mutations in PIGN in two separate families[J]. Hum Mutat, 2016, 37(7): 695-702. DOI:10.1002/humu.22994 (  0) 0) |
| [12] |
Di Zanni E, Adamo A, Belligni E, et al. Common PHOX2B poly-Alanine contractions impair RET gene transcription, predisposing to Hirschsprung disease[J]. Biochim Biophys Acta, 2017, 1863(7): 1770-1777. DOI:10.1016/j.bbadis.2017.04.017 (  0) 0) |
| [13] |
Zupan A, Glavač D. The development of rapid and accurate screening test for RET hotspot somatic and germline mutations in MEN2 syndromes[J]. Exp Mol Pathol, 2015, 99(3): 416-425. DOI:10.1016/j.yexmp.2015.08.017 (  0) 0) |
| [14] |
Norton JA, Krampitz G, Jensen RT. Multiple endocrine neoplasia:Genetics and clinical management[J]. Surg Oncol Clin N Am, 2015, 24(4): 795-832. DOI:10.1016/j.soc.2015.06.008 (  0) 0) |
| [15] |
Mowat DR, Croaker GD, Cass DT, et al. Hirschsprung disease, microcephaly, mental retardation, and characteristic facial features:delineation of a new syndrome and identification of a locus at chromosome 2q22-q23[J]. J Med Genet, 1998, 35(8): 617-623. DOI:10.1136/jmg.35.8.617 (  0) 0) |
| [16] |
Liang F, Zhao M, Fan L, et al. Identification of a de novo mutation of SOX10 in a Chinese patient with Waardenburg syndrome type Ⅵ[J]. Int J Pediatr Otorhinolaryngol, 2016, 91: 67-71. DOI:10.1016/j.ijporl.2016.10.019 (  0) 0) |
| [17] |
李颖. SOX10, EDNRB在人胚胎肠神经系统发育中的表达[D]. 沈阳: 中国医科大学, 2014. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=zgyk201403013&dbname=CJFD&dbcode=CJFQ
(  0) 0) |
| [18] |
Falah N, Posey JE, Thorson W, et al. 22q11.2q13 duplication including SOX10 causes sex-reversal and peripheral demyelinating neuropathy, central dysmyelinating leukodystrophy, Waardenburg syndrome, and Hirschsprung disease[J]. Am J Med Gene A, 2017, 173: 1066-1070. DOI:10.1002/ajmg.a.v173.4 (  0) 0) |
| [19] |
Axelrod FB. Familial dysautonomia[J]. Muscle Nerve, 2004, 29(3): 352-363. DOI:10.1002/(ISSN)1097-4598 (  0) 0) |
| [20] |
Bar-Shai A, Maayan C, Vromen A, et al. Decreased density of ganglia and neurons in the myenteric plexus of familial dysautonomia patients[J]. J Neurol Sci, 2004, 220(1-2): 89-94. DOI:10.1016/j.jns.2004.02.017 (  0) 0) |
| [21] |
Azizi E, Berlowitz I, Vinograd I, et al. Congenital megacolon associated with familial dysautonomia[J]. Eur J Pediatr, 1984, 142(1): 68-69. DOI:10.1007/BF00442596 (  0) 0) |
| [22] |
Cohen-Kupiec R, Pasmanik-Chor M, Oron-Karni V, et al. Effects of IKAP/hELP1 deficiency on gene expression in differentiating neuroblastoma cells:implications for familial dysautonomia[J]. PLoS One, 2011, 6(4): e19147. DOI:10.1371/journal.pone.0019147 (  0) 0) |
| [23] |
Cheng WW, Tang CS, Gui HS, et al. Depletion of the IKBKAP ortholog in zebrafish leads to hirschsprung disease-like phenotype[J]. World J Gastroenterol, 2015, 21(7): 2040-2046. DOI:10.3748/wjg.v21.i7.2040 (  0) 0) |
| [24] |
Dietrich P, Dragatsis I. Familial dysautonomia:mechanisms and models[J]. Genet Mol Biol, 2016, 39(4): 497-514. DOI:10.1590/1678-4685-gmb-2015-0335 (  0) 0) |
| [25] |
Norcliffe-Kaufmann L, Slaugenhaupt SA, Kaufmann H. Familial dysautonomia:history, genotype, phenotype and translational research[J]. Prog Neurobiol, 2017, 152: 131-148. DOI:10.1016/j.pneurobio.2016.06.003 (  0) 0) |
| [26] |
Mendoza-Santiesteban CE, Hedges Iii TR, Norcliffe-Kaufmann L, et al. Selective retinal ganglion cell loss in familial dysautonomia[J]. J Neurol, 2014, 261(4): 702-709. DOI:10.1007/s00415-014-7258-2 (  0) 0) |
| [27] |
Mendoza-Santiesteban CE, Hedges TR 3rd, Norcliffe-Kaufmann L, et al. Clinical neuro-ophthalmic findings in familial dysautonomia[J]. J Neuroophthalmol, 2012, 32(1): 23-26. DOI:10.1097/WNO.0b013e318230feab (  0) 0) |
| [28] |
Mendoza-Santiesteban CE, Palma JA, Hedges TR 3rd, et al. Pathological confirmation of optic neuropathy in familial dysautonomia[J]. J Neuropathol Exp Neurol, 2017, 76(3): 238-244. DOI:10.1093/jnen/nlw118 (  0) 0) |
| [29] |
Parisi MA, Zayed H, Slavotinek AM, et al. Congenital diaphragmatic hernia and microtia in a newborn with mycophenolate mofetil (MMF) exposure:phenocopy for Fryns syndrome or broad spectrum of teratogenic effects?[J]. Am J Med Genet A, 2009, 149A(6): 1237-1240. DOI:10.1002/ajmg.a.v149a:6 (  0) 0) |
| [30] |
Verkaeren E, Brion A, Hurbault A, et al. Health-related quality of life in young adults with congenital central hypoventilation syndrome due to PHOX2B mutations:a cross-sectional study[J]. Respir Res, 2015, 16(1): 80-86. DOI:10.1186/s12931-015-0241-3 (  0) 0) |
| [31] |
尚卿, 刘远梅. 肠神经嵴干细胞发育与先天性巨结肠关系研究[J]. 现代医药卫生, 2015, 31(8): 1164-1167. (  0) 0) |
| [32] |
Tallman KA, Kim HH, Korade Z, et al. Probes for protein adduction in cholesterol biosynthesis disorders:Alkynyl lanosterol as a viable sterol precursor[J]. Redox Biol, 2017, 12(C): 182-190. (  0) 0) |
| [33] |
Klemetti P, Valta H, Kostjukovits S, et al. Cartilage-hair hypoplasia with normal height in childhood-4 patients with a unique genotype[J]. Clin Genet, 2017, 92(2): 204-207. DOI:10.1111/cge.2017.92.issue-2 (  0) 0) |
| [34] |
Tobin JL, Di Franco M, Eichers E, et al. Inhibition of neural crest migration underlies craniofacial dysmorphology and Hirschsprung's disease in Bardet-Biedl syndrome[J]. Proc Natl Acad Sci U S A, 2008, 105(18): 6714-6719. DOI:10.1073/pnas.0707057105 (  0) 0) |
| [35] |
Dafsari HS, Byrne S, Lin J, et al. Goldberg-Shprintzen megacolon syndrome with associated sensory motor axonal neuropathy[J]. Am J Med Genet A, 2015, 167(6): 1300-1304. DOI:10.1002/ajmg.a.36873 (  0) 0) |
| [36] |
Solga AC, Toonen JA, Pan Y, et al. The cell of origin dictates the temporal course of neurofibromatosis-1(NF-1) low-grade glioma formation[J]. Oncotarget, 2017, 8(29): 47206-47215. (  0) 0) |
| [37] |
Nakakimura S, Sasaki F, Okada T. Hirschsprung's disease, acrocallosal syndrome, and congenital hydrocephalus:report of 2 patients and literature review[J]. J Pediatr Surg, 2008, 43(5): E13-17. DOI:10.1016/j.jpedsurg.2007.12.069 (  0) 0) |
| [38] |
Bianconi SE, Cross JL, Wassif CA, et al. Pathogenesis, epidemiology, diagnosis and clinical aspects of Smith-Lemli-Opitz syndrome[J]. Expert Opin Orphan Drugs, 2015, 3(3): 267-280. DOI:10.1517/21678707.2015.1014472 (  0) 0) |
| [39] |
Riley P Jr, Weiner DS, Leighley B, et al. Cartilage hair hypoplasia:characteristics and orthopaedic manifestations[J]. J Child Orthop, 2015, 9(2): 145-152. DOI:10.1007/s11832-015-0646-z (  0) 0) |
| [40] |
Cherkaoui Jaouad I, Laarabi FZ, Chafai Elalaoui S, et al. Novel mutation and structural RNA analysis of the noncoding RNase MRP gene in cartilage-hair hypoplasia[J]. Mol Syndromol, 2015, 6(2): 77-82. DOI:10.1159/000430970 (  0) 0) |
| [41] |
Castro-Sánchez S, Álvarez-Satta M, Cortón M, et al. Exploring genotype-phenotype relationships in Bardet-Biedl syndrome families[J]. J Med Genet, 2015, 52(8): 503-513. DOI:10.1136/jmedgenet-2015-103099 (  0) 0) |
| [42] |
Forsythe E, Beales PL. Bardet-Biedl syndrome[J]. Eur J Hum Genet, 2013, 21(1): 8-13. DOI:10.1038/ejhg.2012.115 (  0) 0) |
| [43] |
Goldberg RB, Shprintzen RJ. Hirschsprung megacolon and cleft palate in two sibs[J]. J Craniofac Genet Dev Biol, 1981, 1(2): 185-189. (  0) 0) |
| [44] |
Kevenaar JT, Bianchi S, van Spronsen M, et al. Kinesin-binding protein controls microtubule dynamics and cargo trafficking by regulating kinesin motor activity[J]. Curr Biol, 2016, 26(7): 849-861. DOI:10.1016/j.cub.2016.01.048 (  0) 0) |
| [45] |
Craigie RJ, Ba'Ath M, Fryer A, et al. Surgical implications of the Smith-Lemli-Opitz syndrome[J]. Pediatr Surg Int, 2005, 21(6): 482-484. DOI:10.1007/s00383-005-1415-8 (  0) 0) |
| [46] |
Hambardzumyan D, Gutmann DH, Kettenmann H. The role of microglia and macrophages in glioma maintenance and progression[J]. Nat Neurosci, 2016, 19(1): 20-27. DOI:10.1038/nn.4185 (  0) 0) |
| [47] |
Stowe IB, Mercado EL, Stowe TR, et al. A shared molecular mechanism underlies the human rasopathies Legius syndrome and neurofibromatosis-1[J]. Genes Dev, 2012, 26(13): 1421-1426. DOI:10.1101/gad.190876.112 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20

