新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy, HIE)是新生儿死亡的重要原因,也是儿童运动、认知和感觉神经系统功能障碍的常见原因之一[1]。尽管亚低温治疗现已普遍应用,但仍有45%~50%的患儿最终死亡或预后不良[2]。因此,如何早期明确诊断、优化治疗方案及准确判断预后一直是临床医生关注的重点。
磁共振成像技术(magnetic resonance imaging, MRI)在HIE的诊断和预后判断中一直占据着重要地位。现行的相关指南建议,在生后第2~8天对临床诊断为HIE的患儿进行MRI检查,可以明确诊断、判断预后并指导临床决策[3]。但传统MRI的应用也存在一些问题。首先,MRI的结果判读有很强的主观性;其次,HIE脑损伤需要一定的演化时间方可确定其具体的病因、类型及损伤程度[4],如生后24 h内的MRI结果,多呈假阴性或低估损伤程度[5],而亚低温治疗的时间窗限制也局限了传统MRI在HIE早期诊断上的应用;此外,传统MRI在HIE患儿的预后判断中也表现欠佳[6]。近年来,随着医学影像技术的进步,功能成像技术如氢质子磁共振波谱(1H-proton magnetic resonance spectroscopy, 1H-MRS)等无创、定量的影像技术的应用,弥补了传统MRI的局限,并在HIE的应用中逐步显示出优势。
文献计量学是一门依靠统计学和数学方法对书目及期刊文章等文献资料进行定性及定量的分析的学科[7]。比如,其可以通过对关键词共现情况进行统计及聚类分析,构建知识网络,反映特定研究领域一定时间内的研究趋势及热点问题,并发现研究对象间的关系亲疏及潜在联系[8]。随着专门用于共现聚类分析的可视化软件的发展使共现聚类分析的结果更加可靠、直观,越来越多的医学工作者开始利用此种方法为政策制定、临床研究及科研方向选择等提供指导[9]。
本研究希望通过对高频关键词的共现及聚类分析,对1H-MRS在HIE中的应用情况进行梳理,以了解其发展趋势及研究热点,为该领域今后的研究方向提供参考。
1 资料与方法使用关键词及主题词相结合的方法,在PubMed、EMBASE及Web of Science数据库进行文献检索,限定文献语言为英文,发表日期为2018年1月10日前,不限制起始日期。检索共得到英文文献1 168篇。纳入标准为:该期间内于公开刊物发表的、研究主题包含HIE与1H-MRS的论著及综述。排除标准为:重复文献、主题不相关文献、会议摘要及未报道关键词的文献。两名作者按此标准分别进行文献筛选工作,初筛共获得主题相关、文献类型符合要求的论著及综述118篇。首先,对此118篇文献进行分布特征分析,随后,纳入其中报道了关键词的文献66篇进行共词分析。使用Microsoft Office Excel 2016提取纳入文献中的关键词,通过阅读其题目及摘要对关键词进行拆分或同义项合并,并统计词频。根据Donohue高频低频词界分公式计算词频阈值[8, 10],并根据词频的实际情况对其进行适当调整[11],对关键词进行热点判别。将所得热点词汇导入Bicomb 2.0软件构建共现矩阵后,使用VOSviewer1.6.6软件进行聚类分析并绘制知识图谱。
在关键词共现及聚类分析图中,中心位置提示该高频词在整个领域中处于核心地位;节点越大提示词频越高;不同颜色代表不同类别的关键词,颜色相同或距离越近提示不同高频词间相关性越高,某点颜色越深表示该词在此类别中所占比重越大[12]。
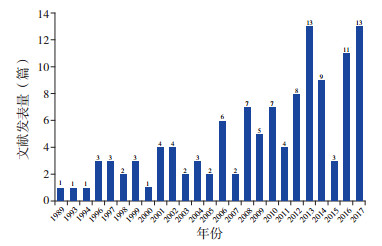
2 结果 2.1 1H-MRS在HIE中的相关研究分布特征纳入1989~2017年间研究主题为1H-MRS在HIE中的应用的文献共118篇。2006年为此研究主题文献发表的第一个高峰,自此以后,相关研究数量整体呈上升趋势,见图 1。
|
图 1 氢质子磁共振波谱在HIE中应用的研究随时间变化情况 此研究主题文献发表的第一个高峰为2006年,自此以后,相关研究数量整体呈上升趋势。 |
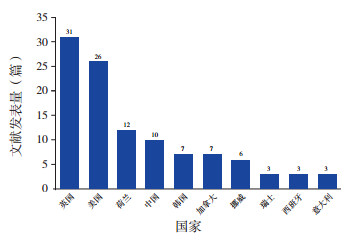
通过对文献发表机构的地域分析可见,1H-MRS的应用主要集中于发达国家。英国在此方向发表研究最多,占文献总量的26.3%(31/118),美国紧随其后(22.0%,26/118)。荷兰(10.2%,12/118)及中国(8.5%,10/118)发文量相近,分别位列第三、第四名。图 2所示为文献发表量排名前10的国家。
|
图 2 氢质子磁共振波谱在HIE中应用的研究文献发表量排名前10的国家 氢质子磁共振波谱的应用主要集中于发达国家,英国在此方向发表研究最多,美国紧随其后,荷兰及中国分别位列第三、第四名。 |
共纳入报道了关键词的文献66篇进行关键词提取及高频关键词的选取。关键词总数为111个,共计出现频次为359次,词频为1的关键词为75个。根据Donohue高频低频词界分公式[8, 10]计算词频阈值T=12.76,即词频≥13者为高频关键词。在此阈值下,高频词共有7个,分别为:“1H-MRS(氢质子磁共振波谱)”“HIE(缺氧缺血性脑病)”“Neonate(新生儿)”“MRI(磁共振成像)”,“Hypoxia-Ischemia(缺氧-缺血)”,“Neuroprotection(神经保护)”以及“Perinatal Asphyxia(围生期窒息)”。由于此时关键词数目过少,且多为特征性关键词,并不能据此显示相关研究的全貌,故根据实际情况及既往经验对高频词界定阈值进行适当调整[11],最终纳入词频≥3的高频关键词共27个(表 1),高频关键词共计出现频次为266次。
| 表 1 入选高频关键词词频分布 |
|
|
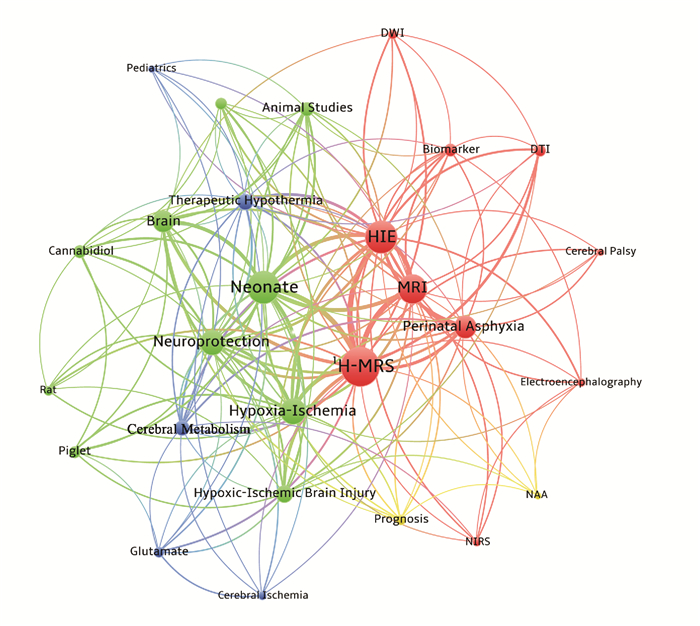
利用VOSviewer对热点词汇进行分析,得到高频词共现关系及聚类分析结果,如图 3所示。
|
图 3 入选关键词共现网络及聚类分析图 热点词汇被分类为4个研究方向,分别为:临床检查手段(红色)、动物实验(绿色)、亚低温治疗相关研究(蓝色)及预后判断(黄色)。其中“临床检查手段”和“动物实验”为关注度最高的研究方向。结合知识图谱中高频词节点的大小、颜色的深浅及学科的实际情况,分析得到上述4个研究方向的关注热点分别为“MRI(磁共振成像)”“ Neuroprotection(神经保护)”“Cerebral Metabolism(脑代谢)”“NAA(N-乙酰天冬氨酸)”。 |
聚类分析结果显示,所有热点词汇被分类为4个研究方向:(1)临床检查手段;(2)动物实验;(3)亚低温治疗相关研究;(4)预后判断。即在HIE的相关研究中,1H-MRS主要应用在临床和科研两方面。在临床应用中,1H-MRS一方面作为一种新兴的临床检查手段被临床医生关注,另一方面则在HIE患儿的预后判断中表现了其吸引力。而在科研方面,1H-MRS则主要应用于各种动物实验,以及与亚低温治疗相关的研究中。其中,临床检查手段(48.1%)和动物实验(38.7%)为关注度最高的研究方向,具体见表 2。结合知识图谱中高频词节点的大小、颜色的深浅及学科的实际情况,分析得到上述4个研究方向的关注热点分别为“MRI”(磁共振成像,8.3%),“Neuroprotection”(神经保护,5.6%),“Cerebral Metabolism”(脑代谢,3.4%)及“NAA”(N-乙酰天冬氨酸,1.1%)。
| 表 2 入选关键词聚类结果及词频比重[n(%)] |
|
|
本研究结果显示,1H-MRS在HIE中的应用自2006年起开始稳步增长,但多数集中于发达国家。目前的1H-MRS在HIE中的应用主要集中在临床和科研两个方面的4个方向中。在临床应用中,1H-MRS作为HIE的临床检查手段及预后判断工具被广泛关注,而在科研中,则主要被应用于动物实验以及与亚低温治疗相关的研究中。其中,临床检查手段(48.1%)和动物实验(38.7%)为关注度最高的研究方向,随后为亚低温治疗相关研究(10.5%)及预后判断(2.6%)。上述4个方向关注热点分别为“MRI(磁共振成像)”“Neuroprotection(神经保护)”“Cerebral Metabolism(脑代谢)”“NAA(N-乙酰天冬氨酸)”。本研究共词分析结果与实际情况相符,提示本研究的方法能较真实地反映当前领域的研究结构和方向。
在HIE的临床检查手段中,“MRI”紧邻作为研究主题而居于核心地位的“1H-MRS”与“HIE”,其出现次数占高频词出现总数的8.3%,提示1H-MRS在HIE中的应用与MRI密切相关,是MRI的衍生技术及补充手段。作为现阶段HIE的主要检查手段之一,传统MRI的局限性,如结果判读的主观性、生后24 h内易出现假阴性结果或低估患儿脑损伤程度等[5],促使人们努力寻求技术的改良及方案的优化,1H-MRS应运而生。1H-MRS主要根据脑组织内不同物质的不同化学位移共振频率在共振线谱上表现出的不同的峰,无创地定量计算脑内关键代谢物如NAA、乳酸、胆碱等的绝对或相对浓度,以实时显示脑组织的代谢情况[13]。例如,在脑组织中,NAA主要存在于神经元内,被认为是神经元成熟及完整性的标志物[2, 14],波峰位于2.02 ppm(ppm表示106),足月新生儿中,NAA峰值升高不常见,但其水平下降提示有神经元的损伤及功能障碍[15-16]。而作为无氧代谢的标志物的乳酸,在正常成人及足月儿脑内几乎检测不到,而在缺氧患儿中则会于1.33 ppm处出现特征性双峰[5]。已有研究表明,与健康的足月儿相比,HIE患儿脑组织内的NAA水平下降,乳酸水平明显上升[17-21]。在患儿生后24 h内,当传统MRI尚无法检测出脑损伤或低估脑损伤程度时,1H-MRS的这一特性,可帮助临床医生更好地对HIE患儿进行早期诊断及病情严重程度的判断,从而使患儿及时接受治疗并从中获益[5, 22]。此外,知识图谱也显示,近年来逐渐兴起的新技术,如可显示细胞毒性脑水肿的弥散加权成像(diffusion weighted imaging, DWI)、可检测脑白质损伤及髓鞘发育情况的弥散张量成像(diffusion tensor imaging, DTI)以及可评估脑血流及其氧合代谢情况的近红外光谱(near infrared spectroscopy, NIRS)等也得到了越来越多的关注。与此同时,脑电图检查也仍旧活跃在HIE患儿的临床监测手段中。根据这一聚类分析的结果可以发现,HIE的临床检查手段日趋多样,并且有多种技术联合应用的趋势。多样化的检查手段可为临床医生提供更准确、更丰富的信息,有利于指导临床决策。
1H-MRS在动物实验中也得到了广泛应用,其主要研究热点为“Neuroprotection(神经保护)”亚低温治疗从最初的动物实验至最初的临床试验,经历了11年的时间[23],此外,有许多动物实验的结果最终未能在临床试验中证实其效果。这种科研向临床转化过程的低效,原因之一是由于动物实验与临床试验中所使用的结局检测指标不同[24],针对这种情况,“桥梁”标志物的应用显得尤为必要。“桥梁”标志物是指在动物和人体中均能检测的、用于评估生理及病理状态的指标。一个好的“桥梁”标志物应该是无创、定量测量的客观指标,并反映不同物种间的相同的病理生理通路,以利于不同物种、不同机构间研究结果的直接比较。1H-MRS即是满足上述条件的检查手段之一。首先,1H-MRS作为MRI的补充手段,可在进行MRI检查时进行,仅需额外耗时5~10 min;其次,它弥补了MRI结果判读的主观性的缺点,可对脑组织代谢情况进行定量的测定分析;此外,随着医学影像技术的发展,1H-MRS已可在猪等大动物模型中进行应用。由此,应用1H-MRS作为动物实验的检测手段之一,不失为一个促进实验室研究向临床应用转化、提高科研成果转化效率的好方法,可为科研工作者提供参考。
亚低温治疗相关研究是1H-MRS在HIE应用中的另一个主要研究方向,其关注热点为“Cerebral Metabolism(脑代谢)”。亚低温治疗的确切机制尚不完全清楚,但已有动物实验表明,其可能对导致细胞损伤多种通路有抑制作用[25]。除可检测与能量代谢有关的乳酸、磷酸肌酸等物质含量外,1H-MRS还可无创地定量检测在体脑组织中的其他关键代谢物,如与神经传导有关的谷氨酸盐以及与抗氧化作用相关的谷胱甘肽等。近来有研究者发现,与复温后相比,亚低温过程中,基底节、丘脑、皮层及白质中,磷酸肌酸浓度升高,肌酸浓度降低,谷氨酸盐浓度降低[26]。该研究结果表明,亚低温过程中,兴奋性神经递质(如谷氨酸盐)浓度的降低,是其降低细胞能量需求、改善脑能量代谢稳态的作用机制之一。此外,1H-MRS还可以用于脑组织温度的测定[27-28]。研究发现,重度HIE患儿在亚低温治疗过程中及复温后,其脑组织温度及脑-直肠温度差均高于同样条件下的中度HIE患儿[28],这意味着,现阶段使用的经直肠或食管测温的方式,并不能使重度HIE患儿的脑组织在亚低温治疗的过程中达到并维持治疗所需的目标温度,可能会对治疗效果产生影响。此种情况下,应用1H-MRS对脑组织温度进行直接测定,可更好地监测治疗效果并制定个体化的治疗方案。1H-MRS的以上特性使其可应用于对亚低温治疗确切机制的深入研究中,有助于进一步优化现行治疗方案,并探究可与亚低温协同使用的相关药物[29]的作用机制及监测其治疗效果。
本研究结果还显示,近年来,1H-MRS在判断HIE患儿的预后方面应用较多,“NAA(N-乙酰天冬氨酸)”为此研究方向中的热点问题。已有大量临床研究表明,1H-MRS测得的脑组织内NAA的含量可用于预测HIE患儿的预后情况,如丘脑及基底节NAA含量的下降多提示患儿预后不良,如脑瘫、智力发育迟缓等[15, 17-21]。相关的荟萃分析也对此结论予以证实,并提出最佳的预后判断指标为基底节/丘脑区域的乳酸/NAA比例,此比例增高(> 0.29)提示预后不良,其敏感度和特异度分别为82%、95%[6]。并且,已有研究者在探究HIE的联合治疗方法时,对将基底节/丘脑区域的乳酸/NAA比例作为临床试验结局的替代指标进行了初步尝试[30]。作为大规模临床试验前的预实验,这种方法可有效降低临床试验的耗时及经费使用,并在很大程度上解决了随访困难、失访率高的儿科临床试验常见问题。
本研究通过对英文文献的发表情况及对其高频词的共现聚类分析,初步展示了1H-MRS在HIE中的应用现状及知识架构,但本研究仍存在一定的局限性。首先,关键词的提取仅基于文章报道的关键词,使许多发表时未报道关键词的文献被排除在外。其次,作为未经规范的自然词语,关键词本身即存在报道不规范、选择有偏颇等问题,可能对共现聚类分析的结果造成一定的影响。此外,研究仅纳入了英文文献进行统计分析。通过检索CNKI数据库对国内发表的研究进行分析,检索得到693篇文献,进行文献筛选后,共获得中文文献48篇,关键词多为特征性词语,如新生儿、缺氧缺血性脑病、磁共振成像等,并不能反映文章研究的具体内容,故未对其进行进一步统计分析。最后,已发表的文献存在一定的滞后性,无法涵盖正在进行的研究内容,但对可视化网络的整体结构不会产生较大影响。尽管如此,本研究的结果仍能提示当前1H-MRS在HIE中应用的主要研究方向及研究热点,有助于临床及科研工作者开拓思路,更好地开展相关工作。
| [1] |
Volpe JJ. Neonatal encephalopathy:an inadequate term for hypoxic-ischemic encephalopathy[J]. Ann Neurol, 2012, 72(2): 156-166. DOI:10.1002/ana.v72.2 (  0) 0) |
| [2] |
Bonifacio SL, Devries LS, Groenendaal F. Impact of hypothermia on predictors of poor outcome:how do we decide to redirect care?[J]. Semin Fetal Neonatal Med, 2015, 20(2): 122-127. DOI:10.1016/j.siny.2014.12.011 (  0) 0) |
| [3] |
Ment LR, Bada HS, Barnes P, et al. Practice parameter:neuroimaging of the neonate:report of the Quality Standards Subcommittee of the American Academy of Neurology and the Practice Committee of the Child Neurology Society[J]. Neurology, 2002, 58(12): 1726-1738. DOI:10.1212/WNL.58.12.1726 (  0) 0) |
| [4] |
Cheong JL, Coleman L, Hunt RW, et al. Prognostic utility of magnetic resonance imaging in neonatal hypoxic-ischemic encephalopathy:substudy of a randomized trial[J]. Arch Pediatr Adolesc Med, 2012, 166(7): 634-640. (  0) 0) |
| [5] |
Ghei SK, Zan E, Nathan JE, et al. MR imaging of hypoxic-ischemic injury in term neonates:pearls and pitfalls[J]. Radiographics, 2014, 34(4): 1047-1061. DOI:10.1148/rg.344130080 (  0) 0) |
| [6] |
Thayyil S, Chandrasekaran M, Taylor A, et al. Cerebral magnetic resonance biomarkers in neonatal encephalopathy:a meta-analysis[J]. Pediatrics, 2010, 125(2): e382-e395. DOI:10.1542/peds.2009-1046 (  0) 0) |
| [7] |
Dabi Y, Darrigues L, Katsahian S, et al. Publication trends in bariatric surgery:a bibliometric study[J]. Obes Surg, 2016, 26(11): 2691-2699. DOI:10.1007/s11695-016-2160-x (  0) 0) |
| [8] |
包惠民, 李智. CNKI数据实现ucinet共现分析的方法及实证分析[J]. 软件导刊(教育技术), 2012, 11(1): 91-93. (  0) 0) |
| [9] |
Wang Y, Wang Q, Wei X, et al. Global scientific trends on exosome research during 2007-2016:a bibliometric analysis[J]. Oncotarget, 2017, 8(29): 48460-48470. (  0) 0) |
| [10] |
储节旺, 郭春侠. EXCEL实现共词分析的方法——以国内图书情报领域知识管理研究为例[J]. 情报杂志, 2011, 30(3): 45-49. (  0) 0) |
| [11] |
刘奕杉, 王玉琳, 李明鑫. 词频分析法中高频词阈值界定方法适用性的实证分析[J]. 数字图书馆论坛, 2017(9): 42-49. (  0) 0) |
| [12] |
Khalil GM, Gotway Crawford CA. A bibliometric analysis of U.S.-based research on the Behavioral Risk Factor Surveillance System[J]. Am J Prev Med, 2015, 48(1): 50-57. DOI:10.1016/j.amepre.2014.08.021 (  0) 0) |
| [13] |
Manias KA, Peet A. What is MR spectroscopy?[J]. Arch Dis Child Educ Pract Ed, 2017 Aug 26. pii: edpract-2017-312839. doi: 10.1136/archdischild-2017-312839. [Epub ahead of print].
(  0) 0) |
| [14] |
Cheong JL, Cady EB, Penrice J, et al. Proton MR spectroscopy in neonates with perinatal cerebral hypoxic-ischemic injury:metabolite peak-area ratios, relaxation times, and absolute concentrations[J]. AJNR Am J Neuroradiol, 2006, 27(7): 1546-1554. (  0) 0) |
| [15] |
Sijens PE, Wischniowsky K, Ter Horst HJ. The prognostic value of proton magnetic resonance spectroscopy in term newborns treated with therapeutic hypothermia following asphyxia[J]. Magn Reson Imaging, 2017, 42: 82-87. DOI:10.1016/j.mri.2017.06.001 (  0) 0) |
| [16] |
Robertson NJ, Thayyil S, Cady EB, et al. Magnetic resonance spectroscopy biomarkers in term perinatal asphyxial encephalopathy:from neuropathological correlates to future clinical applications[J]. Curr Pediatr Rev, 2014, 10(1): 37-47. DOI:10.2174/157339631001140408120613 (  0) 0) |
| [17] |
Alderliesten T, De Vries LS, Staats L, et al. MRI and spectroscopy in (near) term neonates with perinatal asphyxia and therapeutic hypothermia[J]. Arch Dis Child Fetal Neonatal Ed, 2017, 102(2): F147-F152. DOI:10.1136/archdischild-2016-310514 (  0) 0) |
| [18] |
Ancora G, Testa C, Grandi S, et al. Prognostic value of brain proton MR spectroscopy and diffusion tensor imaging in newborns with hypoxic-ischemic encephalopathy treated by brain cooling[J]. Neuroradiology, 2013, 55(8): 1017-1025. DOI:10.1007/s00234-013-1202-5 (  0) 0) |
| [19] |
van Doormaal PJ, Meiners LC, ter Horst HJ, et al. The prognostic value of multivoxel magnetic resonance spectroscopy determined metabolite levels in white and grey matter brain tissue for adverse outcome in term newborns following perinatal asphyxia[J]. Eur Radiol, 2012, 22(4): 772-778. DOI:10.1007/s00330-011-2315-z (  0) 0) |
| [20] |
Alderliesten T, de Vries LS, Benders M, et al. MR imaging and outcome of term neonates with perinatal asphyxia:value of diffusion-weighted MR imaging and 1H MR spectroscopy[J]. Radiology, 2011, 261(1): 235-242. DOI:10.1148/radiol.11110213 (  0) 0) |
| [21] |
Ancora G, Soffritti S, Lodi R, et al. A combined a-EEG and MR spectroscopy study in term newborns with hypoxic-ischemic encephalopathy[J]. Brain Dev, 2010, 32(10): 835-842. DOI:10.1016/j.braindev.2009.11.008 (  0) 0) |
| [22] |
Berger HR, Brekke E, Wideroe M, et al. Neuroprotective treatments after perinatal hypoxic-ischemic brain injury evaluated with Magnetic Resonance Spectroscopy[J]. Dev Neurosci, 2017, 39(1-4): 36-48. DOI:10.1159/000472709 (  0) 0) |
| [23] |
Azzopardi D, Edwards AD. Magnetic resonance biomarkers of neuroprotective effects in infants with hypoxic ischemic encephalopathy[J]. Semin Fetal Neonatal Med, 2010, 15(5): 261-269. DOI:10.1016/j.siny.2010.03.001 (  0) 0) |
| [24] |
Pound P, Ebrahim S, Sandercock P, et al. Where is the evidence that animal research benefits humans?[J]. BMJ, 2004, 328(7438): 514-517. DOI:10.1136/bmj.328.7438.514 (  0) 0) |
| [25] |
Gunn AJ, Laptook AR, Robertson NJ, et al. Therapeutic hypothermia translates from ancient history in to practice[J]. Pediatr Res, 2017, 81(1-2): 202-209. DOI:10.1038/pr.2016.198 (  0) 0) |
| [26] |
Wisnowski JL, Wu TW, Reitman AJ, et al. The effects of therapeutic hypothermia on cerebral metabolism in neonates with hypoxic-ischemic encephalopathy:an in vivo 1H-MR spectroscopy study[J]. J Cereb Blood Flow Metab, 2016, 36(6): 1075-1086. DOI:10.1177/0271678X15607881 (  0) 0) |
| [27] |
Owji ZP, Gilbert G, Saint-Martin C, et al. Brain temperature is increased during the first days of life in asphyxiated newborns:developing brain injury despite hypothermia treatment[J]. AJNR Am J Neuroradiol, 2017, 38(11): 2180-2186. DOI:10.3174/ajnr.A5350 (  0) 0) |
| [28] |
Wu TW, Mclean C, Friedlich P, et al. Brain temperature in neonates with hypoxic-ischemic encephalopathy during therapeutic hypothermia[J]. J Pediatr, 2014, 165(6): 1129-1134. DOI:10.1016/j.jpeds.2014.07.022 (  0) 0) |
| [29] |
Berger HR, Nyman A, Morken TS, et al. Early metabolite changes after melatonin treatment in neonatal rats with hypoxic-ischemic brain injury studied by in-vivo 1H MR spectroscopy[J]. PLoS One, 2017, 12(9): e185202. (  0) 0) |
| [30] |
Azzopardi D, Robertson NJ, Bainbridge A, et al. Moderate hypothermia within 6 h of birth plus inhaled xenon versus moderate hypothermia alone after birth asphyxia (TOBY-Xe):a proof-of-concept, open-label, randomised controlled trial[J]. Lancet Neurol, 2016, 15(2): 145-153. DOI:10.1016/S1474-4422(15)00347-6 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


