2. 福建省血液病研究所/福建省血液病学重点实验室/福建医科大学附属协和医院血液科, 福建 福州 350001
儿童成熟B细胞非霍奇金淋巴瘤(mature B-cell non-Hodgkin lymphoma, B-NHL)呈高度侵袭性,肿瘤负荷大,易侵犯全身多脏器,可早期转移至骨髓以及中枢神经系统,虽然合理的治疗可使其无事件生存率(event-free survival, EFS)达90%[1]。但仍有部分患儿出现诱导失败、复发等情况。因此筛选出影响儿童成熟B-NHL的预后指标,有益于改进化疗方案、提高长期生存率。本研究对28例儿童成熟B-NHL的临床资料包括疗效、长期生存率和预后影响因素进行回顾性分析,以期为提高成熟B-NHL的远期疗效提供理论依据。
1 资料与方法 1.1 研究对象选择2011年1月至2016年12月福建医科大学附属协和医院小儿血液科收治的37例14岁以下的初治成熟B-NHL和成熟B细胞型急性淋巴细胞白血病(B-cell acute lymphocytic leukemia, B-ALL)患儿进行研究,其中6例诊断后即放弃治疗,31例按照CCCG-B-NHL 2010方案接受治疗,2013年6月之后入组的20例采用化疗联合利妥昔单抗方案(化疗前1天给予美罗华375 mg/m2,连续6个疗程)。31例中2例因化疗1疗程后疾病进展放弃治疗,1例化疗2疗程后(缓解状态)失访,共28例(成熟B-NHL 17例,成熟B-ALL 11例)进入研究。28例中男性23例(82%)、女性5例(18%),中位年龄6(1~12)岁,> 10岁的6例(21%)。
成熟B-NHL和成熟B-ALL的诊断、临床分期、化疗及疗效评价均参照CCCG-B-NHL 2010方案[2]进行。所有入组病例均完善血常规、血生化、病毒DNA检查,以及组织病理、骨髓活检、骨髓细胞学MICM分析,脑脊液常规和离心涂片查肿瘤细胞,影像学检查(以PET-CT为主,条件不允许时行增强CT或MRI)等。
骨髓浸润[3]定义为骨髓活检(bone marrow biopsy, BMB)发现局灶性肿瘤细胞浸润,或PET-CT显示骨髓局灶性氟脱氧葡萄糖(fluoro-2-deoxy-D-glucose, FDG)浓聚和/或弥漫性代谢增高。
1.2 随访随访截止至2017年12月,中位随访时间31(4~70)个月。事件指2个疗程后的未缓解、复发、死亡、第二肿瘤、放弃治疗等。
1.3 统计学分析采用SPSS 23.0软件进行数据处理。PET-CT诊断骨髓浸润效率的评价采用诊断试验的四格表法;以Kaplan-Meier法分析无事件生存率和总生存率,并行log-rank检验进行生存率的比较。P < 0.05为差异具有统计学意义。
2 结果 2.1 临床特点和病理类型前5位的首发表现为颈部肿物(13例,46%),颌面部肿物(10例,36%),肝脾大(9例,32%),腹部包块(5例,18%),突眼(5例,18%)。血清乳酸脱氢酶(LDH) < 500 U/L者14例,500~1 000 IU/L者3例,≥1 000 IU/L者11例。28例中3例(11%)为Ⅱ期,9例(32%)Ⅲ期,5例(18%)Ⅳ期,11例(39%)瘤性白血病。28例中Burkitt淋巴瘤(Burkitt lymphoma, BL)/B-ALL 17例(61%),其中11例为成熟B-ALL;弥漫大B细胞型淋巴瘤(diffuse large B-cell lymphoma, DLBCL)8例(29%),3例(11%)未能进一步分类。
2.2 PET-CT对骨髓浸润的诊断评价对16例初诊患儿行PET-CT检查判断有无骨髓浸润,并与骨髓活检的骨髓浸润诊断价值进行比较,显示PET-CT有较高的敏感性及阴性预测价值,但阳性预测价值中等。见表 1。
| 表 1 PET-CT对骨髓浸润诊断价值的评价 |
|
|
28例中有14例接受肿块组织病理检查,标本为颈部肿物的4例,腹腔肿物3例,下颌部肿物2例,胃组织2例,鼻腔肿物1例,腋窝肿物1例,回盲末段1例。14例患儿有CD20、CD10、BCL-6表达;进行Ki-67表达检测的9例中有7例阳性率≥90%,2例阳性率为80%~90%;检测EBER的3例中有2例阳性;采用FISH方法检测3例肿块组织MYC基因重排,结果阳性。
2.4 骨髓MICM分析所有患儿均行骨髓涂片及活检,11例患儿的骨髓涂片肿瘤细胞比例 > 25%,5例肿瘤细胞 < 25%(均为弥漫大B细胞型),12例未检出肿瘤细胞。骨髓免疫分型除有CD20、CD10、CD79a等表达,可见kappa、Lambda、cIgM、FMC7、sIgM、Ki-67等表达。骨髓肿瘤细胞 > 25%的11例患儿均行染色体核型分析,6例为t(8;14)(q24;q32),2例为正常核型,1例为t(8;15;14)(q23;q1?3;q32),1例为dup(1)(q21q32),1例未见分裂相;7例患儿行骨髓细胞MYC基因检测,4例阳性。
2.5 治疗结局28例患儿按照CCCG-B-NHL 2010方案治疗(进入G2、G3和G4组的患儿分别为3、18和7例),其中20例联合美罗华治疗。2疗程后CR、PR例数分别为21例和7例。4例复发,均为成熟B-ALL,复发后均放弃治疗,其中1例为完成全部化疗后骨髓复发,1例为完成全部化疗后于病程8个月时中枢神经系统复发。
3例患儿在引导化疗(P方案)时出现肿瘤溶解综合征,其中1例因化疗前存在浮肿、少尿、肾脏重度弥漫性肿大、肾功能衰竭,化疗后肾功能恶化,血钾升至7.45 mmol/L,行体外血液净化后血尿素氮、血肌酐、血钾下降至正常;另2例经过水化、碱化尿液,别嘌呤醇降低尿酸和支持治疗,高尿酸、高钾、高磷、低钙血症均有效控制。第一疗程化疗后2例出现急性胰腺炎,3例出现消化道出血。
2.6 生存分析及预后影响因素分析28例患儿2年EFS为(85.7±6.6)%,BMB提示骨髓浸润、LDH≥500 IU/L、存在瘤性白血病的成熟B-NHL患儿2年EFS和累积生存率较低(P < 0.05)。见图 1、表 2。
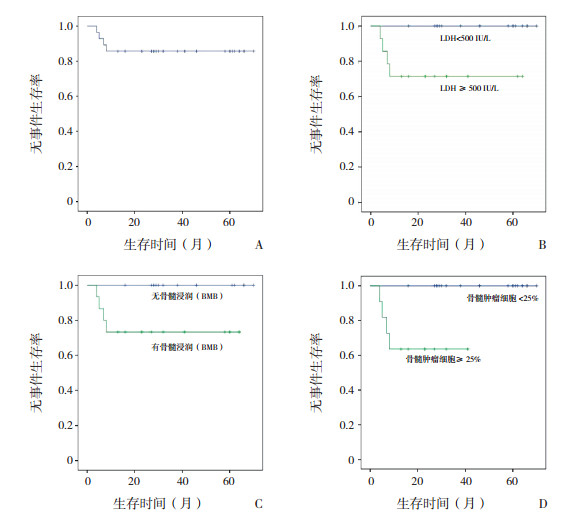
|
图 1 28例成熟B细胞非霍奇金淋巴瘤患儿的2年无事件生存率 A:28例患儿的2年EFS;B:不同LDH水平患儿的2年EFS比较;C:有或无骨髓浸润(BMB)患儿的2年EFS比较;D:有或无瘤性白血病患儿的2年EFS比较。 |
| 表 2 28例B-NHL患儿2年累积生存率的影响因素分析 |
|
|
近三十年来儿童成熟B-NHL的长期生存率取得了显著提高,国外多中心数据显示其治愈率已达到90%,Lee等报道61例(BL 46, DLBCL 15)儿童成熟B-NHL的5年EFS为95%,日本儿童白血病/淋巴瘤研究组报道其4年EFS为87.3%[4-5]。而我国儿童成熟B-NHL的长期生存率相对于发达国家仍有一定的差距。
儿童成熟B-NHL男性患病率高于女性,而BL的男性比例更高[6]。本组资料男/女比为4.6:1,BL的男/女比高达5.3:1,与文献相符。腹部肿块、颈部淋巴结肿大及扁桃体受累为儿童成熟B-NHL最常见的临床特点[7]。本组患儿首发表现也以颈部、颌面部肿物最多,但初诊时处于晚期(Ⅲ期+Ⅳ期)的比例较发达国家高[8-12],需要加强医生和患儿家属对该病的认识。
BL和DLBCL的临床和生物学特点有部分重叠,治疗方案和疗效基本相似[1]。但DLBCL很少累及骨髓和中枢神经系统、LDH很少升高;而BL中Ⅲ、Ⅳ期占70%左右,近半数患者LDH显著升高[7, 13]。本组资料显示,DLBCL只有25%存在骨髓浸润,所有患者LDH均小于2倍正常值,而BL骨髓浸润的达76.5%、71%的LDH大于2倍正常值。
骨髓浸润是成熟B-NHL分期判断和预后提示的重要指标,BMB仍然是判断骨髓浸润的“金标准”。新的影像学技术PET-CT可以无创、敏感地检测初诊时骨髓浸润。Cheson[14]报道骨髓浸润在PET-CT可能表现为局灶性的FDG摄取增高,或整个骨髓腔均匀的FDG摄取升高。Chen[15]认为与BMB相比,PET-CT检测儿童非霍奇金淋巴瘤骨髓浸润的敏感度为95% vs 56%,特异度为98% vs 100%。但也有研究[16-17]表明,经PET-CT提示有或者无骨髓浸润的成人DLBCL患者的EFS差异无统计学意义,而BMB提示有或者无骨髓浸润患者的EFS差异具有统计学意义。Bhojwani等[18]研究表明PET-CT对于儿童淋巴瘤患者骨髓浸润的敏感性及阴性预测值为100%,特异性60%,阳性预测价值25%。本组资料显示PET-CT诊断骨髓浸润的敏感度100%,但特异度仅66.67%,而且经PET-CT提示有或者无骨髓浸润患者的EFS差异无统计学意义,BMB提示骨髓浸润的EFS则较低。说明BMB对骨髓浸润的诊断更具有特异性,预后判断价值更大。PET-CT诊断儿童NHL骨髓浸润的假阳性率可达50%~70%,可能与骨髓局灶性纤维化、坏死、炎症、创伤有关。
中国抗癌协会儿童肿瘤协作组参考BFM 95方案制定了CCCG-B-NHL-2010方案[8]。使用此方案治疗成熟B-NHL患儿,四川大学华西第二医院报道2年EFS为74.1%[9],青岛大学附属医院的5年EFS为72.8%[10],上海儿童医学中心的5年EFS 86.7%[12]。而本组患儿2年EFS为85.7±6.6%。
DLBCL的长期EFS不低于BL[5]。本研究DLBCL与BL采用相同的高强度短疗程化疗方案,两者生存率的差异无统计学意义,但DLBCL无一例复发,而BL有3例复发,因此BL是否需要更强烈的化疗有待进一步研究。
关于联用利妥昔单抗治疗能否改善儿童成熟B-NHL的预后正在开展多中心临床试验,如NCT01595048[19]。本研究中20例(71.4%)患儿加用利妥昔单抗治疗,其累积生存率与单纯化疗组比较,差异无统计学意义。但本研究单纯化疗例数较少,还有待进一步扩大样本进行观察。
本组检测了MYC基因重排的10例中,2例MYC基因重排阴性的患儿复发,7例MYC基因重排阳性和1例重排阴性患儿均持续缓解,提示MYC基因重排与预后的关系无明显规律,与Szczepanowski报道[20]一致。新一代测序技术[21]发现大多数儿童成熟B-NHL可检测到ID3-TCF3-CCND3通路的基因突变,此类突变是否有预后判断价值仍需进一步证实。
CCCG-B-NHL 2010方案联合利妥昔单抗治疗儿童B-NHL疗效满意,PET-CT对于骨髓浸润判断的敏感性及阴性预测价值较高,但预后价值低于骨髓活检。骨髓活检发现的骨髓浸润与不良预后相关,对这类患者需要寻求新的治疗方法以提高长期生存率。
| [1] |
El-Mallawany NK, Cairo MS. Advances in the diagnosis and treatment of childhood and adolescent B-cell non-Hodgkin lymphoma[J]. Clin Adv Hematol Oncol, 2015, 13(2): 113-123. (  0) 0) |
| [2] |
中华医学会儿科学分会血液学组, 中国抗癌协会儿科专业委员会, 中华儿科杂志编辑委员会. 儿童非霍奇金淋巴瘤诊疗建议[J]. 中华儿科杂志, 2011, 49(3): 186-192. (  0) 0) |
| [3] |
Cerci JJ, Györke T, Fanti S, et al. Combined PET and biopsy evidence of marrow involvement improves prognostic prediction in diffuse large B-cell lymphoma[J]. J Nucl Med, 2014, 55(10): 1591-1597. DOI:10.2967/jnumed.113.134486 (  0) 0) |
| [4] |
Lee SH, Yoo KH, Sung KW, et al. Should children with non-Hodgkin lymphoma be treated with different protocols according to histopathologic subtype?[J]. Pediatr Blood Cancer, 2013, 60(11): 1842-1847. DOI:10.1002/pbc.v60.11 (  0) 0) |
| [5] |
Masahito T, Tetsuya M, Akira K, et al. Improved treatment results of children with B-Cell non-Hodgkin lymphoma:A report from the Japanese Pediatric Leukemia/Lymphoma Study Group B-NHL03 Study[J]. Pediatr Blood Cancer, 2014, 61(11): 1215-1221. (  0) 0) |
| [6] |
Burkhardt B, Zimmermann M, Oschlies I, et al. The impact of age and gender on biology, clinical features and treatment outcome of non-Hodgkin lymphoma in childhood and adolescence[J]. Br J Haematol, 2005, 131(1): 39-49. (  0) 0) |
| [7] |
Worch J, Rohde M, Burkhardt B. Mature B-cell lymphoma and leukemia in children and adolescents-review of standard chemotherapy regimen and perspectives[J]. Pediatr Hematol Oncol, 2013, 30(6): 465-483. DOI:10.3109/08880018.2013.783891 (  0) 0) |
| [8] |
中华医学会儿科学分会血液学组, 中国抗癌协会儿科专业委员会. 中国儿童成熟B细胞非霍奇金淋巴瘤多中心诊治报告[J]. 中华儿科杂志, 2014, 52(9): 649-654. (  0) 0) |
| [9] |
郭佳, 朱易萍, 高举, 等. 儿童成熟B细胞非霍奇金淋巴瘤急性淋巴细胞白血病43例临床及预后分析[J]. 中国实验血液学杂志, 2016, 24(1): 72-79. (  0) 0) |
| [10] |
姜健, 宋学文, 徐慧娟, 等. 儿童非霍奇金淋巴瘤78例临床及预后分析[J]. 临床儿科杂志, 2015, 33(8): 715-719. (  0) 0) |
| [11] |
孙晓非, 甄子俊, 夏奕, 等. 改良NHL-BFM-90方案治疗儿童及青少年伯基特淋巴瘤和弥漫大B细胞淋巴瘤的远期疗效[J]. 中华血液学杂志, 2013, 34(12): 1032-1037. DOI:10.3760/cma.j.issn.0253-2727.2013.12.008 (  0) 0) |
| [12] |
叶启东, 潘慈, 薛惠良, 等. 104例B细胞非霍奇金淋巴瘤患儿疗效分析[J]. 中华血液学杂志, 2013, 34(5): 399-403. DOI:10.3760/cma.j.issn.0253-2727.2013.05.005 (  0) 0) |
| [13] |
Reiter A, Klapper W. Recent advances in the understanding and management of diffuse large B-cell lymphoma in children[J]. Br J Haematol, 2008, 142(3): 329-347. (  0) 0) |
| [14] |
Cheson BD. Role of functional imaging in the management of lymphoma[J]. J Clin Oncol, 2011, 29(14): 1844-1854. DOI:10.1200/JCO.2010.32.5225 (  0) 0) |
| [15] |
Chen S, Wang S, He K, et al. PET/CT predicts bone marrow involvement in paediatric non-Hodgkin lymphoma and may preclude the need for bone marrow biopsy in selected patients[J]. Eur Radiol, 2018 Jan 30. doi: 10.1007/s00330-018-5306-5. [Epub ahead of print].
(  0) 0) |
| [16] |
Khan AB, Barrington SF, Mikhaeel NG, et al. PET-CT staging of DLBCL accurately identifies and provides new insight into the clinical significance of bone marrow involvement[J]. Blood, 2013, 122(1): 61-67. DOI:10.1182/blood-2012-12-473389 (  0) 0) |
| [17] |
Adams HJ, Kwee TC, Fijnheer R, et al. Bone marrow 18 F-fluoro-2-deoxy-D-glucose positron emission tomography/computed tomography cannot replace bone marrow biopsy in diffuse large B-cell lymphoma[J]. Am J Hematol, 2014, 89(7): 726-731. DOI:10.1002/ajh.23730 (  0) 0) |
| [18] |
Bhojwani D, McCarville MB, Choi JK, et al. The role of FDG-PET/CT in the evaluation of residual disease in paediatric non-Hodgkin lymphoma[J]. Br J Haematol, 2015, 168(6): 845-853. DOI:10.1111/bjh.2015.168.issue-6 (  0) 0) |
| [19] |
Sandlund JT. Non-Hodgkin Lymphoma in Children[J]. Curr Hematol Malig Rep, 2015, 10(3): 237-243. DOI:10.1007/s11899-015-0277-y (  0) 0) |
| [20] |
Szczepanowski M, Lange J, Kohler CW, et al. Cell-of-origin classification by gene expression and MYC-rearrangements in diffuse large B-cell lymphoma of children and adolescents[J]. Br J Haematol, 2017, 179(1): 116-119. (  0) 0) |
| [21] |
Rohde M, Bonn BR, Zimmermann M, et al. Relevance of ID3-TCF3-CCND3 pathway mutations in pediatric aggressive B-cell lymphoma treated according to the NHL-BFM protocols[J]. Haematologica, 2017, 102(6): 1091-1098. DOI:10.3324/haematol.2016.156885 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


