Sotos综合征(OMIM 117550)又称儿童巨脑综合征,是一种较为罕见的常染色体显性遗传性疾病,其发病率约为1/50 000,临床表现为出生后骨骼生长较快,体型巨大、特殊面容、语言和运动发育迟缓;部分患儿存在听力障碍、视力异常以及癫癎发作等症状[1-2]。Kurotaki等[3]发现,位于染色体5q35区域的NSD1基因异常可导致Sotos综合征。随着测序技术的发展,90%以上的Sotos综合征患儿可检测到NSD1基因突变[4]。本研究利用染色体微阵列技术以及高通量测序技术对3例存在特殊面容及运动发育落后的患者进行基因检测,并复习相关文献,探讨Sotos综合征的临床表型以及与基因型的相关性。
1 资料与方法 1.1 研究对象3例患儿均为男性,年龄7~13个月,均以特殊面容(前额突出、眼距宽、下颌尖长)、运动发育迟缓、智力落后就诊,身长和头围方面仅病例1的头围超过2 SD;头颅CT均显示脑室扩大,临床特点见表 1。3例患者的父母均身体健康,非近亲结婚,家族中均无类似病史。3例患儿均予以早期康复及感统训练等对症治疗。
| 表 1 3例患儿的临床特点 |
|
|
Sotos综合征诊断参照文献[5]:(1)特殊面容,包括前额突起、眼距过宽、下颌尖长、高腭弓等;(2)过度生长:头围和身高明显增加;(3)骨龄超前;(4)智力发育迟缓。此外还有早期喂养困难、肌张力低下、黄疸以及癫癎等非特异性表现。本研究3例患儿均有特殊面容和运动发育迟缓、智力落后,2例有骨龄超前,考虑Sotos综合征可能。3例患儿均进行SNP芯片检测以及拷贝数异常区域验证,检测阴性的患儿进行高通量测序分析。
1.2 SNP芯片检测染色体微缺失/微重复或者高通量测序检测基因突变取患儿及其父母外周静脉血各2 mL(EDTA抗凝),提取基因组DNA,调整DNA浓度为50 ng/μL,采用Illunima cyto SNP芯片进行染色体微缺失/微重复检测,利用荧光定量PCR方法对拷贝数异常的区域进行验证分析,内参为ACTB基因。芯片检测阴性的送华大基因公司进行智力低下相关基因的高通量测序,检测到的突变利用Sanger测序验证。
本研究得到患者家属的知情同意,并获得医院伦理委员会批准。
2 结果 2.1 分子检测结果SNP芯片检测发现患者1(P1)的染色体5q35.2区域存在大片段缺失(染色体位置:175508587-177293341),大小为1.75 Mb。该区域包括NSD1、DDX41、PROP1、B4GALT7等基因,选取NSD1基因为目的基因,利用荧光定量PCR方法对拷贝数异常区域验证分析显示,相对于正常对照,患儿NSD1基因拷贝数减半,患儿父母的NSD1基因拷贝数均未见异常。见图 1。
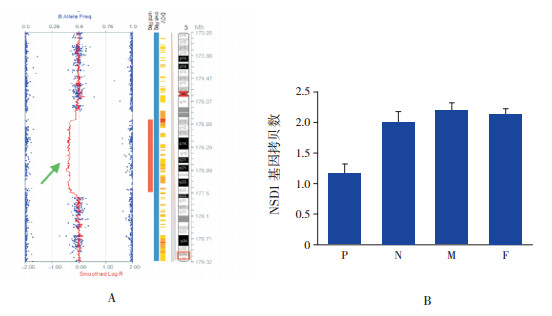
|
图 1 患者1的遗传学检测结果 A. SNP芯片检测结果:染色体5q35.2区域缺失,箭头所指为缺失区域。B.荧光定量PCR验证结果:患儿NSD1基因缺失一个拷贝;P示患者,N正常对照,M患者母亲,F患者父亲。 |
对于SNP芯片检测阴性的患儿2、3(P2、P3)进行高通量测序分析(图 2),发现P2的NSD1基因外显子2存在c.1157T > G杂合突变,该突变为错义突变,在dbSNP数据库、千人基因组数据库中未见收录,患者父母的该位点未见异常;P3的NSD1基因外显子2存在c.1177G > T突变,为已知的Sotos综合征致病性变异,其父母该位点未见异常。
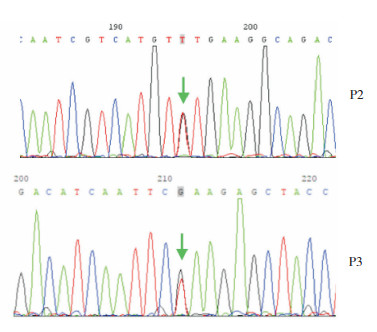
|
图 2 患者2和3的NSD1基因测序结果 P2存在c.1157T > G杂合突变,P3存在c.1177G > T杂合突变。箭头所指为突变位点。 |
P2的NSD1基因c.1157T > G(p.F386L)杂合突变的Polyphen2软件预测值为0.997(分值越接近1,对蛋白功能影响越大),SIFT软件预测得分为0.02(分值越接近0,危害越大)。不同物种(人、家鼠、斑马鱼、猕猴、牛、狗)保守序列分析发现该位点较保守,见图 3。
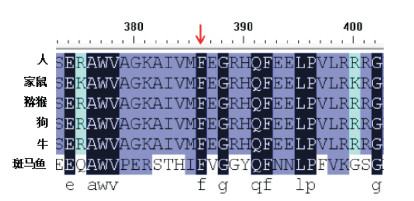
|
图 3 不同物种间NSD1基因编码的蛋白保守性分析 黑色背景的氨基酸在不同的物种之间保持不变,提示位点保守;箭头所指提示NSD1蛋白第386位氨基酸在不同物种间保守。 |
Sotos综合征是常染色体显性遗传的先天性生长过度症,疾病呈散发性,少数为家族性遗传,于1964年由Sotos等首先报道[6]。该病表现为多种先天性异常:身材高大、头围增大,脑室增大、尖下颌、眼距过宽,不同程度的智力落后;部分患者还存在听力障碍、斜视、眼球震颤、行为异常、癫癎发作、肌张力减退等症状[7]。其中特殊面容、过度生长以及智力落后是诊断的关键,但部分患者并不典型。本研究纳入的3例患者均存在前额突出、眼距宽或尖下颌等特殊面容,以及智力运动发育迟缓、脑室扩大,临床特点与Sotos综合征相符,但在身长和头围方面仅P1的头围超过2 SD,过度生长的特征不典型,但本研究患儿年龄仅7~13个月,需要动态随访。国内报道的3例Sotos综合征有2例过度生长不典型[7]。
Sotos综合征与染色体5q35区域的NSD1基因异常有关,90%以上可检测到NSD1基因突变[3-4]。NSD1基因在大脑、肾脏、骨骼肌、胸腺以及外周血白细胞中均有表达,有23个外显子,cDNA长度为8 552 bp,编码一个含有2 696个氨基酸的蛋白质[8]。NSD1蛋白有至少10个结构域,可与核受体相互作用,发挥激活或者阻止转录的作用[8]。70%~90%的Sotos综合征患者存在NSD1基因突变(错义突变、无义突变、剪接位点突变等),约10%存在5q35区域(包括NSD1基因)缺失。基因突变和染色体微缺失在不同种族的Sotos综合征患者所占的比例不同[6, 9]。本研究采用全基因组芯片技术检测发现,患者1的5q35.2区域存在缺失,与文献报道一致。全基因组芯片技术检测无异常的另两例患儿经高通量测序发现,患者2的NSD1基因存在未见报道的c.1157T > G杂合突变,可使NSD1基因编码的蛋白第386位氨基酸由苯丙氨酸突变为亮氨酸,生物信息学预测该位点突变具有致病性;患者3的NSD1基因存在c.1177G > T突变,该突变为已报道的Sotos综合征致病性变异[10],可导致编码的蛋白第393位氨基酸由谷氨酸变为终止密码子,产生截断的蛋白。Sotos综合征的临床表型与基因型有一定的相关性。染色体5q35.2微缺失和NSD1基因突变均可致智力障碍、过度生长,但染色体缺失患者的智力障碍较严重,过度生长症状较轻[6, 11]。本研究患者1存在染色体微缺失,有智力低下症状。患者2、3均存在NSD1基因点突变,其中患者3身长超过1.5个标准差,需动态观察有无过度生长。Sotos综合征患者的身高在成年期趋于正常,因此成年患者头围大为突出表现[7]。
导致过度生长的疾病要注意合并肿瘤的可能,但研究发现Sotos综合征患者肿瘤的发生率低于3%[12]。约20%的Sotos综合征患儿可能出现不同程度的肾脏异常、癫癎、先天性心脏病以及脊柱侧弯等症状[13]。本研究患者1虽无癫癎发作,但脑电图异常,应密切随访发作情况。Sotos综合征目前以对症治疗为主,可针对智力运动发育落后进行早期康复治疗[5-6]。
综上所述,Sotos综合征主要临床表现为发育迟缓、智力障碍、面容异常以及其他系统畸形。高通量测序及染色体芯片技术有助于确诊和提高对发病机制的认识。
| [1] |
Leventopoulos G, Kitsiou-Tzeli S, Kritikos K, et al. A clinical study of Sotos syndrome patients with review of the literature[J]. Pediatr Neurol, 2009, 40(5): 357-364. DOI:10.1016/j.pediatrneurol.2008.11.013 (  0) 0) |
| [2] |
Lane C, Milne E, Freeth M. Cognition and behaviour in Sotos syndrome:A systematic review[J]. PLoS One, 2016, 11(2): e0149189. DOI:10.1371/journal.pone.0149189 (  0) 0) |
| [3] |
Kurotaki N, Harada N, Yoshiura K, et al. Molecular characterization of NSD1, a human homologue of the mouse Nsd1 gene[J]. Gene, 2001, 279(2): 197-204. DOI:10.1016/S0378-1119(01)00750-8 (  0) 0) |
| [4] |
Tatton-Brown K, Rahman N. Sotos syndrome[J]. Eur J Hum Genet, 2007, 15(3): 264-271. DOI:10.1038/sj.ejhg.5201686 (  0) 0) |
| [5] |
Cole TR, Hughes HE. Sotos syndrome:a study of the diagnostic criteria and natural history[J]. J Med Genet, 1994, 31(1): 20-32. DOI:10.1136/jmg.31.1.20 (  0) 0) |
| [6] |
Sotos JF, Dodge PR, Muirhead D, et al. Cerebral gigantism in childhood. A syndrome of excessively rapid growth with acromegalic features and a nonprogressive neurologic disorder[J]. N Engl J Med, 1964, 271: 109-116. DOI:10.1056/NEJM196407162710301 (  0) 0) |
| [7] |
康路路, 刘晓青, 张惠文, 等. 3例Sotos综合征的基因型与临床表现分析[J]. 上海交通大学学报(医学版), 2016, 36(8): 1165-1170. (  0) 0) |
| [8] |
Tatton-Brown K, Rahman N. Clinical features of NSD1-positive Sotos syndrome[J]. Clin Dysmorphol, 2004, 13(4): 199-204. DOI:10.1097/00019605-200410000-00001 (  0) 0) |
| [9] |
Sohn YB, Lee CG, Ko JM, et al. Clinical and genetic spectrum of 18 unrelated Korean patients with Sotos syndrome:frequent 5q35 microdeletion and identification of four novel NSDl mutations[J]. J Hum Genet, 2013, 58(2): 73-77. DOI:10.1038/jhg.2012.135 (  0) 0) |
| [10] |
Tong TM, Hau EW, Lo IF, et al. Spectrum of NSD1 gene mutations in southern Chinese patients with Sotos syndrome[J]. Chin Med J (Engl), 2005, 118(18): 1499-1506. (  0) 0) |
| [11] |
Nagai T, Matsumoto N, Kurotaki N, et al. Sotos syndrome and haploinsufficiency of NSD1:clinical features of intragenic mutations and submicroscopic deletions[J]. J Med Genet, 2003, 40(4): 285-289. DOI:10.1136/jmg.40.4.285 (  0) 0) |
| [12] |
Tatton-Brown K, Douglas J, Coleman K, et al. Genotype-phenotype associations in Sotos syndrome:an analysis of 266 individuals with NSD1 aberrations[J]. Am J Hum Genet, 2005, 77(2): 193-204. DOI:10.1086/432082 (  0) 0) |
| [13] |
Tatton-Brown K, Rahman N. Sotos syndrome[J]. Eur J Hum Genet, 2007, 15(3): 264-271. DOI:10.1038/sj.ejhg.5201686 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20

