2. 宁夏医科大学生育力保持教育部重点实验室, 宁夏 银川 750004
正常情况下,人类染色体两端的端粒阻止染色体两臂融合成环。在某些因素的刺激下,染色体可分别在长、短臂发生断裂,具有着丝粒的片段两端可重新融合形成环状染色体[1-2]。13号环状染色体是一种少见的染色体异常,最早在1968年由Lejune报道。在活产儿中,其发病率约为1:58 000[3]。本研究应用外周血染色体核型分析、荧光原位杂交(metaphase fluorescence in situ hybridization, FISH)技术及微阵列比较基因组杂交(array comparative genomic hybridization, aCGH)技术等细胞遗传学及分子遗传学方法对1例嵌合型13号环状染色体综合征患儿进行遗传学分析,并与国内外报道的13号环状染色体综合征病例进行比较,探讨此综合征临床表型的多样性以及染色体核型间的关系。
1 资料与方法 1.1 研究对象患儿,女,5个月,因生长发育迟缓就诊。患儿视听反应较差,不易逗笑,竖头不稳,不会翻身。既往无特殊。患儿系第2胎,因宫内发育迟缓剖腹产出生,出生胎龄38周、出生体重1.55 kg。父母非近亲结婚,表型正常,否认遗传病家族史。体格检查:身长60 cm(-3 SD),体重5.5 kg(< -3 SD),头围37.2 cm,前囟3 cm×3 cm,发育落后、营养差,特殊面容(小头畸形、眼距宽、耳位偏低、鼻梁扁平、短人中),心肺(-),四肢肌张力较低,腱反射较弱,一侧小阴唇缺失。辅助检查:胸部X线、腹部超声、心脏超声及头颅MRI均未见明显异常。
本研究经医院医学伦理委员会批准及患儿父母知情同意,获取患儿外周血样本进行G显带染色体核型分析、FISH及aCGH分析;获取其父母及哥哥外周血行G显带染色体核型分析。
1.2 外周血染色体核型分析取0.3 mL外周血接种于5 mL淋巴细胞培养基(广州拜迪),接种两瓶,置于二氧化碳培养箱中37℃培养72 h,加入终浓度为0.5 μg/mL的秋水仙素后置于培养箱2 h。将培养物吸入离心管,离心后弃去上清,加入0.075 mol/L的氯化钾溶液,37℃水浴25 min,随后加入1 mL卡诺固定液(甲醇:冰醋酸=3:1)预固定10 min,再用8 mL固定液重复固定2次后进行制片。玻片置于75℃烤箱中3 h后取出,0.25%胰蛋白酶消化约1 min后,吉姆萨染液染色进行G显带。ZEISS染色体核型分析系统分析100个分裂相。
1.3 FISH检测选用英国Cytocell公司的探针与外周血中期细胞悬液进行杂交并检测。选用RB1探针(红色)标记13q14区域、13qter探针(绿色)标记13q34区域。
1.4 aCGH检测采用Qiagen公司的QIAamp DNA Blood mini kit试剂盒提取患儿外周血DNA。应用美国Affymetrix CytoScan ®HD Array微阵列芯片进行分析,实验方法依据厂家提供的标准操作规程进行。包括限制性酶消化、消化产物的连接、PCR扩增反应、PCR产物纯化、纯化产物的定量、片段化、片段化产物的标记、芯片杂交和芯片洗涤、染色、扫描等步骤。使用Affymetrix配套软件Chromosome Analysis Suite进行结果分析,以Affymetrix提供的正常人DNA作为对照。
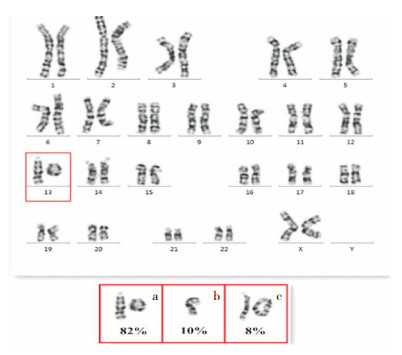
2 结果 2.1 外周血染色体核型分析患儿核型为46, XX, r(13)(p11q33)[82]/45, XX, -13[10]/46, XX, r(13;13)(p11q33;p11q33)[8],表明患儿82%的细胞存在由一条13号染色体形成的小环状染色体;8%的细胞存在由两条13号染色体形成的双着丝粒大环状染色体,断裂与重接位点均位于13p11和13q33;10%的细胞存在一条13号染色体缺失。见图 1。其父母及哥哥的核型均未见异常。患儿C显带标本显示小环染色体有一个C带阳性区,大环状染色体有两个C带阳性区。N显带标本显示各个环状染色体均无银染阳性区。
|
图 1 患儿染色体核型图 患儿13号染色体存在a、b、c三种嵌合核型(如红色框内所示)。a示一条13号染色体形成小环状染色体;b示一条13号染色体缺失;c示两条13号染色体形成的双着丝粒大环状染色体。 |
患儿外周血中期分裂相FISH结果显示,正常13号染色体分别有标记13q14区域的红色探针和标记13q34区域的绿色探针,小环有一个标记13q14区域的红色探针,大环有两个标记13q14区域的红色探针,大环和小环均未见标记13qter区域的绿色探针(图 2)。

|
图 2 患儿外周血中期分裂相FISH结果 A图中黄色箭头所示为正常13号染色体(分别有标记13q14区域的红色探针和标记13q34区域的绿色探针),红色箭头所示为小环状染色体(仅有一个标记13q14区域的红色探针);B图中箭头所示为大环状染色体(有两个标记13q14区域的红色探针)。 |
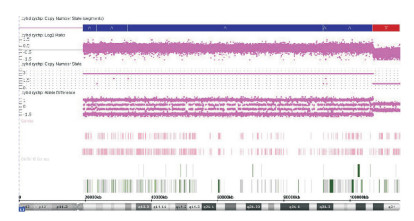
aCGH检测结果显示13号染色体在13q11q33.2区域和13q33.2q34区域分别有87.5 Mb的重复和8.2 Mb的缺失(arr[hg19]13q11q33.2(19, 436, 286-106, 924, 300)×3, 13q33.2q34(106, 925, 506-115, 107, 733) ×1),见图 3。
|
图 3 患儿aCGH检测结果 13号染色体在13q11q33.2区域和13q33.2q34区域分别有87.5 Mb的重复(蓝色实线所示区域)和8.2 Mb的缺失(红色实线所示区域)。 |
13号染色体伴长臂巨大缺失所致的严重临床表现称为13号染色体综合征。本病的临床特征多变,与遗传物质丢失的数量和部位、环的稳定性及不同核型的嵌合比例均有关[4-6]。临床表现包括宫内发育迟缓、智力发育落后、生长发育迟缓、小头畸形、特殊面容(如眼距过宽、小颌、内眦赘皮、小眼畸形、耳位偏低、鼻梁扁平等)、唇裂和腭裂、视网膜母细胞瘤、生殖器畸形、手指/足趾畸形等[7-9]。
本例患儿染色体核型为嵌合型,且所有淋巴细胞未见正常核型存在。环状染色体形成原因可能为:在卵子或精子形成过程中、或者合子开始第一次卵裂之前,13号染色体受到外界因素刺激,染色体长、短臂末端发生断裂并且融合成环。环状染色体在接下来的有丝分裂过程中,如果不发生姐妹染色体单体的交换,则复制形成两个环状染色体分别进入子细胞;如果发生姐妹染色体的交换,则形成比原来大一倍的大环[10-12]。本例患儿染色体核型的13号染色体完全单体性(10%)、小环状染色体(82%)和大环状染色体(8%)即由此造成。本研究患儿主要表现为生长发育迟缓、特殊面容及小阴唇一侧缺失。与13号环状染色体综合征的特征相符。
为了验证染色体核型结果,进一步用FISH验证13号染色体末端区域的缺失,并通过aCGH技术明确断裂点,结果表明:13号染色体在13q11q33.2区域有13号染色体的部分三体,在13q33.2q34区域有末端缺失造成的部分单体。
13q-综合征是由于13号染色体长臂部分缺失导致,其常见临床表型有发育迟缓、特殊面容,以及巩膜缺损、视网膜母细胞瘤、马蹄内翻足、尿道下裂、隐睾、心脏畸形等[13]。缺失的部位和大小决定了患者的症状,如果是末端少部分缺失而不涉及q32区域,则临床表型较轻。如果缺失包括q32区域,常导致严重的智力障碍、生长迟缓或重度畸形,如中枢神经系统缺陷、四肢畸形、心脏畸形及生殖器官异常等[14]。本例患儿13号染色体断裂位点位于q33,缺失部位未包括q32区域,因而未表现出严重的器官畸形,仅有生长发育迟缓、头面部特殊面容及因小阴唇缺失。
13三体综合征的发病率约为1:5 000,约50%在出生半年内死亡,常表现为生长发育迟缓、中枢神系统发育异常、先天性心脏畸形等;另一特征为泌尿生殖系统发育异常,表现为尿道下裂、隐睾、先天性肛门闭锁等[15-16]。本患儿染色体核型含有部分大环,造成13号染色体的部分三体,这可能是患儿小阴唇缺失的一个原因。
将本例与国内外报道的13号环状染色体综合征病例进行比较(表 1),发现13号环状染色体综合征的临床表型多变,包括发育迟缓和畸形如小头畸形、手指或足趾畸形、生殖器异常、骨骼异常等等。其严重程度与遗传物质丢失的数量和部位有关,13号染色体长臂断裂位点越靠近着丝粒,丢失的遗传物质越多,临床表现越严重。Zhao等[17]报道的病例13号染色体在长臂的断裂位于q31.3,丢失的遗传物质更多,因而表现出如室间隔缺损等心脏畸形。而断裂位点相同的病患,大环造成的13号染色体部分三体的比例越高,临床表现越严重。Kaylor等[18]报道的病例13号染色体大环比例达6%,患者表现出生殖器异常和先天性肛门闭锁。
| 表 1 13号环状染色体综合征常见临床表型比较 |
|
|
13号染色体上存在许多关键基因,其中SOX1基因定位于13q34,编码SOX家族的转录因子,在神经细胞中表达,参与胚胎发育,编码的蛋白与其他蛋白形成复合体作为转录调控因子[19]。CHAMP1基因定位于13号染色体长臂末端,编码锌指蛋白,在神经系统发育过程中起重要作用[20]。SOX1基因和CHAMP1基因单倍剂量的不足可能影响大脑的发育和功能,导致大脑发育障碍及小头畸形。表 1中所有患儿均涉及13号染色体长臂末端区域的缺失,除本例及部分患儿因年龄过小无法判断是否存在智力障碍,其余均表现出智力低下。DAOA基因定位于13q33,其编码的蛋白调节谷氨酸能神经递质,该蛋白的缺乏与狂躁症、精神分裂症等的发生密切相关[21]。表 1患儿包括本例均涉及此区域缺失,需要动态监测神经、精神症状的出现。RB基因定位于13q14,为视网膜母细胞瘤易感基因,是一种肿瘤抑制基因,编码一种核结合蛋白,在细胞核中以活化的脱磷酸化和失活的磷酸化形式存在。
13号染色体综合征患儿的常见临床表型包括生长发育迟缓、精神发育障碍和畸形如小头畸形、手指或足趾畸形、生殖器异常、骨骼畸形等,而且表型多变,这主要与染色体区带中遗传物质丢失的数量及部位不同以及不同核型嵌合比例的不同相关。
| [1] |
Pace NP, Maggouta F, Twigden M, et al. Molecular cytogenetic characterisation of a novel de novo ring chromosome 6 involving a terminal 6p deletion and terminal 6q duplication in the different arms of the same chromosome[J]. Mol Cytogenet, 2017, 10: 9. DOI:10.1186/s13039-017-0311-y (  0) 0) |
| [2] |
Rossi E, Riegel M, Messa J, et al. Duplications in addition to terminal deletions are present in a proportion of ring chromosomes:clues to the mechanisms of formation[J]. J Med Genet, 2008, 45(3): 147-154. (  0) 0) |
| [3] |
Bedoyan JK, Flore LA, Alkatib A, et al. Transmission of ring chromosome 13 from a mother to daughter with both having a 46, XX, r(13)(p13q34) karyotype[J]. Am J Med Genet, 2004, 129A(3): 316-320. DOI:10.1002/(ISSN)1096-8628 (  0) 0) |
| [4] |
李静, 李亚梅, 陈雪, 等. 一例嵌合型环状13号染色体病例报道和文献回顾[J]. 中国优生与遗传杂志, 2017, 25(8): 76-77. (  0) 0) |
| [5] |
Özsu E, Yeşiltepe Mutlu G, Ipekçi B. Ring chromosome 13 and ambiguous genitalia[J]. J Clin Res Pediatr Endocrinol, 2014, 6(2): 122-124. (  0) 0) |
| [6] |
Su PH, Chen CP, Su YN, et al. Smallest critical region for microcephaly in a patient with mosaic ring chromosome 13[J]. Genet Mol Res, 2013, 12(2): 1311-1317. DOI:10.4238/2013.April.25.2 (  0) 0) |
| [7] |
Rodrigues MA, Moreira RV, Ribeiro PD. Case report of ring chromosome 13:46, XX, r(13)(p13q34)/46, XX, dic r(13;13)(p13q34;p13q34)[J]. Brit J Med Med Res, 2015, 5(1): 123-128. DOI:10.9734/BJMMR (  0) 0) |
| [8] |
Liao C, Fu F, Zhang L. Ring chromosome 13 syndrome characterized by high resolution array based comparative genomic hybridization in patient with 47, XYY syndrome:a case report[J]. J Med Case Rep, 2011, 5: 99. DOI:10.1186/1752-1947-5-99 (  0) 0) |
| [9] |
Chen CP, Tsai CH, Chern SR, et al. Prenatal diagnosis and molecular cytogenetic characterization of mosaic ring chromosome 13[J]. Gene, 2013, 529: 163-168. DOI:10.1016/j.gene.2013.07.050 (  0) 0) |
| [10] |
Uwineza A, Pierquin G, Gaillez S, et al. Clinical, cytogenetic and molecular characterization of two cases of mosaic ring chromosome 13[J]. Genet Couns, 2013, 24(2): 193-200. (  0) 0) |
| [11] |
Sodré CP, Guilherme RS, Meloni VF, et al. Ring chromosome instability evaluation in six patients with autosomal rings[J]. Genet Mol Res, 2010, 9(1): 134-143. DOI:10.4238/vol9-1gmr707 (  0) 0) |
| [12] |
Kosztolányi G. The Genetics and clinical characteristics of constitutional ring chromosomes[J]. J Assoc Genet Technol, 2009, 35(2): 444-448. (  0) 0) |
| [13] |
赵鼎, 杨俊梅, 宋银森. 13号染色体长臂部分缺失综合征一例报告[J]. 中国优生与遗传杂志, 2011, 19(9): 64. (  0) 0) |
| [14] |
Garcia RE, Garcia GE, Perez SA, et al. A new observation of 13q deletion syndrome:severe undescribed features[J]. Genet Couns, 2015, 26(2): 213-217. (  0) 0) |
| [15] |
Wu J, Springett A, Morris JK. Survival of trisomy 18(Edwards syndrome) and trisomy 13(Patau Syndrome) in England and Wales:2004-2011[J]. Am J Med Genet A, 2013, 161A(10): 2512-2518. (  0) 0) |
| [16] |
Rios A, Furdon SA, Adams D, et al. Recognizing the clinical features of Trisomy 13 syndrome[J]. Adv Neonatal Care, 2004, 4(6): 332-343. DOI:10.1016/j.adnc.2004.09.008 (  0) 0) |
| [17] |
Zhao XR, Han X, Wang YL, et al. Molecular and cytogenetic characterization of a fetus with mosaic ring chromosome 13:a very rare case[J]. Chinese Med J-Peking, 2017, 130: 3007-3008. (  0) 0) |
| [18] |
Kaylor J, Alfaro M, Ishwar A, et al. Molecular and cytogenetic evaluation of a patient with ring chromosome 13 and discordant results[J]. Cytogenet Genome Res, 2014, 144: 104-108. DOI:10.1159/000368649 (  0) 0) |
| [19] |
Bylund M, Andersson E, Novitch BG, et al. Vertebrate neurogenesis is counteracted by Sox1-3 activity[J]. Nat Neurosci, 2003, 6(11): 1162-1168. DOI:10.1038/nn1131 (  0) 0) |
| [20] |
Hempel M, Cremer K, Ockeloen CW, et al. De novo mutations in CHAMP1 cause intellectual disability with severe speech impairment[J]. Am J Hum Genet, 2015, 97(3): 493-500. DOI:10.1016/j.ajhg.2015.08.003 (  0) 0) |
| [21] |
Hattori E, Liu C, Badner JA, et al. Polymorphisms at the G72/G30 gene locus, on 13q33, are associated with bipolar disorder in two independent pedigree series[J]. Am J Hum Genet, 2003, 72(5): 1131-1140. DOI:10.1086/374822 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


