先天性心脏病(congenital heart disease, CHD)是由心脏和/或大血管组织结构异常导致的心脏形态与功能改变的一组疾病。无论是可自愈的微小畸形或缺损还是导致胎儿先天缺陷或死亡的严重畸形都是CHD的具体表现形式[1]。尽管检测技术与治疗水平不断发展,但仍有3%的CHD婴儿死亡,46%的先天畸形死亡归因于CHD[2]。CHD是由遗传因素和环境因素共同作用引起,国内外对CHD的遗传机制研究表明染色体畸变和单、多基因突变可引发CHD,并且证实了心脏转录因子在调控心脏发育过程中起到重要作用[3]。已有的心脏转录因子基因突变的Meta分析仅限于基因突变人数对CHD的影响[4]或未区分种族只针对NKX2.5基因中63A > G(rs2277923)和606G > C(rs3729753)的等位基因频率与CHD的关系[5]。本研究从对心脏早期发育最重要的3种心脏转录因子NKX2.5、GATA4、TBX5和GATA家族的辅助转录因子FOG2入手,汇总比较了4种基因的所有单核苷酸多态性(SNP)在中国CHD患者和正常对照组中的分布情况,评价中国人群心脏转录因子的基因SNP与CHD之间的关系。
1 资料与方法 1.1 检索策略检索PubMed、Google学术、中国知网、万方数据资源系统、重庆维普数据库从建库到2017年12月发表的文献。检索词为先天性心脏病、心脏转录因子、单核苷酸多态性、NKX2.5、GATA4、TBX5、FOG2、病例对照研究等及其相应的英文表达。
1.2 文献纳入与排除标准纳入标准:(1)研究对象为单纯性CHD(指不伴有其他器官的畸形)患者;(2)研究类型为基于中国人群的病例对照研究;(3)研究目标为NKX2.5、GATA4、TBX5、FOG2基因所有位点的SNP与CHD的关系;(4)文中数据可以直接提取或通过计算得到相应基因位点SNP与CHD的比值比(OR)及95%可信区间(CI);(5)如果同一作者在两篇文章中纳入同一对象,选取最全面且发表时间最近的文章。排除动物实验、重复报告等文章。
1.3 资料提取制定原始信息提取表,收集内容如下:(1)第一作者及发表年份;(2)基因类型、SNP位点及突变类型;(3)CHD类型;(4)CHD组及对照组样本量;(5)DNA来源(血液或心肌组织);(6)Hardy-Weinberg平衡(HWE)检验结果;(7)文献质量评分。
1.4 文献质量评价纳入文献的质量参考Newcastle-Ottawa Scale(NOS)评分标准[6]。该量表的评分范围为0~9分,当评分≥7分认为是高质量研究。筛选文献、提取数据、质量评价工作由两人独立完成,出现分歧时共同讨论解决或由第三人协商直至达成一致。
1.5 统计学分析心脏转录因子的基因SNP与CHD的关系均采用OR值及95%CI表示。当同一基因位点研究文献数≥2时,将同一位点的SNP与CHD关系的数据进行合并整理。异质性检验用Q检验和I2值表示,当I2 > 50%或P≤0.1时结果存在异质性,使用随机效应模型;反之,使用固定效应模型分析。若目标基因的位点只在单篇文献中提及,则提取文献中相关数据计算位点的SNP与CHD的关系。当总文献数量≥10时采用敏感性分析评价结果的稳定性并使用“漏斗图”、Egger's检验分析可能存在的发表偏倚。Egger's检验应用SAS 9.2软件,其余统计分析采用Revman 5.3软件。
2 结果 2.1 文献纳入情况初检索共检出281篇文献,阅读标题、摘要和全文,剔除不符合纳入标准及重复文献258篇,最终纳入23篇文献[7-29](8篇为英文,15篇为中文)。
纳入的23篇文献中,CHD患者合计5 385人,正常对照合计5 125人。NKX2.5基因共14篇文献涉及7个位点研究基因型或等位基因频率在CHD组和对照组中的差异,GATA4基因有9篇涉及17个位点,TBX5基因有2篇涉及6个位点,FOG2基因有1篇涉及6个位点。14篇文献对具体CHD亚型与基因SNP关系进行分析。纳入文献的NOS平均评分为7.3分,说明纳入文献的质量相对较高。纳入文献的具体特征见表 1。
| 表 1 23篇纳入文献的基本特征 |
|
|
由于很多基因位点只在单篇文献中有报道,因此本研究将2篇及2篇以上的同一基因位点的相同基因型或等位基因与CHD关系的数据进行合并整理(表 2)。Meta分析结果显示,NKX2.5中两个当前研究较多的SNP位点rs2277923和rs3729753的基因型和等位基因频率在CHD患者和对照组的差异均无统计学意义。GATA4中rs1139244和rs867858的基因型和等位基因频率及rs904018的基因型(GA/AA)频率在CHD患者和对照组中差异均有统计学意义。GATA4中rs1139244和rs867858的SNP(包括基因型和等位基因)的OR值均大于1,说明这两个位点的SNP是CHD发生的危险因素;而rs904018的基因型(GA/AA)频率的OR值小于1,说明该位点的基因型(GA/AA)是CHD发生的保护性因素。对于GATA4其他位点和TBX5基因位点rs883079,未发现其在两组中的差异存在统计学意义。FOG2基因由于未有2篇或2篇以上报道,未对其进行Meta分析。
| 表 2 心脏转录因子SNP与CHD的关系 |
|
|
当目标基因位点SNP的纳入文献数≥10时,采用亚组分析的方法探讨目标基因位点与具体CHD分型的关系。由表 2可得,NKX2.5基因的rs2277923位点的基因型(GG/AA、GA/AA)和等位基因(G/A)纳入文献数均≥10篇,整合数据提示,rs2277923基因型GG/AA(OR=1.09,95%CI=0.69~1.74,P=0.71)、GA/AA(OR=0.96 95%CI=0.74~1.25,P=0.77)与等位基因频率G/A(OR=1.15,95%CI=0.81~1.64,P=0.43)在VSD组与对照组中差异均无统计学意义;rs2277923基因型GG/AA(OR=0.50,95%CI=0.20~1.24,P=0.14)、GA/AA(OR=0.46,95%CI=0.21~1.00,P=0.05)与等位基因频率G/A(OR=0.78,95%CI=0.49~1.24,P=0.29)在ASD组与对照组中差异均无统计学意义。其他基因与位点由于纳入文献数量较少或缺少相关数据未进行分析。
2.4 单篇报道的4种心脏转录因子SNP与CHD的关系NKX2.5、GATA4、TBX5、FOG2这4种基因的许多位点只在单篇文献中有报道,本研究统一将其等位基因频率在CHD患者和对照组中的关系整理在表 3中。由表 3可见,NKX2.5基因中的rs703752和rs118026695、GATA4基因中的rs884662、rs12825、rs12458、rs3203358、rs4841588及TBX5基因中的rs6489956等位基因频率在两组中差异有统计学意义。FOG2基因位点的等位基因频率在两组中差异无统计学意义。
| 表 3 单篇报道的心脏转录因子SNP与CHD的关系 |
|
|
对于文献数量≥10篇的文献,采用逐一剔除的方法,观察与原始结果是否一致。对于NKX2.5基因中位点rs2277923的基因型和等位基因频率与CHD发生的关系在每次排除1篇文献后结论不变,即Meta分析结论稳定。漏斗图(图 1)及Egger's检验也均未提示本研究存在发表偏倚。
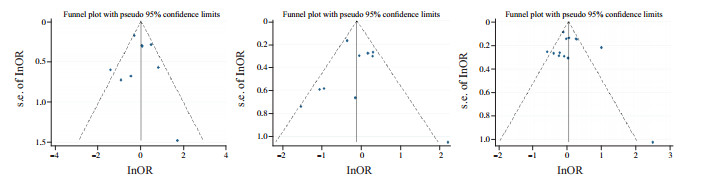
|
图 1 NKX2.5基因rs2277923位点SNP的漏斗图 从左至右的3幅图分别指rs2277923基因多态性GG/AA、GA/AA及G/A与CHD关系的漏斗图,均显示无发表偏倚。 |
CHD全球发病率约为6~8/1 000个活产儿,在高龄产妇和早产儿中发病风险会相应升高[30]。CHD作为先天畸形中发病率及病死率最高的疾病,是医学工作者探索的热点领域,而心脏转录因子基因突变是否会直接导致CHD的发生更是当前研究者希望攻克的命题。
心脏转录因子是在心脏发育过程中调控基因在特定的时间与空间表达的重要的转录活化因子[3, 31]。NKX2.5、GATA4、TBX5为心脏早期发育最重要的3种心脏转录因子[9]。NKX2.5基因是心脏前体细胞分化的最早标志物,贯穿于心脏的整个发育阶段[32]。本Meta分析并未发现NKX2.5的基因位点rs3729753的SNP与CHD及具体CHD分型有关,与Xie等[5]和Wang等[33]的Meta分析结果一致,而基因位点rs2277923与CHD的发生无关的结果却与上述两篇Meta分析结果不一致。在异质性较小、无发表偏倚的条件下,结果的偏差可能是由于本Meta分析的研究对象特定为中国人群,且纳入的文章均为小样本的病例对照研究,这就需要之后的研究者开展更多的相关研究以增加结果的可信性。对于GATA4基因,位点rs1139244、rs867858和rs904018与CHD的发生有关,与Zhang等[34]的Meta分析结果“位点rs867858与CHD的发生有关,99G > T与CHD的发生无关”一致。这些结果提示,即使锌指转录因子GATA4在心脏细胞分化、表达中起重要作用,也并不是所有的位点都与CHD有关,为今后的研究提供了侧重方向。两篇关于TBX5基因位点rs883079的合并结果显示其与CHD的发生无关,这可能与纳入文献过少导致的低检验效能有关。尽管动物试验已经证实TBX5基因突变与Holt-Oram综合征和单纯性CHD有关[35],但人群中特定的TBX5位点的基因突变是否会直接导致CHD仍存在争议。
目前研究普遍认为,心脏转录因子作为心脏发育过程中的重要调控基因,当发生基因突变时会减弱DNA与心脏转录因子的结合能力并改变蛋白质的表达从而使转录因子活性下降,且基因间的转录协同作用被破坏,最终导致心脏发育异常[9, 36-37]。本研究显示:NKX2.5、GATA4、TBX5基因的一些位点的SNP与CHD发生有关,但尚未发现FOG2基因位点的SNP与CHD有关,说明NKX2.5、GATA4、TBX5的基因突变是CHD发生的危险因素,也间接证明这3种基因是心脏发育不可缺少的重要的心脏转录因子,并为目标基因的特定基因位点与中国人群CHD的易感性提供一定依据。
本研究仍存在一些不足:首先,由于Meta分析是基于现有研究数据进行整合,但针对心脏转录因子的基因SNP包括基因型和等位基因测序结果的研究数量有限,只有部分基因的SNP数据可以通过Meta分析进行整合。很多基因的位点只在单篇文章中有报道,本研究只能将这些位点的等位基因频率对CHD的影响归纳整理在表格内,方便以后的研究者查阅使用。其次,除单篇文章外,使用Meta分析方法整合研究的总样本量均偏小,检验效能相应偏小,因此需要更多的研究者就此课题开展更深入的探索。最后,由于纳入文献的对照组选择标准(纳入对象的年龄、性别、CHD种类等)不同且缺少原始数据无法控制混杂因素,同样会影响最终的结果。
综上,本Meta分析显示,中国人群NKX2.5、GATA4、TBX5基因的一些现有位点的SNP与CHD的发生有关;尚未发现FOG2基因现有位点的SNP与CHD的发生有关。CHD的致病机制一直是广大医学工作研究者探索的方向,本研究通过Meta分析探索中国人群NKX2.5、GATA4、TBX5、FOG2基因的所有现有位点的SNP包括基因型和等位基因频率与CHD的关系,可为之后的相关研究提供参考。
| [1] |
Rosamond W, Flegal K, Furie K, et al. Heart disease and stroke statistics-2008 update:a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee[J]. Circulation, 2008, 117(4): e25-e146. DOI:10.1161/CIRCULATIONAHA.107.187998 (  0) 0) |
| [2] |
Knowles R, Griebsch I, Dezateux C, et al. Newborn screening for congenital heart defects:a systematic review and cost-effectiveness analysis[J]. Health Technol Assess, 2005, 9(44): 1-152, ⅲ-ⅳ. (  0) 0) |
| [3] |
蔡花, 付四清. Nkx2.5基因与先天性心脏病[J]. 中国优生与遗传杂志, 2014, 22(4): 1-3. (  0) 0) |
| [4] |
刘敏, 赵洛沙. 先天性心脏病患者相关突变基因的筛选[J]. 中华高血压杂志, 2015, 23(3): 758. (  0) 0) |
| [5] |
Xie X, Shi X, Xun X, et al. Associations of NKX2-5 genetic polymorphisms with the risk of congenital heart disease:a meta analysis[J]. Pediatr Cardiol, 2016, 37(5): 953-961. DOI:10.1007/s00246-016-1377-8 (  0) 0) |
| [6] |
Lo CK, Mertz D, Loeb M. Newcastle-Ottawa Scale:comparing reviewers' to authors' assessments[J]. BMC Med Res Methodol, 2014, 14: 45. DOI:10.1186/1471-2288-14-45 (  0) 0) |
| [7] |
石琳, 申阿东, 李晓峰, 等. 中国先天性心脏病Nkx2.5基因突变筛查及关联研究[J]. 首都医科大学学报, 2005, 26(5): 525-528. (  0) 0) |
| [8] |
周云. 转录因子GATA-4在人胎心发育中的表达及在先天性心脏病胎儿中的突变检测[D]. 福州: 福建医科大学, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10392-2007212345.htm
(  0) 0) |
| [9] |
Zhang W, Li X, Shen A, et al. Screening NKX2.5 mutation in a sample of 230 Han Chinese children with congenital heart diseases[J]. Genet Test Mol Biomarkers, 2009, 13(2): 159-162. DOI:10.1089/gtmb.2008.0044 (  0) 0) |
| [10] |
刘兴元, 杨奕清, 杨颖, 等. 先天性室间隔缺损患者NKX2-5基因新突变的识别[J]. 中华医学杂志, 2009, 89(34): 2395-2399. DOI:10.3760/cma.j.issn.0376-2491.2009.34.006 (  0) 0) |
| [11] |
刘兴元, 杨奕清, 杨颖, 等. 房间隔缺损患儿NKX2.5基因突变的研究[J]. 中华儿科杂志, 2009, 47(9): 696-700. (  0) 0) |
| [12] |
Peng T, Wang L, Zhou SF, et al. Mutations of the GATA4 and NKX2.5 genes in Chinese pediatric patients with non-familial congenital heart disease[J]. Genetica, 2010, 138(11-12): 1231-1240. DOI:10.1007/s10709-010-9522-4 (  0) 0) |
| [13] |
李静. GATA4基因多态性与中国西北人群室间隔缺损的关联研究[D]. 兰州: 兰州大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10730-2010132055.htm
(  0) 0) |
| [14] |
王娟, 胡大一, 李新明, 等. 先天性心脏病患者GATA4基因新突变的识别[J]. 中华医学杂志, 2010, 90(10): 667-671. DOI:10.3760/cma.j.issn.0376-2491.2010.10.007 (  0) 0) |
| [15] |
Ouyang P, Saarel E, Bai Y, et al. A de novo mutation in NKX2.5 associated with atrial septal defects, ventricular noncompaction, syncope and sudden death[J]. Clin Chim Acta, 2011, 412(1-2): 170-175. DOI:10.1016/j.cca.2010.09.035 (  0) 0) |
| [16] |
韩增强, 唐胤, 陈彧, 等. 81例单纯性先天性心脏病患者NKx 2.5基因突变筛查及关联研究[J]. 中国循环杂志, 2011, 26(6): 461-464. (  0) 0) |
| [17] |
Pang S, Shan J, Qiao Y, et al. Genetic and functional analysis of the NKX2-5 gene promoter in patients with ventricular septal defects[J]. Pediatr Cardiol, 2012, 33(8): 1355-1361. DOI:10.1007/s00246-012-0346-0 (  0) 0) |
| [18] |
王风. miRNAs对TBX5的靶向调控及其遗传变异的调控差异在先天性心脏病中的作用[D]. 上海: 复旦大学, 2012.
(  0) 0) |
| [19] |
Xiong F, Li Q, Zhang C, et al. Analyses of GATA4, NKX2.5, and TFAP2B genes in subjects from southern China with sporadic congenital heart disease[J]. Cardiovasc Pathol, 2013, 22(2): 141-145. DOI:10.1016/j.carpath.2012.07.001 (  0) 0) |
| [20] |
Huang X, Niu W, Zhang Z, et al. Identification of novel significant variants of ZFPM2/FOG2 in non-syndromic Tetralogy of Fallot and double outlet right ventricle in a Chinese Han population[J]. Mol Biol Rep, 2014, 41(4): 2671-2677. DOI:10.1007/s11033-014-3126-5 (  0) 0) |
| [21] |
丁琰, 段君凯, 雷华平, 等. 先天性心脏病患者Nkx2.5基因突变研究[J]. 医学信息, 2014, 27(6): 193-194. (  0) 0) |
| [22] |
赵晓波. 单纯性先天性心脏病NKX2-5基因突变筛查及关联研究[D]. 武汉: 华中科技大学, 2014. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D613241
(  0) 0) |
| [23] |
Yang XY, Jing XY, Chen Z, et al. Correlation between GATA4 gene polymorphism and congenital heart disease[J]. Int J Clin Exp Med, 2015, 8(9): 16733-16736. (  0) 0) |
| [24] |
李栋. 先天性心脏病血浆microRNA表达谱及与GATA4靶序列单核苷酸多态性的关联研究[D]. 济南: 山东大学, 2015.
(  0) 0) |
| [25] |
许细财, 李奋, 周万平, 等. 单纯性房间隔缺损患儿GATA4和GATA6基因突变筛查[J]. 临床儿科杂志, 2015, 33(3): 225-229. (  0) 0) |
| [26] |
尤涛, 丁兆红, 刘兴光, 等. GATA4基因多态性与先天性心脏病相关性研究[J]. 兰州大学学报(医学版), 2015, 41(1): 60-62. (  0) 0) |
| [27] |
Cao Y, Wang J, Wei C, et al. Genetic variations of NKX2-5 in sporadic atrial septal defect and ventricular septal defect in Chinese Yunnan population[J]. Gene, 2016, 575(1): 29-33. DOI:10.1016/j.gene.2015.08.033 (  0) 0) |
| [28] |
黄雄. NKX2-5、TBX5和GATA4基因多态性与广西壮、汉族人群先天性心脏病关系及其功能验证[D]. 南宁: 广西医科大学, 2016.
(  0) 0) |
| [29] |
杨景晖, 许小艳, 米弘瑛, 等. NKX2.5基因和TBX5基因在先天性心脏病试管婴儿中的突变检测[J]. 中国当代儿科杂志, 2017, 19(6): 652-657. (  0) 0) |
| [30] |
Sadowski SL. Congenital cardiac disease in the newborn infant:past, present, and future[J]. Crit Care Nurs Clin North Am, 2009, 21(1): 37-48. DOI:10.1016/j.ccell.2008.10.001 (  0) 0) |
| [31] |
宫立国, 邱广蓉, 徐小延, 等. 心脏特异转录因子NKX2-5、TBX5、GATA4与先天性心脏病的研究进展[J]. 国际遗传学杂志, 2006, 29(2): 133-136. (  0) 0) |
| [32] |
李金, 唐燕华. NKX2-5与先天性心脏病发病关系的研究进展[J]. 中国循环杂志, 2014, 29(12): 1061-1063. DOI:10.3969/j.issn.1000-3614.2014.12.026 (  0) 0) |
| [33] |
Wang Z, Zou L, Zhong R, et al. Associations between two genetic variants in NKX2-5 and risk of congenital heart disease in Chinese population:a meta-analysis[J]. PLoS One, 2013, 8(8): e70979. DOI:10.1371/journal.pone.0070979 (  0) 0) |
| [34] |
Zhang Y, Ai F, Zheng J, et al. Associations of GATA4 genetic mutations with the risk of congenital heart disease:a meta-analysis[J]. Medicine (Baltimore), 2017, 96(18): e6857. DOI:10.1097/MD.0000000000006857 (  0) 0) |
| [35] |
胡易池, 杨毅宁. NKX2.5和TBX5与先天性心脏病的研究进展[J]. 医学综述, 2012, 18(13): 1986-1989. DOI:10.3969/j.issn.1006-2084.2012.13.009 (  0) 0) |
| [36] |
齐冰阳. 一个导致家族性房间隔缺损的新的GATA4基因突变[D]. 长春: 吉林大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10183-1017156831.htm
(  0) 0) |
| [37] |
许耘红, 何穗镕, 李丽青. 心肌转录因子和锌指转录因子在先天性心脏病中的相互作用[J]. 中国临床药理学杂志, 2017, 33(18): 1773-1775. (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


