2. 南开大学医学院, 天津 300071;
3. 北京脑重大疾病研究院癫痫研究所, 北京 100069
患儿,男,1岁5个月,因精神运动发育落后伴中性粒细胞减少1年余就诊。患儿3月龄会抬头,4月龄会翻身,5月龄发现四肢肌张力低,追物、逗笑较同龄儿落后,11月龄能扶坐。1岁5个月仍不能独坐及扶站,不会叫“爸爸、妈妈”。患儿2月龄曾发现外周血中性粒细胞减少(具体不详),其后复查波动于0.4~0.6×109/L。
既往无反复感染、惊厥、外伤等。患儿为第一胎第一产,足月剖宫产,出生体重3 250 g,否认出生窒息史,生后母乳喂养,6月龄添加辅食。患儿父母非近亲婚配,其母29岁曾因“甲状腺乳头状癌”行甲状腺切除术,术后予以左旋甲状腺素片口服替代治疗。
体格检查:体重9 kg(-1.3 SD),头围44 cm(-2.5 SD),前囟已闭,发育落后,营养良好,神志清,精神反应可,追光、追物正常,可逗笑,特殊面容:眼距宽,轻度内眦赘皮,睫毛浓密,睑裂稍下斜,耳垂稍大,双侧面部对称,鼻梁低,人中短。右手通贯掌,双侧肩、髋关节过度伸展,四肢肌力正常、肌张力减低,双侧膝腱反射正常,双侧巴氏征阴性。
实验室检查:心电图、脑电图均正常,头颅磁共振未见异常。血生化、自身抗体大致正常,血常规:白细胞3.92×109/L,中性粒细胞0.51×109/L,余项正常。全基因组拷贝数变异检测未发现染色体非整倍体变异及已知的、致病性明确的100 kb以上的微缺失/微重复变异。
2 诊断思维患儿自5月龄发现精神、运动发育落后,伴中性粒细胞减少,至1岁5月龄智力、体格发育明显落后于健康同龄儿;体格检查发现小头畸形、特殊面容、皮纹异常(右手通贯掌),四肢肌张力低,双侧肩、髋关节过度伸展。小儿精神运动发育落后是多种原因引起的发育时期脑功能异常的一种表现,常见病因包括感染、脑损伤、缺氧、代谢、大脑发育异常、遗传等方面原因。患儿围产期无异常,无出生窒息史,生后无感染、抽搐、外伤史,脑电图、头颅磁共振无异常,可除外感染、缺氧缺血性脑损伤、脑发育异常等原因引起的发育迟滞;患儿无喂养困难、低血糖等病史,皮肤、毛发正常,血生化未见明显异常,无代谢性疾病线索;患儿头围小、面容特殊、皮纹异常(右手通贯掌),需要考虑染色体病的可能,但染色体检测未发现非整倍体变异及有明确致病意义的100 kb以上的微缺失/微重复变异,因此无染色体病线索。患儿婴儿期起病,肌张力减低伴关节过伸,需注意遗传性结缔组织病如马凡综合征、Ehlers-Danlos综合征,但患儿家族史无特殊,四肢对称,皮肤正常,心电图未见异常,不符合本类疾病常见的典型表现(如四肢细长、皮肤松弛、组织脆性增加、心血管系统异常等)。此外,患儿多次查血常规均有中性粒细胞减少,可除外药物、放射性物质、感染、肿瘤、自身免疫性疾病等继发因素,应与先天性粒细胞减少症相鉴别。综合患儿存在精神运动发育落后、以及血液系统和关节过伸等多个系统表型,需进一步完善高通量靶向基因测序协助明确病因。
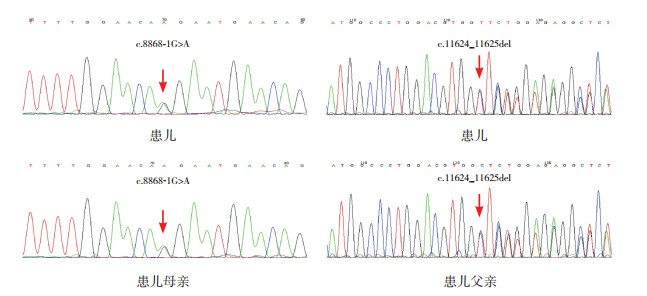
3 进一步检查参照OMIM数据库(http://omim.org/)和HGMD数据库(http://www.hgmd.org),选取38个与中性粒细胞减少相关的基因panel进行高通量测序发现先证者VPS13B基因(OMIM:607817)有两个位点的复合杂合突变:外显子exon49存在c.8868-1G > A,splicing(剪接突变),外显子exon61存在c.11624_11625del,p.V3875Afs*10(移码突变);先证者父母各携带一个位点的杂合突变。见图 1。
|
图 1 患儿及其父母VPS13B基因测序结果 患儿及其母亲携带杂合突变:c.8868-1G > A,splicing(VPS13B基因chr8-100832148, exon49);患儿及其父亲携带杂合突变:c.11624_11625del,p.V3875Afs*10(VPS13B基因chr8-100883728-100883730, exon61)。患儿存在上述两个位点的复合杂合突变,分别来自其父母。突变位点如箭头所示。 |
两个突变的致病性尚未见文献报道,不属于多态性位点,人群中发生频率极低。蛋白预测软件MutationTaster(http://www.mutationtaster.org)评分均为1分,提示可能有害;ACMG致病性分析为可能致病突变。综合上述预测结果,上述两个突变均为致病性突变。
4 诊断及确诊依据根据患儿临床表现及VPS13B基因分析结果,确诊为Cohen综合征,依据:(1)婴儿早期出现精神运动发育落后,围产期无异常;(2)小头畸形;(3)特殊面容;(4)关节过度伸展;(5)中性粒细胞减少;(6)肌张力减低;(7)VPS13B基因存在c.8868-1G > A(splicing)与c.11624_11625del(p.V3875Afs*10)致病性复合杂合突变。
5 临床经过根据患儿临床表现及VPS13B基因分析结果,明确诊断为Cohen综合征,予以康复治疗并随访。
6个月后(2岁2个月)患儿随访时体重增至11 kg(-1.3 SD)、头围45.5 cm(-2.1 SD),能叫“妈妈”,追光、追物正常,逗之能笑,能勉强手膝爬行,能短时间扶站,上肢肌张力正常、下肢肌张力仍低,肩、髋关节过度伸展明显。多次复查中性粒细胞波动于0.4~2.1×109/L。
6 讨论Cohen综合征(OMIM:216550)是一种罕见的常染色体隐性遗传病,于1973年由Cohen等首次报道[1]。其在世界范围均有发现,多见于芬兰人群与阿米什人群,近亲婚育是本病最大的危险因素。
Cohen综合征临床表现复杂,有些症状随年龄增长而进展,诊断困难。目前尚无共识的Cohen综合征诊断标准,广为接受的是Kolehmainen等[2]于2004年提出的标准,以下8项至少具有6项可诊断Cohen综合征:①发育迟缓;②小头畸形;③典型的Cohen综合征面部特征[3](浓密的头发、眉毛、睫毛,波浪形、下斜的睑裂,凸出、喙形的鼻子,人中短、上翘等);④躯干性肥胖伴四肢纤细;⑤过度的社交行为或开朗的性格;⑥关节过度伸展;⑦高度近视和/或视网膜营养不良;⑧中性粒细胞减少。Cohen综合征有些症状与年龄相关,如小头畸形、发育迟缓多于婴儿期出现[3-4];躯干性肥胖常出现于6岁及以上[5];出现眼科异常的平均年龄为4岁余[6]。本例患儿于婴儿早期出现精神、运动发育落后,伴有小头畸形、特殊面容、关节过伸,以及中性粒细胞减少等特征,符合Cohen综合征诊断标准中的5项,但患儿年龄小,应注意动态观察与年龄相关的其他Cohen综合征表现。Cohen综合征其他常见临床表现还包括上睑下垂、晶状体异位、斜视、白内障、视网膜脱落,以及癫痫发作、肌张力减低(多于婴儿期出现)、喉软骨发育不良、身材矮小、扁平足、膝外翻、脊柱侧凸等[3-7]。
Cohen综合征是由VPS13B基因突变所致,VPS13B基因定位于染色体8q22.2,亦称COH1、CHS1基因[8]。致病的VPS13B基因突变可形成提前的转录终止信号,最终导致转录的mRNA不稳定或翻译的蛋白呈截短改变,进而发生临床改变[9]。VPS13B蛋白是一种潜在的跨膜蛋白,与囊泡介导的胞内蛋白质转运和分选相关,在眼、血液系统和中枢神经系统的发育中起着重要作用[8]。近期研究表明,VPS13B蛋白与顺面高尔基体蛋白GM130有着共同定位,对于维持高尔基体的完整性与正常生理功能至关重要,而高尔基体是新合成蛋白质糖基化的重要场所[10]。Duplomb等[11]证实Cohen综合征患者体内的部分蛋白确实存在糖基化异常,且这种糖基化缺陷与VPS13B基因突变密切相关。VPS13B蛋白还是一种潜在的可促进神经突生长的Rab6效应蛋白,当高尔基体VPS13B蛋白功能受损时,即会造成神经突生长受抑,导致脑组织体积缩小[12]。但VPS13B基因突变如何导致Cohen综合征一系列其他症状,尚不明确。本病例VPS13B基因存在新发复合杂合突变:c.8868-1G > A(splicing)与c.11624_11625del(p.V3875Afs*10),生物信息学分析提示为致病性突变,故明确诊断为Cohen综合征。
目前仍缺乏对Cohen综合征的有效治疗手段,主要为对症治疗。部分患者身材矮小可能与伴发生长激素缺乏有关,须加以鉴别并应用生长激素治疗[13];有中性粒细胞减少的反复感染的患者应用粒细胞集落刺激因子效果较好[14-15];康复训练有利于改善患者发育落后、肌张力减低、关节过伸、行动笨拙等症状[16]。
7 结语Cohen综合征是由VPS13B基因突变所致的罕见的常染色体隐性遗传病。Cohen综合征临床表现复杂多样,当精神运动发育落后的患儿出现特征性的面部表现,伴中性粒细胞减少、关节过度伸展等症状时应注意此病,行VPS13B基因检测有助于明确诊断,并密切随访,必要时可应用重组人粒细胞集落刺激因子改善中性粒细胞减少的程度。
| [1] |
Cohen MM Jr, Hall BD, Smith DW, et al. A new syndrome with hypotonia, obesity, mental deficiency, and facial, oral, ocular, and limb anomalies[J]. J Pediatr, 1973, 83: 280-284. DOI:10.1016/S0022-3476(73)80493-7 (  0) 0) |
| [2] |
Kolehmainen J, Wilkinson R, Lehesjoki AE, et al. Delineation of Cohen syndrome following a large-scale genotype-phenotype screen[J]. Am J Hum Genet, 2004, 75(1): 122-127. DOI:10.1086/422197 (  0) 0) |
| [3] |
Chandler KE, Kidd A, Al-Gazali L, et al. Diagnostic criteria, clinical characteristics, and natural history of Cohen syndrome[J]. J Med Genet, 2003, 40(4): 233-241. DOI:10.1136/jmg.40.4.233 (  0) 0) |
| [4] |
Kivitie-Kallio S, Norio R. Cohen syndrome:essential features, natural history, and heterogeneity[J]. Am J Med Genet, 2001, 102(2): 125-135. DOI:10.1002/(ISSN)1096-8628 (  0) 0) |
| [5] |
Katzaki E, Pescucci C, Uliana V, et al. Clinical and molecular characterization of Italian patients affected by Cohen syndrome[J]. J Hum Genet, 2007, 52(12): 1011-1017. DOI:10.1007/s10038-007-0208-4 (  0) 0) |
| [6] |
Taban M, Memoracion-Peralta DS, Wang H, et al. Cohen syndrome:report of nine cases and review of the literature, with emphasis on ophthalmic features[J]. J AAPOS, 2007, 11(5): 431-437. DOI:10.1016/j.jaapos.2007.01.118 (  0) 0) |
| [7] |
Coppola G, Federico RR, Epifanio G, et al. Focal polymicrogyria, continuous spike-and-wave discharges during slow-wave sleep and Cohen syndrome:a case report[J]. Brain Dev, 2003, 25(6): 446-449. DOI:10.1016/S0387-7604(03)00055-X (  0) 0) |
| [8] |
Kolehmainen J, Black GC, Saarinen A, et al. Cohen syndrome is caused by mutations in a novel gene, COH1, encoding a transmembrane protein with a presumed role in vesicle-mediated sorting and intracellular protein transport[J]. Am J Hum Genet, 2003, 72(6): 1359-1369. DOI:10.1086/375454 (  0) 0) |
| [9] |
Seifert W, Holder-Espinasse M, Kühnisch J, et al. Expanded mutational spectrum in Cohen syndrome, tissue expression, and transcript variants of COH1[J]. Hum Mutat, 2009, 30(2): E404-E420. DOI:10.1002/humu.20886 (  0) 0) |
| [10] |
Seifert W, Kühnisch J, Maritzen T, et al. Cohen syndrome-associated protein, COH1, is a novel, giant Golgi matrix protein required for Golgi integrity[J]. J Biol Chem, 2011, 286(43): 37665-37675. DOI:10.1074/jbc.M111.267971 (  0) 0) |
| [11] |
Duplomb L, Duvet S, Picot D, et al. Cohen syndrome is associated with major glycosylation defects[J]. Hum Mol Genet, 2014, 23(9): 2391-2399. DOI:10.1093/hmg/ddt630 (  0) 0) |
| [12] |
Seifert W, Kühnisch J, Maritzen T, et al. Cohen syndrome-associated protein COH1 physically and functionally interacts with the small GTPase RAB6 at the Golgi complex and directs neurite outgrowth[J]. J Biol Chem, 2015, 290(6): 3349-3358. DOI:10.1074/jbc.M114.608174 (  0) 0) |
| [13] |
Massa G, Dooms L, Vanderschueren-Lodeweyckx M. Growth hormone deficiency in a girl with the Cohen syndrome[J]. J Med Genet, 1991, 28(1): 48-50. DOI:10.1136/jmg.28.1.48 (  0) 0) |
| [14] |
Kivitie-Kallio S, Rajantie J, Juvonen E, et al. Granulocytopenia in Cohen syndrome[J]. Br J Haematol, 1997, 98(2): 308-311. DOI:10.1046/j.1365-2141.1997.2323049.x (  0) 0) |
| [15] |
Seow WK, Bartold PM, Thong YH, et al. Cohen syndrome with neutropenia-induced periodontitis managed with granulocyte colony-stimulating factor (G-CSF):case reports[J]. Pediatr Dent, 1998, 20(5): 350-354. (  0) 0) |
| [16] |
尹连海, 程芒芒, 王苑晓, 等. Cohen综合征1例报告并文献复习[J]. 中华实用儿科临床杂志, 2016, 31(19): 1498-1499. DOI:10.3760/cma.j.issn.2095-428X.2016.19.016 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


