2. 首都儿科研究所病理科, 北京 100020
肾母细胞瘤又称Wilms瘤(Wilms tumor, WT),是儿童最常见的恶性实体瘤之一,常表现为无痛性腹部包块、腹痛、血尿、高血压,也有因其他疾病就医而偶然发现的病例。肾母细胞瘤的发病机制错综复杂。近年来,长散布核元件-1(long interspersed nuclear element-1, LINE-1)在肿瘤发生发展中的作用逐步得到证实。
LINE-1是人类基因组中最丰富的能自主转座的非末端重复序列反转录转座子,约占总序列的17%左右,它可通过“复制粘贴”的机制,以RNA为中介体,反转录并插入到新的基因位点。这种反转录转座活动会影响基因组的稳定,从而驱使肿瘤发生[1-2]。众多研究表明体细胞中LINE-1反转录活性增强是许多上皮癌(如肾癌、卵巢癌、肺癌和前列腺癌、黑色素瘤等)的特征性改变[3]。LINE-1编码的ORF1p与ORF2p蛋白是支持其转座的重要组分,而肿瘤细胞中ORF1p的水平是ORF2p的千倍左右,LINE-1的过表达与肿瘤的增殖、转移密切相关[4-6]。
生理性LINE-1表达一般限于生殖细胞、胚胎干细胞和早期胚胎[7]。肾母细胞瘤与早期胚胎肾的基因表达谱存在相似性,因此LINE-1的表达变化可能与肾母细胞瘤的发生发展有着一定联系[8]。由于目前无市售人源性LINE1-ORF1p抗体,本研究通过基因工程的方法原核表达LINE1-ORF1p,经动物免疫获得LINE1-ORF1p多克隆抗体后构建真核表达载体pEGFP-N1-LINE1-ORF1,研究肾母细胞瘤细胞系WT_CLS1中LINE1-ORF1p过表达对细胞增殖的影响,为进一步研究肾母细胞瘤的发生机制提供新思路,以期为临床诊断及治疗提供理论依据。
1 材料与方法 1.1 材料 1.1.1 细胞、菌株和质粒大肠杆菌TOP10及BL21(康为世纪生物公司);原核表达载体pET28a;真核表达载体pEGFP-N1;人胚肾293细胞、黑色素瘤细胞系A375、宫颈癌Hela细胞系和肾母细胞瘤WT_CLS1细胞(本实验室保存)。
1.1.2 主要试剂及耗材T4 DNA连接酶,反转录酶(Promega公司);限制性核酸内切酶EcoRI、SalI及NdeI(Fermentas公司);质粒提取试剂盒、DNA胶回收试剂盒和qPCR试剂(康为世纪生物公司);qPCR引物(上海捷瑞公司);异丙基-β-D-硫代半乳糖苷(isopropyl β-D-thiogalactoside, IPTG)(Genview公司);Luria-Bertani(LB)培养基;超滤离心管(Sartorius公司);BCA蛋白定量试剂盒(北京鼎国昌盛生物公司);β-actin(北京中杉金桥公司),HRP标记的羊抗兔IgG(CST公司);CCK-8试剂盒(日本同仁公司);Taq酶,细胞转染试剂TRANSFECT Ⅲ,ECL超敏发光试剂(北京博海众诚生物科技有限公司)。
1.1.3 实验动物体重约2.5 kg的家兔(北京金牧阳实验动物公司)。
1.2 LINE1-ORF1p抗体制备及鉴定 1.2.1 pET28a-LINE1-ORF1及pEGFP-N1-LINE1-ORF1的构建及鉴定扩增含有LINE1-ORF1基因片段的质粒,用限制性内切酶NdeI和SalI进行酶切,琼脂糖凝胶回收目的片段,并用相同的酶酶切pET28a载体后回收片段。将目的片段与载体片段用T4 DNA连接酶(4℃过夜)连接后转化进TOP10感受态细胞,涂布在含卡那霉素抗性的LB平板上37℃孵育过夜。次日随机挑单克隆菌斑扩增菌液,提取质粒并用SalI和NdeI双酶切及测序鉴定,获得重组质粒。同样的方法构建真核表达载体pEGFP-N1-LINE1-ORF1,其中酶切位点选取EcoRI和SalI。
1.2.2 pET28a-LINE1-ORF1p的诱导表达、纯化将pET28a-LINE1-ORF1重组质粒转化到BL21感受态细胞,涂布在含卡那霉素抗性的LB平板上,37℃孵育过夜。挑取几个单克隆菌斑分别接种到2 mL卡那霉素抗性LB培养基中,37℃震荡培养,待菌液处于对数生长期时,加入不同终浓度(0.5 mmol/L、1 mmol/L、1.5 mmol/L、2 mmol/L)的IPTG,分别24℃培养3 h、6 h、9 h及过夜。收集菌液沉淀,超声碎菌并离心,分别收集沉淀和上清,通过SDS-PAGE胶电泳检测诱导的目的蛋白表达,以确定最佳诱导条件。诱导条件确定后将该菌株扩大培养,超声碎菌后经过亲和层析柱纯化蛋白,再经超滤离心管进一步纯化并浓缩蛋白,BCA法测蛋白浓度并用12% SDS-PAGE胶鉴定纯化效果。
1.2.3 多克隆抗体制备及纯化纯化的LINE1-ORF1p作为免疫原与等体积氟氏完全佐剂充分乳化,皮下多点免疫法免疫家兔,每次剂量为0.5 mg(浓度1 mg/mL),共免疫6次。于末次免疫后的一周,颈动脉取血,分离血清。
用间接ELISA法测抗血清效价:将纯化的pET28a-LINE1-ORF1p用包被液稀释至约100 ng/mL,分别将阳性血清和阴性血清用PBS倍比稀释,稀释梯度为1:500以及1:1 000至1:64 000,二抗为HRP标记的羊抗兔IgG(1:3 000稀释)。酶标仪测定450 nm处各个孔的吸光度(A450),计算阳性血清与阴性血清的吸光度之比(P/N),P/N < 1.5为阴性、1.5~ < 2.1为可疑阳性、≥2.1为阳性,将P/N≥2.1时所对应的血清最高稀释倍数作为抗体的效价。获得的抗血清采用抗原亲和纯化的方法纯化抗体。
1.2.4 Western blot检测LINE1-ORF1p表达将真核表达载体pEGFP-N1-LINE1-ORF1转染入人胚肾293细胞,并以转染空载体及空白细胞做对照,48 h后收集细胞提取蛋白,通过Western blot检测LINE1-ORF1p表达。培养人黑色素瘤细胞系A375和人子宫颈癌Hela细胞系,收集细胞并提取蛋白,通过Western blot检测两种细胞的LINE1-ORF1p表达。一抗工作浓度:β-actin 1:1 000,自制兔抗LINE1-ORF1p 1:10 000;二抗(含有HRP的羊抗兔IgG):1:2 000。用Image J软件分析各条带的灰度值,计算目的条带相对于内参β-actin的灰度比值,对蛋白表达进行定量分析。以上实验独立进行3次。
1.2.5 免疫组化检测黑色素瘤裸鼠模型肿瘤组织的LINE1-ORF1p表达采用免疫组化试剂盒以及自制兔抗LINE1-ORF1p,按照说明书检测本课题组前期保存的人黑色素瘤裸鼠模型(包括非核苷类逆转录酶抑制剂依非韦伦处理模型和DMSO处理的对照模型)肿瘤组织的LINE1-ORF1p表达情况。
1.3 LINE1-ORF1p过表达对WT_CLS1细胞系增殖的影响 1.3.1 细胞转染及LINE1-ORF1蛋白与mRNA表达的检测将真核表达载体pEGFP-N1-LINE1-ORF1及空载体pEGFP-N1转染入WT_CLS1细胞,48 h后收集细胞分别提取蛋白和RNA。通过Western blot检测WT_CLS1细胞中LINE1-ORF1p的表达情况,一抗工作浓度:β-actin 1:1 000,LINE1-ORF1 1:10 000,二抗浓度1:2 000,用Image J软件分析各条带的灰度值,计算目的条带相对于内参β-actin的灰度比值,对蛋白表达进行定量分析,以上实验独立进行3次。
通过qRT-PCR检测转染后的WT_CLS1细胞LINE1-ORF1 mRNA水平是否提高,以β-actin为内参,进行3次独立实验,每次重复3个复孔。由计算机给出的CT值计算平均值,再根据公式:△△CT =[CT(转染组目的基因)-CT(转染组内参)] - [CT(空载体组目的基因)-CT(空载体组内参)],相对表达量=2-△△CT,计算LINE1-ORF1的相对表达量。空载体LINE1-ORF1 mRNA表达量定为1。
1.3.2 细胞增殖检测将真核表达载体pEGFP-N1-LINE1-ORF1及空载体pEGFP-N1转染WT_CLS1细胞,24 h后将细胞按每孔1x104细胞密度铺于96孔板进行细胞培养,利用CCK-8试剂盒观察培养24 h、48 h、72 h后的活细胞数,每组3个平行孔,实验独立重复3次,绘制平均生长曲线。
1.3.3 平板克隆形成试验将真核表达载体pEGFP-N1-LINE1-ORF1及空载体pEGFP-N1转染WT_CLS1细胞,转染24 h后将细胞按1 000个/孔的密度铺于六孔板,置于37℃、5%CO2的孵箱中培养14~17d。肉眼观察到克隆形成时弃培养基,PBS洗3遍,甲醇固定15~20 min,弃去固定液,结晶紫染色10~15 min,清水浸泡洗去多余染色背景,晾干,计数克隆形成数目。实验独立重复3次。
1.4 统计学分析采用Excell软件对数据进行处理。正态分布的计量资料以x±s表示,组间比较进行t检验。P < 0.05为差异有统计学意义。
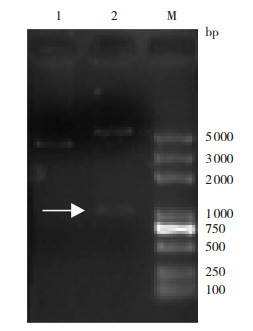
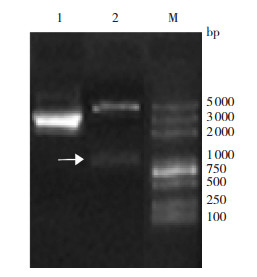
2 结果 2.1 LINE1-ORF1原核、真核重组质粒的构建通过常规基因克隆的方法将LINE1-ORF1基因分别与原核表达载体pET28a、真核表达载体pEGFP-N1连接,经过双酶切鉴定,从核酸电泳图(图 1、2)可见双酶切产物为目的基因片段(1 017 bp)与载体片段(原核表达载体pET28a为5 369 bp,真核表达载体pEGFP-N1为4 700 bp),与理论值相符。经过测序鉴定与原质粒目的基因序列一致,正向插入载体中,表明两个重组质粒构建成功。
|
图 1 重组质粒pET28a-LINE1-ORF1酶切电泳图 1:重组质粒pET28a-LINE1-ORF1;2:NdeI和SalI酶切重组质粒pET28a-LINE1-ORF1;M:DL2000 marker。箭头所指为目的基因LINE1-ORF1片段。 |
|
图 2 重组质粒pEGFP-N1-LINE1-ORF1酶切电泳图 1:重组质粒pEGFP-N1-LINE1-ORF1;2:EcoRI和SalI酶切重组质粒pEGFP-N1-LINE1-ORF1;M:DL2000 marker。箭头所指为目的基因LINE1-ORF1片段。 |
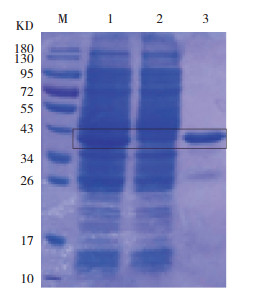
诱导条件经过优化后,最终确定诱导pET28a-LINE1-ORF1p表达的条件。即扩大培养的阳性菌株,在对数生长期加入IPTG至终浓度1.5 mmol/L,24℃过夜(12~16 h)震荡培养,收集蛋白并纯化。12% SDS-PAGE胶电泳显示(图 3),在40 kD处有清晰单一的目的条带,纯化效果较好。将纯化的蛋白经超滤离心管进一步离心获得更纯的蛋白并浓缩。
|
图 3 pET28a-LINE1-ORF1p经ITPG诱导并纯化后的SDS-PAGE电泳图 M:蛋白marker;1:纯化前;2:流穿液;3:纯化后。[ITPG]异丙基-β-D-硫代半乳糖苷。 |
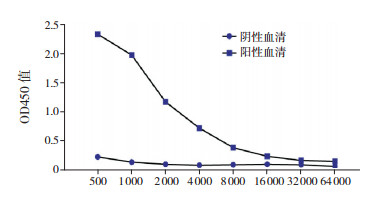
用纯化的重组蛋白pET28a-LINE1-ORF1p免疫家兔,制备抗血清,间接ELISA法检测抗体效价(图 4),显示效价 > 1:16 000,表明制备的抗体有较高的效价。按照抗原亲和纯化的步骤将抗体从血清中纯化并浓缩,最后加入等体积50%甘油,-20℃保存。
|
图 4 间接ELISA法检测LINE1-ORF1p抗体效价 |
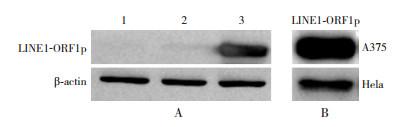
人胚肾293细胞瞬时转染LINE1-ORF1后,利用自制LINE1-ORF1p抗体经Western blot检测,在40 kD处可见清晰单一的条带,空载体转染(对照)细胞未见目的条带。利用自制LINE1-ORF1p抗体,经Western blot检测黑色素瘤细胞A375和宫颈癌Hela细胞的LINE1-ORF1p表达,在40 kD处可见清晰单一的条带。见图 5。
|
图 5 Western blot检测LINE1-ORF1p抗体特异性 A:人胚肾293细胞的LINE1-ORF1p表达。1:未转染细胞;2:转染pEGFP-N1的细胞;3:转染pEGFP-N1-LINE1-ORF1的细胞。B:黑色素瘤细胞A375和宫颈癌Hela细胞的LINE1-ORF1p表达。 |
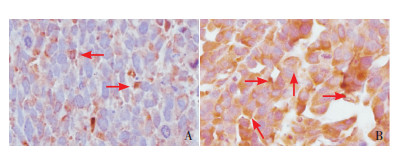
免疫组化检测黑色素瘤裸鼠模型肿瘤组织LINE1-ORF1p表达,显示LINE1-ORF1p定位在胞浆,依非韦伦处理的标本LINE1-ORF1p阳性表达弱于DMSO处理标本(图 6A、B)。
|
图 6 免疫组化检测黑色素瘤裸鼠模型肿瘤组织LINE1-ORF1p表达(×400) A:依非韦伦处理的肿瘤组织;B:DMSO处理的肿瘤组织。箭头所指为LINE1-ORF1p阳性表达。 |
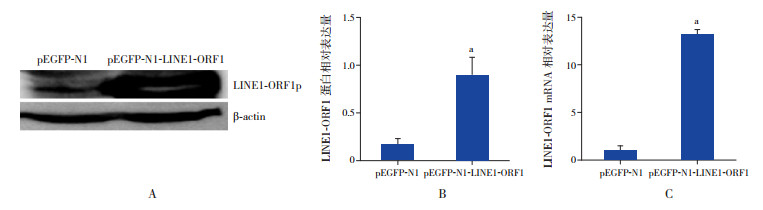
经Western blot及qRT-PCR检测发现,与空载体转染细胞相比,转染LINE1-ORF1的细胞LINE1-ORF1蛋白和mRNA表达均较高。见图 7。
|
图 7 转染LINE1-ORF1对WT_CLS1细胞LINE1-ORF1p表达的影响(n=3) A:Western blot检测LINE1-ORF1p表达;B:LINE1-ORF1蛋白表达的相对定量,a示与转染pEGFP-N1细胞比较,P < 0.05;C:qRT-PCR检测LINE1-ORF1 mRNA相对表达水平,a示与转染pEGFP-N1的细胞比较,P < 0.05。 |
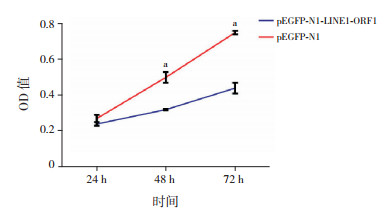
使用CCK-8试剂盒检测WT_CLS1细胞增殖情况,结果显示随着转染后的时间延长,转染LINE1-ORF1重组质粒48 h和72 h后细胞的增殖能力明显强于相应时间点的转染空载体细胞(P < 0.05),见图 8。
|
图 8 LINE1-ORF1p过表达对WT_CLS1细胞增殖的影响(n=3) a示与同一时间点的转染pEGFP-N1的细胞比较,P < 0.05。 |
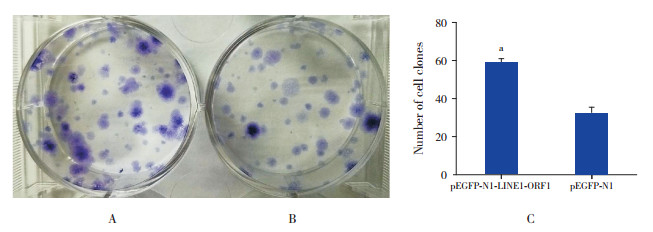
与转染空载体细胞比较,WT_CLS1细胞转染重组质粒pEGFP-N1-LINE1-ORF1后细胞克隆增多,见图 9。
|
图 9 LINE1-ORF1p过表达对WT_CLS1细胞克隆形成能力的影响(n=3) A:转染pEGFP-N1-LINE1-ORF1质粒的细胞;B:转染pEGFP-N1的细胞;C:克隆形成计数比较,a示与转染pEGFP-N1的细胞比较,P < 0.05。 |
LINE-1同其他一些重复序列在过去被称为“垃圾基因”,如今,随着研究的深入,发现其具有重要的调控作用。无论是在正常发育还是疾病发生中,LINE-1都成为有趣的主体。鉴于其对全基因组的甲基化改变,遗传信息的表达和反转录的贡献,LINE-1在肿瘤发生、发展中的作用也逐渐进入研究者的视野。在正常体细胞中,LINE-1的启动子处于高甲基化状态从而抑制LINE-1转座活动,而在大多数恶性肿瘤中LINE-1出现低甲基化以及蛋白、mRNA高表达的现象[9]。LINE-1编码的两个蛋白ORF1p和ORF2p是支持LINE-1转座的重要组分,但ORF1p的表达量是ORF2p的千倍左右[4],提示ORF1p可能起着除了支持转座以外的重要作用。本课题组前期研究发现LINE-1基因启动子区低甲基化与肾母细胞瘤的发生有密切的关系[10],LINE-1低甲基化对蛋白表达有一定的影响。本研究通过基因工程原核表达纯化的方法获取LINE1-ORF1p,免疫家兔后纯化抗血清得到多克隆抗体,并证明其具有较高的效价及特异性,为进一步研究LINE-1与肾母细胞瘤之间的功能关系奠定了基础。本研究LINE1-ORF1p最佳诱导表达条件是1.5 mmol/L的IPTG 24℃诱导12~16 h。另有报道[11-13]认为,由于LINE1-ORF1p是一个三聚体结构,ORF1p N端标签可能影响此蛋白折叠,从而影响其活性、对抗体的产生有影响。而本研究并未切割掉ORF1p N端标签同样获得了敏感性和特异性较好的抗体,可能是因为选择的原核表达载体pET28a中的HIS标签是由6个组氨酸构成的区段,这个标签在pH8.0时不带电,且无免疫原性,对蛋白的分泌、折叠等功能基本不影响。
为研究LINE1-ORF1p与肾母细胞瘤的发生发展的关系,本研究将构建的真核表达载体pEGFP-N1-LINE1-ORF1转染肾母细胞瘤细胞系WT_CLS1,转染后的WT_CLS1细胞增殖和克隆形成能力增强,提示LINE1-ORF1p可能参与肾母细胞瘤的发生发展。肾母细胞瘤发病机制复杂,许多基因及信号通路参与肿瘤的发生,而LINE1-ORF1p是一种RNA结合蛋白,不仅能结合自身mRNA,也能结合其他的RNA或编码蛋白[14],因此LINE1-ORF1p可能通过竞争调节某些转录因子,或与某些信号通路分子存在蛋白-蛋白相互作用,从而影响WT_CLS1细胞增殖,但这些仍需后续深入研究。
综上,本研究成功制备了针对人源性LINE-ORF1p的多克隆抗体,为临床LINE-ORF1p的免疫组化或血清学检测提供了可能;并进一步证实了LINE-ORF1p可以促进肾母细胞瘤细胞增殖,有望为肾母细胞瘤的诊断提供新的初筛方法,并为靶向治疗研究提供理论依据。
| [1] |
Beck CR, Garcia-Perez JL, Badge RM, et al. LINE-1 elements in structural variation and disease[J]. Annu Rev Genomics Hum Genet, 2011, 12: 187-215. (  0) 0) |
| [2] |
Kemp JR, Longworth MS. Crossing the LINE toward genomic instability:LINE-1 retrotransposition in cancer[J]. Front Chem, 2015, 3: 68. (  0) 0) |
| [3] |
Belancio VP, Roy-Engel AM, Pochampally RR, et al. Somatic expression of LINE-1 elements in human tissues[J]. Nucleic Acids Res, 2010, 38(12): 3909-3922. (  0) 0) |
| [4] |
Sharma R, Rodić N, Burns KH, et al. Immunodetection of human LINE-1 expression in cultured cells and human tissues[J]. Methods Mol Biol, 2016, 1400: 261-280. DOI:10.1007/978-1-4939-3372-3 (  0) 0) |
| [5] |
Sinibaldi-Vallebona P, Lavia P, Garaci E, et al. A role for endogenous reverse transcriptase in tumorigenesis and as a target in differentiating cancer therapy[J]. Genes Chromosomes Cancer, 2006, 45(1): 1-10. (  0) 0) |
| [6] |
Martin SL. The ORF1 protein encoded by LINE-1:structure and function during L1 retrotransposition[J]. J Biomed Biotechnol, 2006, 2006(1): 45621. (  0) 0) |
| [7] |
Xiao-Jie L, Hui-Ying X, Qi X, et al. LINE-1 in cancer:multifaceted functions and potential clinical implications[J]. Genet Med, 2016, 18(5): 431-439. (  0) 0) |
| [8] |
Maschietto M, de Camargo B, Brentani H, et al. Molecular profiling of isolated histological components of wilms tumor implicates a common role for the Wnt signaling pathway in kidney and tumor development[J]. Oncology, 2008, 75(1-2): 81-91. DOI:10.1159/000155210 (  0) 0) |
| [9] |
刘茜, 王瑾晖, 李晓宇, 等. 逆转录转座子LINE-1与肿瘤的发生和发展[J]. 遗传, 2016, 38(2): 93-102. (  0) 0) |
| [10] |
Chang HB, Zou JZ, He C, et al. Association between LINE-1 methylation and relative telomere length in Wilms tumor[J]. Chin Med J, 2015, 128(22): 3055-3061. (  0) 0) |
| [11] |
Khazina E, Truffault V, Büttner R, et al. Trimeric structure and flexibility of the L1ORF1 protein in human L1 retrotransposition[J]. Nat Struct Mol Biol, 2011, 18(9): 1006-1014. DOI:10.1038/nsmb.2097 (  0) 0) |
| [12] |
Callahan KE, Hickman AB, Jones CE, et al. Polymerization and nucleic acid-binding properties of human L1 ORF1 protein[J]. Nucleic Acids Res, 2012, 40(2): 813-827. DOI:10.1093/nar/gkr728 (  0) 0) |
| [13] |
Dai LX, LaCava J, Taylor MS, et al. Expression and detection of LINE-1 ORF-encoded proteins[J]. Mob Genet Elements, 2014, 4: e29319. DOI:10.4161/mge.29319 (  0) 0) |
| [14] |
Sciamanna I, De Luca C, Spadafora C. The reverse transcriptase encoded by LINE-1 retrotransposons in the genesis, progression, and therapy of cancer[J]. Front Chem, 2016, 4: 6. (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


