2. 邢台市人民医院儿童保健科, 河北 邢台 054000;
3. 湖南省人民医院临床研究所, 湖南 长沙 410005;
4. 湖南省人民医院超声科, 湖南 长沙 410005;
5. 湖南师范大学医学院2014级卓越医师班, 湖南 长沙 410005
近年来,心血管疾病患病率有逐年增加的趋势,已成为全球导致居民死亡的主要原因[1-2]。心脏肥厚和纤维化是心血管疾病的病变基础和共同的病理生理过程,也是心脏重塑不同阶段的重要表现[3-4]。心脏重塑机制在研究心血管疾病防治中具有重要的现实意义[5]。
随着科学技术的快速发展,转基因研究成为了心脏重塑研究的热点,传统心脏重塑模型主要为BALB/c和C57BL/6J等品系小鼠,通过皮下注射异丙肾上腺素(isoprenaline, ISO)已经成为成熟的造模途径,但其受精卵不适用于转基因研究;FVB/N品系小鼠受精卵前核大,便于显微注射DNA,而且注射后存活良好、繁殖快,被广泛应用于转基因的相关领域研究[6]。目前关于FVB/N品系小鼠心脏重塑模型的研究甚少;杨承志等[7]研究发现皮下埋微量泵注射ISO能诱导出FVB/N小鼠心脏肥大,但未能诱导出心脏纤维化;心脏重塑主要包括心脏肥大和心脏纤维化等病变,因此杨承志等[7]研究中诱导出的小鼠心脏肥大不能代表心脏重塑,且皮下埋微量泵价格昂贵,因此有必要对模型进行改进。本课题组前期研究[8]发现腹腔注射途径模型操作相对比较简单,药物吸收快,不需要复杂的仪器,经济便捷,基于这些优点,本研究采用腹腔注射途径探索ISO诱导FVB/N小鼠心脏重塑的条件,为进一步研究提供实验依据。
1 材料与方法 1.1 实验动物及药品12周龄FVB/N雄性小鼠购自赛业(广州)生物科技有限公司,饲养环境温度为25±2℃,12 h明/暗交替,所有动物实验遵守生物医学研究伦理要求。ISO(#15627)购自美国Sigma公司。
1.2 ISO诱导小鼠心脏重塑将48只FVB/N小鼠编号后利用随机化数字表进行完全随机分组,根据ISO不同的给药途径分为背部皮下盐水组(皮下盐水组)、腹腔盐水组、背部皮下ISO组(皮下ISO组)、腹腔ISO组(n=12)。皮下ISO组和腹腔ISO组小鼠每日均给予ISO(3 mg/mL)10 μL/g体重,分2次注射,间隔12 h,共14 d;两对照组按照不同给药途径注射等量生理盐水。
1.3 心脏超声的检测各组小鼠在注射开始前1 d和结束前1 d分别进行心脏超声检测。将小鼠用10%水合氯醛麻醉,仰卧于木板上固定,采用ALOKA Qrosound a10 Premier超声仪,以14 MHz高频心脏探头探测胸骨旁左心室长轴切面和左心室短轴切面。分析连续测量3个心动周期的参数,计算均值,记录舒张末期左心室后壁厚度(diastolic left ventricular posterior wall thickness, dLVPW)。
1.4 心脏肥厚的检测给予ISO 14 d后,将各组小鼠颈椎脱臼处死后立即剪开胸腔,取出心脏,冷PBS缓冲液冲洗去血液,滤纸吸干游离水分,称重,观察心脏的大体形态。取小鼠胫骨,测量长度。计算心脏重量与胫骨长度比值(心胫比)。留取左心室肌置于4%甲醛溶液中,随后进行苏木精-伊红(HE)染色;采图软件测量小鼠心肌纤维直径,每个心脏组织随机选取3张切片,每张切片随机取5个视野,取平均值。通过小鼠心脏大体形态、心胫比及心肌纤维直径衡量心脏肥大程度。
1.5 心脏胶原分布检测经乳头肌水平横切心脏,将心肌组织置于4%多聚甲醛溶液中,常规脱水包埋,切片厚6 μm;常规脱蜡,天狼星红染色液滴染1 h,流水稍微冲洗,去除切片表面染液;Mayer苏木素染色液染细胞核8~10 min,流水冲洗10 min;常规脱水透明,中性树胶封固,检测胶原分布。应用软件Image Pro Plus 6.0(Media Cybernetics Inc,美国)测量和计算胶原面积占心脏面积的百分比,用于判断纤维化程度。
1.6 心肌Ⅰ型胶原蛋白mRNA检测取100 mg左室心尖部分组织,TRIzol提取总RNA。采用First Strand cDNA Synthesis Kit试剂盒(TOYOBO公司)合成cDNA。引物由美国Invitrogen公司设计并合成;Ⅰ型胶原蛋白(CollagenⅠ)序列:上游引物5'-CTGACTGGAAGAGCGGAGAG-3',下游引物5'-CGGCTGAGTAGGGAACACAC-3',片段长度116 bp;β-actin序列:上游引物5'-TGAAGGGTGGAGCCAAAAG-3',下游引物5'-AGTCTTCTGGGTGGCAGTGAT-3',片段长度227 bp。每个样品均作3个复孔,使用SYBR® Premix Ex TaqTM试剂盒(TaKaRa公司)配制反应体系(10 μL)为:2×qPCR Mix 5.0 μL,上下游引物(2.5 μmol/L)各0.5 μL,模板1.0 μL,ddH2O 2.8 μL,Rox 0.2 μL。StepOneTM Real-Time PCR仪(美国Life Technologies公司)上完成实时荧光定量PCR,反应条件为:95℃预变性1 min;95℃变性15 s,58℃退火20 s,72℃延伸20 s,循环40次;72℃终延伸5 min。记录每次测定的Ct值,目的基因的相对表达量=2-△△Ct。
1.7 统计学分析采用SPSS 17.0统计软件对数据进行统计学分析。计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;计数资料以率表示,组间比较采用卡方检验。P < 0.05为差异有统计学意义。
2 结果 2.1 皮下及腹腔注射ISO对小鼠存活率的影响ISO注射14 d后,腹腔ISO组小鼠存活7只,死亡5只;而皮下ISO组小鼠存活9只,死亡3只。两组之间死亡率比较差异无统计学意义(χ2=0.75,P=0.386)。
2.2 皮下及腹腔注射ISO对FVB/N小鼠心脏大小的影响心脏大体形态和HE染色结果显示:与皮下ISO组、皮下盐水组和腹腔盐水组比较,腹腔ISO组小鼠心脏外形和心腔增大;与皮下盐水组和腹腔盐水组比较,皮下ISO组小鼠心脏外形和心腔无明显变化(图 1)。HE染色和心脏超声结果显示:腹腔ISO组小鼠心胫比、心肌纤维直径和dLVPW明显高于皮下ISO组、皮下盐水组和腹腔盐水组(P < 0.01,表 1,图 1);皮下ISO组心胫比、心肌纤维直径和dLVPW与皮下盐水组和腹腔盐水组比较,差异均无统计学意义(P > 0.05,表 1,图 1)。提示腹腔注射ISO可诱导FVB/N小鼠心脏肥大,而背部皮下注射ISO则不能引起FVB/N小鼠心脏肥大。
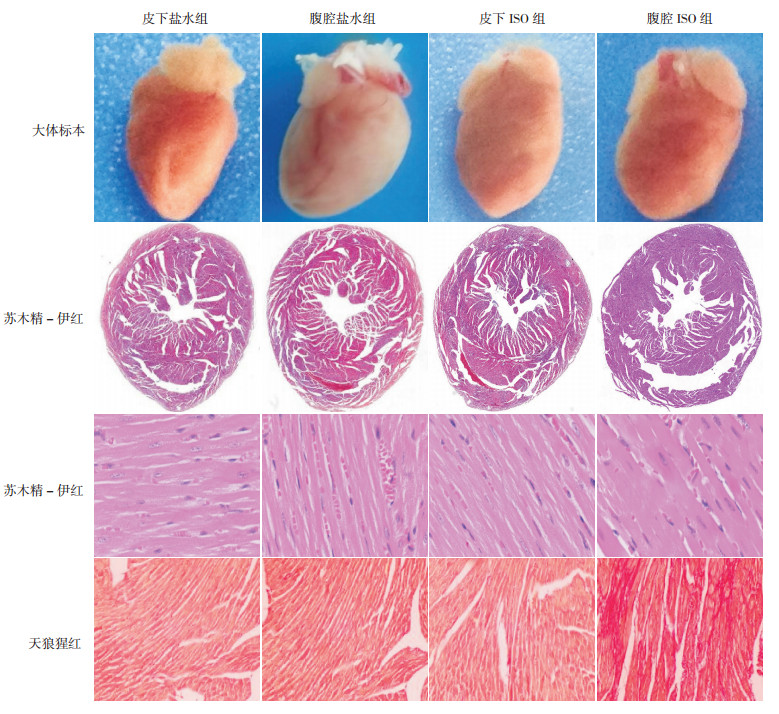
|
图 1 各组小鼠心脏病理改变 腹腔ISO组小鼠心脏外观及心腔(苏木精-伊红,×40)较其他3组增大,心肌纤维明显增粗(苏木精-伊红,×400);其余3组未见明显心脏肥厚表现;腹腔ISO组心肌间质胶原沉积显著(天狼猩红,×100),其余3组未见明显胶原沉积,胶原沉积阳性表达呈猩红色。 |
| 表 1 各组小鼠心脏大小指标比较(x±s) |
|
|
与腹腔盐水组、皮下ISO组和皮下盐水组比较,腹腔ISO组心脏胶原面积百分比、CollagenⅠmRNA明显增高(P < 0.01);与腹腔盐水组和皮下盐水组比较,皮下ISO组心脏胶原面积百分比、CollagenⅠmRNA无明显增高(P > 0.05)。提示腹腔注射ISO能诱导FVB/N小鼠心脏纤维化,而皮下注射ISO则不能诱导FVB/N小鼠心脏纤维化。见图 1,表 2。
| 表 2 各组小鼠心脏纤维化指标比较(x±s) |
|
|
机体交感神经过度激活、儿茶酚胺释放增加是导致心脏重塑的重要原因[9-10],但是具体机制尚不清楚。ISO是一种外源性的儿茶酚胺,可导致心室肥厚,持续刺激可导致心肌间质胶原沉积、心肌纤维化[11-12],因而被用于模拟内源性儿茶酚胺研究心脏重塑相关机制[9, 13]。心脏肥厚是内源性儿茶酚胺导致心脏改变的始动环节,也是心力衰竭、心律失常和心脏性猝死的最强预测因素[14-15];心脏纤维化是一个慢性过程,也会导致心力衰竭、心律失常和心脏性猝死[16-17]。心脏受体内儿茶酚胺长期过度激活是心脏重塑的重要病理生理基础[9, 18],探索导致心脏重塑的机制对于心血管疾病的防治具有重要意义。
BALB/C、C57BL/6J小鼠是常用的心脏重塑的品系,且诱导技术成熟[19-22],但其皮下注射方法并不能成功诱导FVB/N小鼠建立该模型。本研究通过腹腔注射途径进行探索,发现腹腔ISO组小鼠心胫比、dLVPW、心脏胶原面积百分比和心肌CollagenⅠmRNA显著高于腹腔盐水组和皮下ISO组;心脏大体形态和心肌HE染色显示腹腔ISO组小鼠心脏明显增大,心肌纤维明显增粗;而皮下ISO组未能诱导出小鼠心脏肥大和心肌纤维化。对腹腔ISO组和皮下ISO组死亡率进行比较,两组死亡率比较差异无统计学意义。本研究提示每日腹腔注射ISO 30 μg/g体重,每日2次,间隔12 h,注射14 d后可以诱导出小鼠心脏肥大和心肌纤维化,且死亡率不高。目前FVB/N小鼠心脏重塑模型的研究鲜见报道,国内研究发现同等剂量ISO皮下微量泵注射两周可以诱导出小鼠心脏明显肥大[7],与本实验结论一致,但该研究未能诱导出心肌纤维化模型。本研究通过腹腔注射ISO诱导出心脏重塑模型,考虑成功可能原因如下:皮下注射和腹腔注射是两种不同的给药方式,皮下注射主要通过微血管吸收,而腹腔注射主要通过腹膜吸收,由于腹膜的面积广大且密布血管和淋巴管,研究发现腹膜每小时可吸收动物体重3%~8%的液体,吸收面积大,药物能快速吸收入血[23-25],因此ISO经腹腔注射后经腹膜吸收能快速进入血液循环,从而有效的激动心肌,起到模拟内源性儿茶酚胺诱导心脏重塑的作用。而皮下注射因为外周毛细血管受局部组织的影响,药物吸收面积小,会形成外周局部组织细胞的药物浓度高于血液循环的结果,这种浓度差会促使药物顺浓度梯度移入外周血中,再通过血循环进入内脏,相对腹腔给药,药物到达内脏的速度较慢、浓度较低,故皮下给药不及腹腔给药的效果,这可能与皮下给药方式不能在短时间达到足够的血药浓度有关[26]。ISO皮下注射时间长,药物持续刺激皮下组织,局部组织可能会出现坏死、增生和纤维化,也不利于药物的吸收。研究发现皮下注射可出现皮下硬结,出现不同程度的发硬和黑色结痂,随着造模天数的增加,其硬度逐渐加重,影响药物吸收,达不到有效的造模剂量,导致造模失败[27-28]。虽然腹腔注射吸收快,但可能因为血药浓度很快达到高峰,药物单次剂量过大导致死亡率增加[29]。本研究改用分次腹腔注射不仅避免了单次剂量过大导致的小鼠死亡率增高的副作用,而且又有利于保持较好的ISO血药浓度,是造模成功的另一重要原因。
综上所述,本研究确定了腹腔注射途径每日给予ISO 30 μg/g体重,每天分2次注射,间隔12 h,注射两周的方法可成功建立FVB/N小鼠心脏肥大和纤维化模型,此方法简单易行、安全廉价,且小鼠死亡率不高,为进一步的研究提供了参考,值得推广。
| [1] |
Mozaffarian D, Benjamin EJ, Go AS, et al. Heart disease and stroke statistics-2015 update:a report from the American Heart Association[J]. Circulation, 2015, 131(4): e29-e322. DOI:10.1161/CIR.0000000000000152 (  0) 0) |
| [2] |
王文, 朱曼璐, 王拥军, 等. 《中国心血管病报告2012》概要[J]. 中国循环杂志, 2013, 28(6): 408-412. (  0) 0) |
| [3] |
Kong P, Christia P, Frangogiannis NG. The pathogenesis of cardiac fibrosis[J]. Cell Mol Life Sci, 2014, 71(4): 549-574. DOI:10.1007/s00018-013-1349-6 (  0) 0) |
| [4] |
Li C, Huang D, Tang J, et al. ClC-3 chloride channel is involved in isoprenaline-induced cardiac hypertrophy[J]. Gene, 2018, 642: 335-342. DOI:10.1016/j.gene.2017.11.045 (  0) 0) |
| [5] |
Krum H, Roecker EB, Mohacsi P, et al. Effects of initiating carvedilol in patients with severe chronic heart failure:results from the COPERNICUS Study[J]. JAMA, 2003, 289(6): 712-718. DOI:10.1001/jama.289.6.712 (  0) 0) |
| [6] |
Taketo M, Schroeder AC, Mobraaten LE, et al. FVB/N:an inbred mouse strain preferable for transgenic analyses[J]. Proc Natl Acad Sci U S A, 1991, 88(6): 2065-2069. DOI:10.1073/pnas.88.6.2065 (  0) 0) |
| [7] |
杨承志, 田爱炬, 孟增慧, 等. 异丙肾上腺素诱导FVB/N小鼠心脏肥大模型的建立[J]. 北京大学学报(医学版), 2014, 46(6): 906-910. (  0) 0) |
| [8] |
袁勇华, 何学华, 方亦兵, 等. 黄芪对扩张型心肌病大鼠心肌缝隙连接蛋白43表达的影响[J]. 临床儿科杂志, 2014, 32(11): 1080-1083. DOI:10.3969/j.issn.1000-3606.2014.11.25 (  0) 0) |
| [9] |
Chaulet H, Lin F, Guo J, et al. Sustained augmentation of cardiac alpha1A-adrenergic drive results in pathological remodeling with contractile dysfunction, progressive fibrosis and reactivation of matricellular protein genes[J]. J Mol Cell Cardiol, 2006, 40(4): 540-552. DOI:10.1016/j.yjmcc.2006.01.015 (  0) 0) |
| [10] |
Fu Y, Xiao H, Zhang Y. Beta-adrenoceptor signaling pathways mediate cardiac pathological remodeling[J]. Front Biosci (Elite Ed), 2012, 4: 1625-1637. (  0) 0) |
| [11] |
Aflaki M, Qi XY, Xiao L, et al. Exchange protein directly activated by cAMP mediates slow delayed-rectifier current remodeling by sustained β-adrenergic activation in guinea pig hearts[J]. Circ Res, 2014, 114(6): 993-1003. DOI:10.1161/CIRCRESAHA.113.302982 (  0) 0) |
| [12] |
Chowdhury D, Tangutur AD, Khatua TN, et al. A proteomic view of isoproterenol induced cardiac hypertrophy:prohibitin identified as a potential biomarker in rats[J]. J Transl Med, 2013, 11: 130. DOI:10.1186/1479-5876-11-130 (  0) 0) |
| [13] |
Lv T, Du Y, Cao N, et al. Proliferation in cardiac fibroblasts induced by β1-adrenoceptor autoantibody and the underlying mechanisms[J]. Sci Rep, 2016, 6: 32430. DOI:10.1038/srep32430 (  0) 0) |
| [14] |
van Berlo JH, Maillet M, Molkentin JD. Signaling effectors underlying pathologic growth and remodeling of the heart[J]. J Clin Invest, 2013, 123(1): 37-45. DOI:10.1172/JCI62839 (  0) 0) |
| [15] |
Cramariuc D, Gerdts E. Epidemiology of left ventricular hypertrophy in hypertension:implications for the clinic[J]. Expert Rev Cardiovasc Ther, 2016, 14(8): 915-926. DOI:10.1080/14779072.2016.1186542 (  0) 0) |
| [16] |
Turillazzi E, Neri M, Riezzo I, et al. Cardiac fibrosis, arrhythmia and sudden death in myotonic dystrophy type 1:could TGF-ß1 improve the predictive accuracy of patients at risk, opening new therapeutic challenges?[J]. Int J Cardiol, 2013, 168(5): 4976-4978. DOI:10.1016/j.ijcard.2013.07.135 (  0) 0) |
| [17] |
Grimaldi V, De Pascale MR, Zullo A, et al. Evidence of epigenetic tags in cardiac fibrosis[J]. J Cardiol, 2017, 69(2): 401-408. DOI:10.1016/j.jjcc.2016.10.004 (  0) 0) |
| [18] |
Okin PM, Hille DA, Kjeldsen SE, et al. Persistence of left ventricular hypertrophy is associated with increased cardiovascular morbidity and mortality in hypertensive patients with lower achieved systolic pressure during antihypertensive treatment[J]. Blood Press, 2014, 23(2): 71-80. DOI:10.3109/08037051.2013.791414 (  0) 0) |
| [19] |
Wang LS, Lee CT, Su WL, et al. Delonix regia leaf extract (DRLE):a potential therapeutic agent for cardioprotection[J]. PLoS One, 2016, 11(12): e0167768. DOI:10.1371/journal.pone.0167768 (  0) 0) |
| [20] |
Iaccarino G, Tomhave ED, Lefkowitz RJ, et al. Reciprocal in vivo regulation of myocardial G protein-coupled receptor kinase expression by beta-adrenergic receptor stimulation and blockade[J]. Circulation, 1998, 98(17): 1783-1789. DOI:10.1161/01.CIR.98.17.1783 (  0) 0) |
| [21] |
Duan Q, Ni L, Wang P, et al. Deregulation of XBP1 expression contributes to myocardial vascular endothelial growth factor-A expression and angiogenesis during cardiac hypertrophy in vivo[J]. Aging Cell, 2016, 15(4): 625-633. DOI:10.1111/acel.2016.15.issue-4 (  0) 0) |
| [22] |
Song S, Si LY. Klotho ameliorated isoproterenol-induced pathological changes in cardiomyocytes via the regulation of oxidative stress[J]. Life Sci, 2015, 135: 118-123. DOI:10.1016/j.lfs.2015.05.024 (  0) 0) |
| [23] |
Huang ZP, Chen J, Seok HY, et al. MicroRNA-22 regulates cardiac hypertrophy and remodeling in response to stress[J]. Circ Res, 2013, 112(9): 1234-1243. DOI:10.1161/CIRCRESAHA.112.300682 (  0) 0) |
| [24] |
姜国良, 于晓, 徐恺, 等. 腹腔和皮下注射D-半乳糖衰老大鼠模型分析[J]. 中国老年学杂志, 2013, 33(5): 1101-1103. (  0) 0) |
| [25] |
龚频, 陈福欣, 金赛, 等. 不同给药方式下蓝莓花青素的镇痛作用研究[J]. 食品研究与开发, 2013, 34(24): 186-188. DOI:10.3969/j.issn.1005-6521.2013.24.050 (  0) 0) |
| [26] |
徐南平, 汪倩, 邹音, 等. 表皮生长因子对多器官功能障碍小鼠的作用[J]. 中华急诊医学杂志, 2012, 21(5): 497-502. (  0) 0) |
| [27] |
邹磊, 李一鸣, 杨建云, 等. 甾体类固醇衍生物AGE对60Coγ射线辐射C57小鼠治疗作用[J]. 科学技术与工程, 2015, 15(17): 29-33. DOI:10.3969/j.issn.1671-1815.2015.17.006 (  0) 0) |
| [28] |
秦文艳, 陈贺, 朱竟赫, 等. 不同氢化可的松小鼠肾阳虚模型制备方法对比研究[J]. 实验动物科学, 2017, 34(4): 11-14. (  0) 0) |
| [29] |
安祯祥, 何远利, 王敏. 四氯化碳不同给药途径复合乙醇诱导大鼠肝纤维化模型的研究[J]. 贵州医药, 2016, 40(1): 6-8. (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


