支气管哮喘是一种基于慢性支气管炎症的多样化、多因子的疾病,它存在可变和大部分可逆转的呼吸道阻塞[1]。近年来,哮喘相关的免疫机制研究逐渐增多,研究表明哮喘患者正常的免疫功能受损,存在免疫功能低下及免疫机制紊乱[2]。呼吸道感染是哮喘急性发作的常见诱发因素之一,如何调节呼吸系统免疫,从而减少哮喘急性发作是目前临床研究的热点之一。细菌溶解产物(OM-85BV)是8种细菌的冻干溶解物,是一种常用的呼吸道免疫调节剂,有研究证实口服OM-85BV可通过刺激黏膜源性淋巴组织(mucosa-associated lympoid tissue, MALT)激活机体免疫系统,增加调节性T细胞活性,减轻气道高反应性[3]。目前OM-85BV已应用于反复呼吸道感染和慢性支气管炎等的预防治疗。全反式维甲酸(all trans-retinoic acid, ATRA)是维生素A的活性型,是一种脂溶性维生素,素来有“抗感染维生素”之称,它具有拮抗呼吸道氧化性损伤、促进呼吸道损伤的修复、抑制呼吸道高反应、诱导免疫耐受、调节呼吸道炎症等功能[4],与机体的免疫调节功能密切相关。本实验通过使用OM-85BV及ATRA两种药物对哮喘模型小鼠进行干预治疗,通过测定哮喘小鼠肺泡灌洗液(BALF)中细胞因子水平以及肺部病理改变,观察OM-85BV及ATRA治疗哮喘小鼠的可能性并分析二者影响哮喘小鼠呼吸道炎症的作用途径,为临床治疗哮喘提供用药依据。
1 材料与方法 1.1 实验动物SPF级6~8周龄雌性近交系BALB/c小鼠40只,体重20.0±3.3 g,由湖南斯莱克景达实验动物有限公司提供,动物生产许可证编号SCXK(湘)2016-0002,在湘雅医学院动物实验学部屏障环境中饲养,动物使用许可证编号SYXK(湘)2015-0017。
1.2 主要仪器与试剂卵清蛋白(OVA)及氢氧化铝佐剂(美国Sigma公司),OM-85BV(瑞士欧姆制药),维A酸片(山东良福制药有限公司),逆转录试剂盒(北京康为世纪生物科技有限公司),TRIzol(美国Invitrogen公司),引物设计与合成(上海生物工程有限公司),ECL化学发光液(美国Thermo公司);转膜仪(北京六一生物科技有限公司),荧光定量RCP仪(美国Thermo公司),多功能酶标分析仪(深圳市汇松科技发展有限公司)。
1.3 动物分组及模型制作40只雌性BALB/c小鼠按随机数字表法分为正常对照组、模型组、OM-85BV组、ATRA组、ATRA+OM-85BV组(n=8)。模型组小鼠分别于实验第1天、第14天腹腔注射OVA混悬液(OVA 100 mg+氢氧化铝10 mg+生理盐水0.4 mL)致敏,并于第14天以2% OVA溶液5 mL雾化吸入激发1次,第25天起置于自制透明雾化箱中,予以1% OVA溶液5 mL雾化吸入激发,每日1次,每次30 min,共10 d,小鼠出现呼吸急促、烦躁不安、腹肌痉挛、两便失禁为阳性反应。OM-85BV组、ATRA组、ATRA+OM-85BV组致敏及激发步骤同模型组,从第25天起于每次激发前,OM-85BV组予OM-85BV(OM-85BV 1.75 mg+生理盐水0.3 mL)灌胃,ATRA组予ATRA(ATRA 250 μg+生理盐水0.3 mL)灌胃,ATRA+OM-85BV组予OM-85BV联合ATRA(OM-85BV 1.75 mg+ATRA 250 μg+生理盐水0.3 mL)灌胃。正常对照组腹腔注射致敏以及雾化吸入激发均以等量生理盐水替代。正常对照组和模型组灌胃均以生理盐水替代。本实验所采用的造模方法及药物剂量参考国内外的相关文献报道同时加以改进[5-8]。
1.4 标本采集实验第35~36天,即末次激发后24~48 h予10%水合氯醛麻醉小鼠,开胸,取眼眶血备用,结扎左肺,以0.5 mL PBS溶液灌洗右肺并回收灌洗液,重复灌洗2~3次,收集的灌洗液以2 000 r/min离心10 min,收集上清液储存于-20℃冰箱。取左肺置于4%多聚甲醛固定液中固定。
1.5 肺组织病理学观察左肺固定48 h后,脱水、石蜡包埋,制成5 μm厚度的薄片,行苏木精-伊红(HE)染色,400倍光镜下观察肺组织的病理变化。
1.6 酶联免疫吸附法(ELISA)测定BALF中IL-10、IL-17的水平采用小鼠细胞因子ELISA检测试剂盒,实验步骤按试剂盒说明书进行,根据光密度值来计算细胞因子的含量。
1.7 荧光定量PCR检测肺组织ROR-γT mRNA的相对表达TRIzol提取组织总RNA,以mRNA为模板,逆转录为互补脱氧核糖核酸(cDNA),并以此为模板行PCR扩增。ROR-γt上游引物:5'-CTATAGCACTGACGGCCAACTTACTC-3',下游引物:5'-CTCTCGGAAGGACTTGCAGACATTC-3',片段长度199 bp;β-actin上游引物:5'-ACATCCGTAAAGACCTCTATGCC-3',下游引物:5'-TACTCCTGCTTGCTGATCCAC-3',片段长度223 bp。反应体系(30 μL):1 μL cDNA模板,上、下游引物各0.5 μL,15 μL预混试剂及13 μL双蒸水。反应条件:95℃10 min;95℃15 s,60℃50 s,40个循环。行2%琼脂糖凝胶电泳,结果以ROR-γt与β-actin的相对吸光度比值表示。
1.8 统计学分析采用SPSS 20.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,多组间均数的比较采用方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
2 结果 2.1 哮喘动物模型的评价模型组、OM-85BV组、ATRA组、ATRA+OM-85BV组小鼠致敏后表现为烦躁不安、毛色失去光泽;雾化激发过程中出现呼吸急促、点头呼吸、呼吸节律不规则,弓背直立、前肢缩抬,口唇及四肢末端有不同程度发绀,行动迟缓,二便失禁等哮喘速发相反应表现;模型组小鼠在哮喘激发过程中的上述表现较其他3组强烈。雾化激发结束后雾化箱内遗留较多排泄物,雾化结束30 min左右小鼠上述症状可自行缓解。正常对照组小鼠活动自如,无上述表现。
2.2 肺组织病理学观察结果与正常对照组相比,模型组小鼠支气管上皮水肿,气道管壁、血管壁及基底膜增厚,平滑肌及周围血管增生,支气管管腔缩小,管腔内分泌物明显增多,支气管周围及肺泡壁可见大量炎性细胞浸润。与模型组相比,OM-85BV组、ATRA组、ATRA+OM-85BV组小鼠气道管壁、血管壁及基底膜稍增厚,管腔有缩小,支气管周围及肺泡壁炎性细胞浸润有减少,炎症反应均有改善。见图 1。
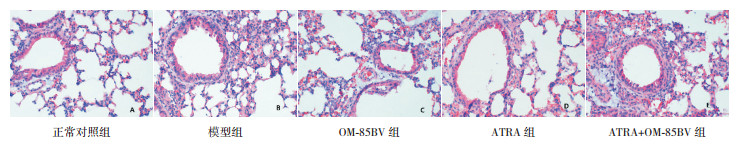
|
图 1 各组小鼠肺组织病理改变(苏木精-伊红染色,×400) 正常对照组气道黏膜完整,气道壁未见明显增厚,周围无明显的炎性细胞浸润。模型组气道管壁、周围血管壁及基底膜可见明显增厚,周围血管及气道平滑肌增生,支气管管腔缩小,管腔内分泌物明显增多,支气管周围及肺泡壁可见大量炎性细胞浸润。OM-85BV组可见管腔有狭窄,气道管壁、血管壁及基底膜均轻度增厚,血管及平滑肌轻度增生,支气管周围及肺泡壁可见少量炎性细胞浸润。ATRA组气道黏膜完整,管腔规则,气道管壁、血管壁及基底膜均轻度增厚,周围可见少量炎性细胞浸润。ATRA+OM-85BV组可见气道管壁、血管壁及基底膜均有轻度增厚,血管及平滑肌有增生,支气管周围及肺泡壁可见稍多炎性细胞浸润。 |
与正常对照组相比,模型组BALF中IL-10水平明显降低,IL-17水平明显升高(P < 0.05);与模型组相比,OM-85BV组BALF中IL-10水平明显增高,IL-17水平明显降低(P < 0.05);与模型组相比,ATRA组BALF中IL-17水平明显下降(P < 0.05);与ATRA组相比,ATRA+OM-85BV组BALF中IL-10及IL-17水平均有升高(P < 0.05)。见表 1。
| 表 1 各组小鼠BALF中IL-10及IL-17水平比较 |
|
|
各组小鼠肺组织中ROR-γT mRNA的相对表达量比较差异有统计学意义(F=6.816,P < 0.001)。与正常对照组(1.8±0.7)相比,模型组ROR-γT mRNA的相对表达(5.8±2.4)明显增加(P < 0.05);与模型组相比,OM-85BV组(1.7±2.3)、ATRA组ROR-γT mRNA的相对表达(3.5±1.9)均明显下降(P < 0.05);与OM-85BV组相比,ATRA+OM-85BV组ROR-γT mRNA的相对表达(3.9±1.2)明显增加(P < 0.05)。
3 讨论支气管哮喘是一种异质性疾病,众多炎症细胞(肥大细胞、嗜酸性粒细胞、T淋巴细胞、单核-巨噬细胞、中性粒细胞等)及细胞组分(血小板活化因子、白三烯、前列腺素、活性神经肽等介质,IL-10、IL-17、TGF-β1等细胞因子)参与哮喘发病的病理生理过程。其中T淋巴细胞发挥着重要的免疫调节作用,Th1/Th2失衡是公认的哮喘发病机制的核心。目前越来越多的研究表明,Th17细胞/CD4+CD25+调节性T细胞(Treg细胞)功能平衡紊乱在哮喘的发生发展中起着重要的作用。Treg细胞可以控制自身免疫性疾病和移植物排斥反应,并可能在支气管哮喘和过敏性疾病的发病中起炎症抑制作用。Treg细胞通过分泌IL-10及TGF-β在控制儿童哮喘中发挥重要作用[9]。Th17细胞是重要的促炎症细胞,可通过分泌IL-17诱导多种前炎症因子和趋化因子,在促炎症反应和自身免疫性疾病中发挥作用。Shi等[10]研究发现,在中度至重度哮喘患者中Th17细胞及IL-17水平明显升高,而Treg细胞及IL-10显著减少。这些结果均提示IL-10及IL-17参与了哮喘的发生发展过程,且Th17/Treg细胞功能平衡紊乱在哮喘发病机制中起重要作用。
ROR-γT是维甲酸相关核孤儿受体家族成员之一,主要分布于CD4+CD8+淋巴细胞内。ROR-γT是Th17细胞的特异性转录因子,能诱导初始T细胞分化成Th17细胞,同时能诱导Th17细胞高分泌IL-17,还参与Th17细胞介导的炎症性疾病的发病过程[11]。缺乏ROR-γT细胞的小鼠会减弱自身免疫性疾病,组织会缺乏Th17细胞,研究表明ROR-γT是免疫稳态的重要调节因子[12],它在Th17细胞分化发育及参与哮喘气道炎症反应中发挥了重要作用[13]。
本实验采用OVA致敏方法建立支气管哮喘小鼠模型。哮喘模型组小鼠在致敏及激发过程中出现哮喘速发相反应,病理切片显示支气管上皮水肿,基底膜及平滑肌增厚,支气管痉挛收缩,支气管周围及肺泡壁可见大量炎性细胞浸润,均提示哮喘模型制作成功。本研究发现口服OM-85BV、ATRA以及两种药物联合干预,均可减少炎症细胞浸润,气道重塑有减轻,炎症反应均有改善。这与Chen等[14]的实验证明母孕期充足的维生素A水平可以抑制成年鼠的气道平滑肌过度分化,减轻成年鼠的气道高反应性及气道重塑,以及Niu等[15]关于VitA有利于维持气道完整性,减轻气道重塑的结论一致。同时与刘静等[16]研究发现OM-85BV对哮喘小鼠气道炎症改善有预防作用的结论相同。本研究中OM-85BV组和ATRA组的ROR-γT mRNA及IL-17均明显下降,提示口服OM-85BV及ATRA能有效调节Th17细胞功能,通过抑制ROR-γT的表达,从而减少Th17细胞分泌IL-17,抑制炎症反应,与Xiao等[17]研究发现VitA可通过抑制维甲酸孤儿受体表达来抑制IL-6和TGF-β1对Th17细胞的分化诱导观点一致。同时OM-85BV组的IL-10明显增加,考虑口服OM-85BV能增加Treg细胞的分化,进一步对炎症起抑制作用,此与Strickland等[3]的观点相符:OM-85BV可刺激机体CD4+CD25+ Treg的分化及其转录因子Foxp3和IL-10的表达;亦与Fu等[18]推测哮喘小鼠口服OM-85BV可能引起Treg细胞增殖相一致。根据OM-85BV组病理切片改变及IL-10水平明显增加,促炎症因子IL-17及其重要转录因子ROR-γT mRNA均明显下降的结果,考虑OM-85BV可以减轻哮喘小鼠肺组织的炎症反应,同Han等[19]研究所得婴儿毛细支气管炎继发哮喘患者中OM-85BV的使用能减少喘息的发作的结论相符合。根据ATRA组病理切片改变及促炎症因子IL-17及其重要转录因子ROR-γT mRNA均下降的结果,考虑ATRA亦可以减轻哮喘小鼠肺组织的炎症反应,Fujii等[20]也研究发现维甲酸X受体激动剂与维甲酸受体结合后,哮喘小鼠模型中气道高反应性降低,小鼠气道炎性细胞减少,肺泡灌洗液中细胞因子的水平变化。Luo等[21]研究指出,患有喘息的婴儿中维生素A普遍缺乏,同时维生素A缺乏的程度与喘息的严重程度相关。OM-85BV+ATRA组的病理改变较OM-85BV组、ATRA组并无进一步改善,且IL-10、IL-17及ROR-γT mRNA较OM-85BV组、ATRA组均稍有增加,提示两种药物联用在Th17/Treg细胞功能平衡中并无明确优势作用细胞,联合用药并没有较单独用药干预有更明显的疗效,这可能与二者联合用药时干预药物剂量的掌握,以及干预时间的长短有关,需要进一步的实验研究。
| [1] |
Horak F, Doberer D, Eber E, et al. Diagnosis and management of asthma-Statement on the 2015 GINA Guidelines[J]. Wien Klin Wochenschr, 2016, 128(15-16): 541-554. DOI:10.1007/s00508-016-1019-4 (  0) 0) |
| [2] |
Umlawska W, Gaszczyk G, Sands D. Physical development in children and adolescents with bronchial asthma[J]. Respir Physiol Neurobiol, 2013, 187(1): 108-113. DOI:10.1016/j.resp.2013.02.012 (  0) 0) |
| [3] |
Strickland DH, Judd S, Thomas JA, et al. Boosting airway T-regulatory cells by gastrointestinal stimulation as a strategy for asthma control[J]. Mucosal Immunol, 2011, 4(1): 43-52. DOI:10.1038/mi.2010.43 (  0) 0) |
| [4] |
庄丽丽, 周国平. 维生素A与哮喘关系的研究进展[J]. 国际儿科学杂志, 2015, 42(1): 1-5. (  0) 0) |
| [5] |
Liu C, Huang R, Yao R, et al. The immunotherapeutic role of bacterial lysates in a mouse model of asthma[J]. Lung, 2017, 195(5): 563-569. DOI:10.1007/s00408-017-0003-8 (  0) 0) |
| [6] |
郭欣, 洪建国, 周小建. 细菌溶解产物和1, 25-二羟维生素D3对支气管哮喘小鼠呼吸道炎症的影响[J]. 中华实用儿科临床杂志, 2016, 31(12): 936-939. DOI:10.3760/cma.j.issn.2095-428X.2016.12.016 (  0) 0) |
| [7] |
Sakamoto H, Koya T, Tsukioka K, et al. The effects of all-trans retinoic acid on the induction of oral tolerance in a murine model of bronchial asthma[J]. Int Arch Allergy Immunol, 2015, 167(3): 167-176. DOI:10.1159/000437326 (  0) 0) |
| [8] |
Bessler WG, Vor dem Esche U, Masihi N. The bacterial extract OM-85 BV protects mice against influenza and Salmonella infection[J]. Int Immunopharmacol, 2010, 10(9): 1086-1090. DOI:10.1016/j.intimp.2010.06.009 (  0) 0) |
| [9] |
Ray A, Khare A, Krishnamoorthy N, et al. Regulatory T cells in many flavors control asthma[J]. Mucosal Immunol, 2010, 3(3): 216-229. DOI:10.1038/mi.2010.4 (  0) 0) |
| [10] |
Shi YH, Shi GC, Wan HY, et al. Coexistence of Th1/Th2 and Th17/Treg imbalances in patients with allergic asthma[J]. Chin Med J (Engl), 2011, 124(13): 1951-1956. (  0) 0) |
| [11] |
Manel N, Unutmaz D, Littman DR. The differentiation of human T(H)-17 cells requires transforming growth factor-beta and induction of the nuclear receptor RORγt[J]. Nat Immunol, 2008, 9(6): 641-649. DOI:10.1038/ni.1610 (  0) 0) |
| [12] |
Ivanov Ⅱ, Mckenzie BS, Zhou L, et al. The orphan nuclear receptor RORγt directs the differentiation program of proinflammatory IL-17+ T helper cells[J]. Cell, 2006, 126(6): 1121-1133. DOI:10.1016/j.cell.2006.07.035 (  0) 0) |
| [13] |
Cosmi L, Liotta F, Annunziato F. Th17 regulating lower airway disease[J]. Curr Opin Allergy Clin Immunol, 2016, 16(1): 1-6. DOI:10.1097/ACI.0000000000000227 (  0) 0) |
| [14] |
Chen F, Marquez H, Kim YK, et al. Prenatal retinoid deficiency leads to airway hyperresponsiveness in adult mice[J]. J Clin Invest, 2014, 124(2): 801-811. DOI:10.1172/JCI70291 (  0) 0) |
| [15] |
Niu C, Liu N, Liu J, et al. Vitamin A maintains the airway epithelium in a murine model of asthma by suppressing glucocorticoid-induced leucine zipper[J]. Clin Exp Allergy, 2016, 46(6): 848-860. DOI:10.1111/cea.2016.46.issue-6 (  0) 0) |
| [16] |
刘静, 周小建, 洪建国. 细菌溶解产物对哮喘小鼠气道炎症的预防作用[J]. 临床儿科杂志, 2014, 32(8): 767-771. (  0) 0) |
| [17] |
Xiao S, Jin H, Korn T, et al. Retinoic acid increases Foxp3+ regulatory T cells and inhibits development of Th17 cells by enhancing TGF-beta-driven Smad3 signaling and inhibiting IL-6 and IL-23 receptor expression[J]. J Immunol, 2008, 181(4): 2277-2284. DOI:10.4049/jimmunol.181.4.2277 (  0) 0) |
| [18] |
Fu R, Li J, Zhong H, et al. Broncho-Vaxom attenuates allergic airway inflammation by restoring GSK3β-related T regulatory cell insufficiency[J]. PLoS One, 2014, 9(3): e92912. DOI:10.1371/journal.pone.0092912 (  0) 0) |
| [19] |
Han RF, Li HY, Wang JW, et al. Study on clinical effect and immunologic mechanism of infants capillary bronchitis secondary bronchial asthma treated with bacterial lysates Broncho-Vaxom[J]. Eur Rev Med Pharmacol Sci, 2016, 20(10): 2151-2155. (  0) 0) |
| [20] |
Fujii U, Miyahara N, Taniguchi A, et al. Effect of a retinoid X receptor partial agonist on airway inflammation and hyperresponsiveness in a murine model of asthma[J]. Respir Res, 2017, 18(1): 23. DOI:10.1186/s12931-017-0507-z (  0) 0) |
| [21] |
Luo ZX, Liu EM, Luo J, et al. Vitamin A deficiency and wheezing[J]. World J Pediatr, 2010, 6(1): 81-84. DOI:10.1007/s12519-010-0012-7 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


