多种酯酰辅酶A脱氢酶缺乏症(multiple acylcoenzyme A dehydrogenase deficiency, MADD)是一种线粒体电子传递链和脂肪酸代谢障碍的常染色体隐性遗传疾病[1-2]。由于气相质谱检测发现患者尿中有乙基丙二酸、戊二酸、己二酸、辛二酸及庚二酸等代谢物,又被称为戊二酸血症Ⅱ型[3]。MADD是由电子转移黄素蛋白(ETF)或电子转移黄素蛋白-泛醌氧化还原酶(ETFDH)缺陷所致[4]。ETF是由ETFA和ETFB组成的异源二聚体,并结合黄素腺嘌呤二核苷酸(FAD)和单磷酸腺苷(AMP)组成[5]。ETFDH是由FAD结合结构域、铁-硫簇结构域及辅酶Q10结合结构域组成[6]。生理情况下,酯酰辅酶A脱氢酶产生的电子传递给ETF,再转运至ETFDH,经ETFDH结合的泛醌传递给呼吸链复合体Ⅲ。当EFT/ETFDH功能缺陷使线粒体氧化呼吸链脱氢酶脱氢产生的电子不能下传,导致脂肪酸、氨基酸及胆固醇能量代谢障碍。MADD临床表现高度异质[7],根据发病年龄可分为三类:Ⅰ型伴有先天性畸形的新生儿型;Ⅱ型新生儿起病,不伴有先天畸形;Ⅲ型起病晚,症状多样,迟发型。新生儿诊断此病主要依靠足跟血酯酰肉碱及尿中有机酸含量增加,但这些生化指标的改变可在发病间期不表现。因此MADD病因学基因诊断尤为重要。我们对1例临床表现为MADD患儿进行外显子测序,检测到ETFDH基因两个杂合突变,从分子水平阐明患儿发病机制,为其父母再生育提供遗传咨询。
1 资料与方法 1.1 研究对象患儿,男,14 d,第1胎第1产,足月儿。生后母乳喂养,进奶好,无呕吐,大小便正常。无嗜睡,无抽搐。父母非近亲结婚,母孕期定期产检,未发现异常。无家族遗传史。体查:精神反应好,肤红,哭畅,呼吸平,无气促,无青紫及三凹征,心肺听诊无异常,腹软,不胀,肝脾无肿大,四肢活动好,肌张力正常,拥抱反射正常。男性外生殖器,无尿道下裂。常规行新生儿足底血筛查时发现异常,串联质谱筛查结果发现:己酰基肉碱(C6)0.32 μmol/L(参考范围0.01~0.09 μmol/L)、辛酰基肉碱(C8)0.43 μmol/L(参考范围0.02~0.17 μmol/L)、葵酰基肉碱(C10)0.66 μmol/L(参考范围0.02~0.25 μmol/L)、十二烷酰基肉碱(C12)0.83 μmol/L(参考范围0.02~0.29 μmol/L)、十四烷酰基肉碱(C14)0.61 μmol/L(参考范围0.04~0.39 μmol/L)、十四烯酰基肉碱(C14 : 1)0.52 μmol/L(参考范围0.03~0.31 μmol/L)、C8/乙酰基肉碱(C2)0.03(参考范围0~0.01)、C14 : 1/十六烷酰基肉碱(C16)0.34(参考范围0.01~0.1)、丙二酰基肉碱(C3DC+C4OH)/C10 0.15(参考范围0.5~3.83)。尿液气象色谱-质谱联用分析结果显示:3-羟基丁酸15.78(正常均值0.7,参考范围0~3.7)、乙基丙二酸7.42(正常均值0.9,参考范围0~6.2)、己二酸17.34(正常均值3,参考范围0.5~5)、辛二酸13.45(正常均值2.4,参考范围0.3~4.7)和癸二酸8.1(正常均值2.2,参考范围0.4~7)。血糖4.2 mmol/L(参考范围2.2~7 mmol/L),血清谷草转氨酶139 U/L(参考范围5~40 U/L),谷丙转氨酶97 U/L(参考范围5~40 U/L),乳酸脱氢酶703 U/L(参考范围109~245 U/L),肌酸激酶330 U/L(参考范围38~171 U/L),心肌型CK同工酶66.4 U/L(参考范围0~25 U/L)。患儿生后20个月(出生日期2016年7月11日),在本院和上海定期随访,病情稳定,未出现明显临床症状,可能与干预较早有关。早期干预措施包括口服维生素B2,一日3次,每次100 mg;口服左卡尼汀,一日3次,每次200 mg;口服辅酶Q10,每日200 mg,分3次服用。同时患儿新生儿期未出现临床症状,不伴有先天畸形,考虑迟发型MADD,即MADDⅢ型[8]。
1.2 全基因外显子组捕获及测序提取患儿和父母外周血DNA,取1.5 μg DNA样本进行超声打断,打断程序为50%强度超声3 s停1 s共35 min,得到150~200 bp的DNA片段。片段化的DNA采用KAPA LTP Library Preparation Kit试剂构建DNA文库,通过安捷伦芯片对目标基因编码区及邻近剪切区的DNA进行捕获和富集,随后使用Illumina HiSeq2500高通量测序,目标序列测序覆盖度不低于99%。
1.3 生物信息学分析测序结果结合致病突变数据库、正常人基因组数据库、已知四千种遗传病临床特征数据库进行分析,采用Mutation Asses软件根据进化保守性,Mutation Taster和Polyphen-2软件根据蛋白质结构/功能和进化保守性,Provean软件根据变异序列和蛋白序列同源性之间的相似性进行比对,并预测新的基因突变对蛋白功能的影响。采用多序列比对分析ETFDH在该位点序列的保守性。在Pubmed数据库中检索该突变所在的结构域,预测其可能参与的生物学进程。
1.4 疑似致病突变验证对目标序列进行PCR后,引物见表 1,经ABI3730测序仪进行Sanger测序验证,并经序列分析软件得到验证结果。
| 表 1 ETFDH突变位点验证引物 |
|
|
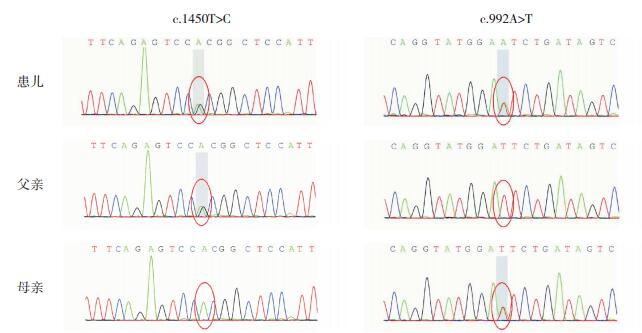
通过对患儿及其父母全基因外显子测序发现,ETFDH基因存在两处杂合突变位点:c.1450T > C、c.992A > T,导致氨基酸改变:p.W484R(色氨酸变为精氨酸)、p.N331I(天冬酰胺变为异亮氨酸);父亲携带有c.1450T > C杂合突变,母亲携带有c.992A > T杂合突变。见图 1。
|
图 1 ETFDH基因Sanger测序结果 患儿ETFDH基因存在c.1450T>C、c.992A>T杂合突变,患儿之父携带ETFDH基因c.1450T>C突变,患儿之母携带ETFDH基因c.992A>T突变。 |
HGMDpro数据库显示c.1450T > C为导致MADD的致病突变[9];目前尚未有c.992A > T突变的文献报道。检索千人数据库和EXAC数据库,在正常对照人群中未发现c.992A > T突变。
2.2 生物信息学预测通过Mutation Asses、Mutation Taster、Provean和PolyPhen-2软件评估新突变c.992A > T(p.N331I)对蛋白有影响,其最后评分分别为蛋白质功能受损可能大(-8.992,评分 < -2.5预测为有害)和致病性可能大(0.999,参考范围0~1,越接近1,危害程度可能越大),提示该突变有可能对蛋白影响较大。
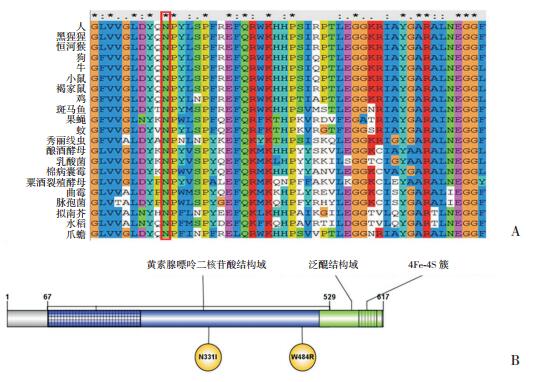
对人、猿、小鼠等多个物种的ETFDH基因作多序列比对分析,结果显示331位的亮氨酸高度保守(图 2A)。文献检索发现c.992A > T(p.N331I)在ETFDH基因FAD结合区域(图 2B)。
|
图 2 功能保守性分析 A:多物种序列比对;B:ETFDH基因常见的功能结构域。 |
迄今为止,MADD的发病率尚无明确的报道,但患者并不少见。1985~2000年日本的187所医疗机构中检出的64例线粒体脂肪酸氧化障碍相关疾病患者中有14例是MADD(22%)[10]。2005~2012年上海新华医院对1.5万例高危儿进行串联质谱检测,发现65例MADD患者,提示MADD是中国人常见而重要的脂肪酸代谢缺陷[3]。鉴于MADD在中国人群中不低的发病率[11],而基因缺陷导致的此病目前尚无有效的治疗措施[12]。因此分子水平阐明MADD发病机制的研究为MADD的预防提供坚实的基础。
本病涉及到线粒体脂肪酸氧化和支链氨基酸代谢途径中多种酶功能受损,临床表现多样,缺乏特异性,容易漏诊和误诊,串联质谱检测中可表现为酰基肉碱C4至C18广泛增高,尿气相色谱检测多种有机酸、二羧酸、羟基酸增高。然而并不是每个MADD患儿都会出现以上典型的实验室检查异常,在轻症或发病间歇期,血串联质谱、尿气相色谱结果可能改变轻微或不典型,多次复查亦难以诊断,且极易与其他代谢病混淆。本文中患儿临床并无明显症状,于新生儿期串联质谱筛查时发现异常,结合尿气相色谱出现上述较典型改变,临床诊断MADD,随即开始维生素B2、左卡尼汀及辅酶Q10等治疗,目前随访期间治疗效果良好。
基因的诊断一方面有利于明确患者致病原因,指导临床治疗,另一方面由于大部分的突变至今尚无有效的治疗方法,明确的基因诊断更加有利于患儿父母生育下一代的胚胎植入前的诊断或产前诊断。MADD基因型与临床表型相关,无义突变、框移突变及剪切突变会造成无义突变导致mRNA降解通路激活及ETF/ETFDH酶复合体完全缺陷[13],临床表型较重,而错义突变及小片段缺失和插入突变有残余ETF/ETFDH酶活性,与轻型相关。部分MADD对核黄素疗效显著,称为核黄素反应性MADD。而核黄素反应性MADD是由ETFDH基因突变导致,这些突变位点大多集中在UQ或FAD结构域,均未累计直接与FAD直接连接的氨基酸位点。ETFDH基因点突变可能会导致蛋白构象改变,进而影响与FAD的结合且其结合的复合物稳定性下降。核黄素的补充增加了线粒体内FAD浓度,一方面可以提高突变蛋白与FAD的结合率,另一方面核黄素的增加可提高突变蛋白的稳定性和生物学活性。通过对患儿全基因外显子测序发现ETFDH基因两处杂合突变位点:c.1450T > C、c.992A > T,而这两个突变位点都在FAD结构域,基于以上文献回顾分析,这也解释了本文患儿临床症状相对较轻同时对核黄素的治疗效果反应良好。
综上所述,本研究对1个MADD核心家系中ETFDH基因突变进行研究,发现ETFDH基因两处杂合突变位点:c.1450T > C(胸腺嘧啶 > 胞嘧啶),c.992A > T(腺嘌呤 > 胸腺嘧啶),父亲携带有c.1450T > C杂合突变,母亲携带有c.992A > T杂合突变。通过生物信息预测、氨基酸同源序列比对及蛋白质结构域分析,初步证实了该新发突变为致病突变,不仅丰富了ETFDH基因的突变谱,同时为以后的基因与表型及胚胎植入前诊断、产前诊断提供依据。
| [1] |
Er TK, Liang WC, Chang JG, et al. High resolution melting analysis facilitates mutation screening of ETFDH gene:applications in riboflavin-responsive multiple acyl-CoA dehydrogenase defciency[J]. Clin Chim Acta, 2010, 411(9-10): 690-699. DOI:10.1016/j.cca.2010.01.033 (  0) 0) |
| [2] |
van der Westhuizen FH, Smuts I, Honey E, et al. A novel mutation in ETFDH manifesting as severe neonatal-onset multiple acyl-CoA dehydrogenase deficiency[J]. J Neurol Sci, 2018, 384: 121-125. DOI:10.1016/j.jns.2017.11.012 (  0) 0) |
| [3] |
章瑞南, 邱文娟, 叶军, 等. 多种酰基辅酶A脱氢酶缺乏症儿童与成人患者临床特点比较[J]. 临床儿科杂志, 2012, 30(5): 446-449. (  0) 0) |
| [4] |
Leone P, Galluccio M, Barbiroli A, et al. Bacterial production, characterization and protein modeling of a novel monofuctional isoform of FAD synthase in humans:an emergency protein?[J]. Molecules, 2018, 23(1): 116. DOI:10.3390/molecules23010116 (  0) 0) |
| [5] |
Olsen RK, Broner S, Sabaratnam R, et al. The ETFDH c.158A>G variation disrupts the balanced interplay of ESE-and ESSbinding proteins thereby causing missplicing and multiple AcylCoA dehydrogenation deficiency[J]. Hum Mutat, 2014, 35(1): 86-95. DOI:10.1002/humu.2014.35.issue-1 (  0) 0) |
| [6] |
Swanson MA, Usselman RJ, Frerman FE, et al. The ironsulfur cluster of electron transfer flavoprotein-ubiquinone oxidoreductase is the electron acceptor for electron transfer flavoprotein[J]. Biochemistry, 2008, 47(34): 8894-8901. DOI:10.1021/bi800507p (  0) 0) |
| [7] |
Grunert SC. Clinical and genetical heterogeneity of lateonset multiple acyl-coenzyme A dehydrogenase deficiency[J]. Orphanet J Rare Dis, 2014, 9: 117. DOI:10.1186/s13023-014-0117-5 (  0) 0) |
| [8] |
Zhao YW, Liu XJ, Zhang W, et al. Muscle magnetic resonance imaging for the differentiation of multiple Acyl-CoA dehydrogenase deficiency and immune-mediated necrotizing myopathy[J]. Chin Med J (Engl), 2018, 131(2): 144-150. DOI:10.4103/0366-6999.222323 (  0) 0) |
| [9] |
Wen B, Li D, Li W, et al. Multiple acyl-CoA dehydrogenation deficiency as decreased acyl-carnitine profile in serum[J]. Neurol Sci, 2015, 36(6): 853-859. DOI:10.1007/s10072-015-2197-y (  0) 0) |
| [10] |
Tamaoki Y, Kimura M, Hasegawa Y, et al. A survey of Japanese patients with mitochondrial fatty acid beta-oxidation and related disorders as detected from 1985 to 2000[J]. Brain Dev, 2002, 24(7): 675-680. DOI:10.1016/S0387-7604(02)00074-8 (  0) 0) |
| [11] |
Vengalil S, Preethish-Kumar V, Polavarapu K, et al. Fatty acid oxidation defects presenting as primary myopathy and prominent dropped head syndrome[J]. Neuromuscul Disord, 2017, 27(11): 986-996. DOI:10.1016/j.nmd.2017.08.004 (  0) 0) |
| [12] |
Trebatická J, Hradečná Z, Böhmer F, et al. Emulsifed omega-3 fatty-acids modulate the symptoms of depressive disorder in children and adolescents:a pilot study[J]. Child Adolesc Psychiatry Ment Health, 2017, 11: 30. DOI:10.1186/s13034-017-0167-2 (  0) 0) |
| [13] |
鲍梦馨. 多种酰基辅酶A脱氢酶缺乏症两家系临床、病理及分子遗传学研究[D]. 济南: 山东大学, 2012. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2184160
(  0) 0) |
 2018, Vol. 20
2018, Vol. 20


