急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)是儿童最常见恶性肿瘤,其中B细胞ALL(B-ALL)约占儿童ALL的80%,随着治疗的进步,80%左右可长期无病生存[1]。但仍有15%~20%的B-ALL复发,这与体内的残留白血病细胞即微小残留病(minimal residual diseas, MRD)有关[2]。在ALL的现代分层治疗中,MRD是危险分层的重要指标,可作为一个独立的预后参数,诱导缓解第33天是MRD监测的重要时间点[3-4]。中国儿童白血病协作组(Chinese Children's Leukemia Group, CCLG)ALL-2008方案将第33天MRD作为危险分层的一个独立参数,第33天MRD阳性是B-ALL患儿的高危因素[5-6]。IKZF1(Ikaros family zinc finger 1)基因的编码蛋白Ikaros属于锌指DNA结合蛋白家族,参与染色质重塑,发挥调控淋巴细胞分化发育,是淋巴系统发育必需的转录因子。Ikaros基因包含结合DNA的N端4个锌指结构,以及形成二聚体的C端2个锌指结构。IKZF1基因含8个外显子,可产生10余种亚型,只有N端含有至少3个锌指结构的亚型(IKl-IK3)才能与DNA正确结合而正常发挥功能,因此IKl-IK3被认为是功能亚型,而其他亚型为显性负向Ikaros异构体,即功能缺失亚型。IKZF1基因功能缺失亚型的表达与儿童ALL预后不良相关[7]。而关于IKZF1基因型联合诱导缓解第33天MRD对B-ALL儿童预后的预测鲜有报道。本研究通过巢式逆转录聚合酶链反(reverse transcription-polymerase chain reaction, RT-PCR)方法检测儿童B-ALL患者IKZF1基因亚型表达,并应用流式细胞术检测第33天MRD水平,以探讨第33天MRD及IKZF1基因型对于生存的影响。
1 资料与方法 1.1 研究对象收集湖南省儿童医院血液内科2012年1月至2015年6月第一疗程化疗获得完全缓解且有完整随访信息的152例初诊B-ALL患者的临床资料,均经骨髓细胞形态学、免疫学分型、细胞遗传学和分子生物学确诊,诊断、疗效评价、复发均参照《血液病诊断及疗效标准》[8],并按CCLG-ALL-2008方案治疗[6]。其中男88例、女64例,平均年龄6.25岁。随访截至2017年8月1日,中位随访时间35(14~68)个月,随访期间2例因严重感染死亡,26例复发。无复发生存期指从完全缓解(complete remission, CR)至第一次复发的时间。
本研究获得患儿家长的知情同意。
1.2 染色体、融合基因和MRD检测染色体、融合基因和MRD检测均由武汉康圣达医学检验所完成。危险度分组参照CCLG-ALL-2008方案[6]标准。并以第33天MRD作为危险分层的依据,残留白血病细胞 < 10-4者为MRD标危组(60例),10-4≤MRD < 10-2为MRD中危组(55例),MRD≥10-2为MRD高危组(37例)。
1.3 巢式RT-PCR检测IKZF1基因亚型表达收集化疗前的骨髓单个核细胞,用TRIzol法提取总RNA,逆转录合成cDNA。利用Primer Premier 6软件设计PCR引物,引物合成委托美国Invitrogen公司完成。内参基因GAPDH引物上游5'-GAAGGTGAAGGTCGGAGTC-3',下游5'-GAAGATGGTGATGGGATTTC-3',扩增片段长度226 bp。IKZF1基因巢式PCR引物能够扩增IKZF1所有亚型,外引物上游5'-ATGGATGCTGATGAGGGTCAAGAC-3',下游5'-TTAGCTCATGTGGAAGCGGTGCTC-3';内引物上游5'-CCCCTGTAAGCGATACTCCAGATG-3',下游5'-GATGGCTTGGTCCATCACGTGGGA-3'。第一轮PCR反应体系为20 μL,包括2×GoTaq Green Master Mix 10 μL、外侧上游和下游引物1.5 μL、cDNA 1.5 μL、ddH2O 7 μL,ddH2O做阴性对照。PCR条件:95℃预变性5 min;95℃变性30 s,60℃退火30 s,72℃延伸30 s,35个循环后72℃延伸7 min,4℃终止反应。取第一轮PCR扩增产物0.5 μL与9.5 μL ddH2O混合,从中吸取1.5 μL进行第二轮PCR。第二轮PCR反应体系为20 μL,包括2×GoTaq Green Master Mix 10 μL、外侧上游和下游引物各1.5 μL、第一轮PCR扩增产物1.5 μL、ddH2O 7 μL,用ddH2O做阴性对照。PCR条件:95℃预变性5 min;95℃变性30 s,60℃退火30 s,72℃延伸30 s,35个循环后72℃延伸7 min,4℃终止反应。取最终扩增产物2%琼脂糖凝胶电泳,利用紫外成像仪成像分析,电泳产物进行切胶回收测序鉴定:IKl-IK3为功能亚型,而缺乏IKl-IK3亚型为功能缺失亚型。上述实验由武汉康圣达医学检验所完成。
1.4 统计学分析采用SPSS 19.0软件进行数据处理。计数资料以频数或百分率(%)表示,组间比较采用χ2检验。采用Kaplan-Meier方法评估患儿5年无复发生存率,无复发生存率的组间比较采用log-rank检验。P < 0.05为差异有统计学意义。
2 结果 2.1 B-ALL患儿中IKZF1基因亚型的表达152例B-ALL患儿的IKZF1基因型有7种亚型(图 1):IK1(945 bp)、IK2/3(684 bp)、IK4(558 bp)、IK6(225 bp)、IK8(390 bp)、IK9(135 bp)和IK10(95 bp),并经过测序鉴定证实。130例(86%)儿童B-ALL患者表达IKZF1功能亚型,22例(14%)表达IKZFl功能缺失亚型。
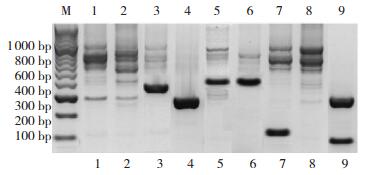
|
图 1 巢式PCR方法检测B-ALL患儿IKZF1基因表达情况 注:M泳道为marker,第l、8泳道945 bp处的明显条带为IK1亚型,第2泳道684 bp处的明显条带为IK2/3亚型,3泳道390 bp处的明显条带为IK8亚型,第4、9泳道225 bp处的明显条带为IK6亚型,第5、6泳道558 bp处的明显条带为IK4亚型,7泳道135 bp处的明显条带为IK9亚型,9泳道95 bp处的明显条带为IK10亚型。 |
152例患儿随访期间复发26例(17%),自诊断至复发的中位时间为28(6~62)个月。随着MRD水平增高,复发率逐渐增高,以MRD高危患儿复发率最高(P < 0.05),而标危、中危组复发率的差异无统计学意义(P > 0.05),见表 1。
| 表 1 MRD水平对B-ALL患儿复发的影响 [例(%)] |
|
|
表达IKZF1基因功能缺失亚型的患儿复发率高于表达IKZFl功能亚型的患儿(P < 0.01),见表 2。
| 表 2 IKZF1基因亚型对B-ALL患儿复发的影响 [例(%)] |
|
|
152例B-ALL患儿5年无复发生存率为(82.5±1.8)%,第33天MRD标危、中危和高危组的5年无复发生存率分别为(94.2±2.9)%、(86.7±3.8)%和(56.2±4.5)%,三组间的差异有统计学意义(P < 0.05);表达IKZF1基因功能亚型的患儿其5年无复发生存率[(89.6±2.7)%]高于表达功能缺失亚型的患儿[(31.3±3.9)%],差异有统计学意义(P < 0.01)。见图 2。
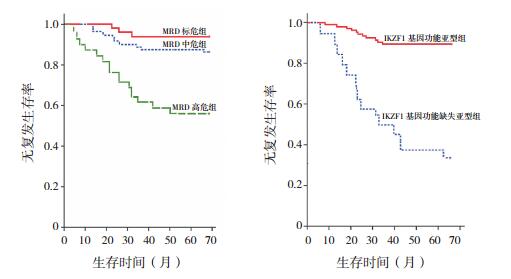
|
图 2 MRD分组及IKZF1基因亚型对B-ALL患儿5年无复发生存率的影响 |
诱导化疗第33天MRD标危组中表达IKZF1基因功能亚型或功能缺失亚型的患儿5年无复发生存率分别为(96.4±2.5)%和(75.8±3.6)%,差异无统计学意义(P=0.058);中危组及高危组表达IKZF1基因功能亚型的患儿5年无复发生存率[(95.3±2.2)%,(67.7±2.6)%]高于表达功能缺失亚型的患儿[(58.3±3.2)%,(14.3±1.5)%],差异有统计学意义(P < 0.05)。见图 3。
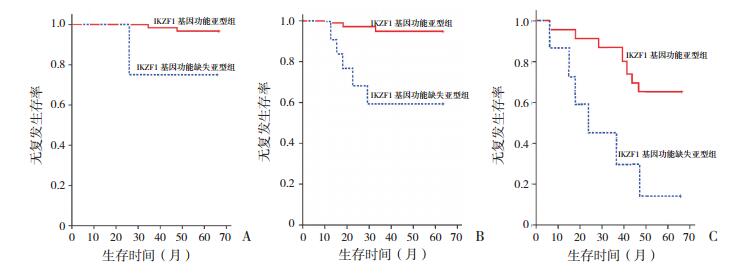
|
图 3 MRD危险分组与IKZFl基因型联合对于B-ALL患儿无复发生率的预测 A:MRD标危组;B:MRD中危组;C:MRD高危组。 |
近年来,儿童B-ALL的疗效取得很大进步,但复发仍是导致治疗失败的最主要原因,我国儿童ALL的累计复发率为15%左右[9]。本研究B-ALL的累计复发率为17.1%。B-ALL的高复发率对危险度分级提出了挑战。MRD监测在儿童ALL的疗效和预后评价方面具有重要价值,将MRD引入到传统的危险分层形成一种新的分层体系,能更好地判断ALL预后、优化治疗方案、提高治愈率[10]。
诱导缓解第33天的MRD具有重要的预后意义。Pui等[11]研究显示,在诱导缓解后MRD阴性的382例ALL中6例(1.6%)复发,而MRD阳性的11例患者2例(18.2%)复发。安粉艳等[6]报道第33天MRD≥10-2是B-ALL患儿5年无事件生存率和总生存率显著减低的高危因素。因此一些医疗机构已将第33天MRD引入白血病危险分层以指导治疗[5, 12]。刘晓明等[5]应用第33天MRD调整危险度并进行相应强度化疗,患儿严重感染的发生率没有增加,但复发率及病死率降低。Vora等[12-13]进行的随机对照试验显示,诱导结束时MRD < 0.01%和MRD为0.01%~0.1%的患者5年EFS分别为(87±1)%和(74±4)%,对MRD阳性患者采用更强的治疗方案可改善预后。本研究根据第33天MRD水平进行B-ALL危险分层,结果显示高危患儿复发率高于标危和中危。
IKZF1基因是与淋巴细胞发育相关的重要转录因子,编码产生IKAROS蛋白,参与造血细胞的分化发育,尤其在淋巴系统发育与肿瘤抑制中起关键作用[14]。
近年来发现部分复发ALL儿童存在IKZF1基因的缺失和突变。而IKZFl基因缺失突变主要表现为显性负向亚型即功能缺失亚型的表达,如IK6等表达。IKZF1基因缺失被证实是ALL预后不良因素[15]。研究表明IKZFl基因功能亚型的缺失与成人ALL早期复发与耐药有关[16]。黄小航等[17]报道IK6亚型(IKZFl基因功能缺失亚型)的表达可作为儿童B-ALL预后不良的标志,与B-ALL复发密切相关。本研究显示,存在IKZFl基因功能缺失亚型患儿的累计复发率高于IKZFl基因功能亚型阳性患儿,其5年无复发生存率也较低,与文献报道相似。虽然,MRD预后分层可识别出治疗反应差的B-ALL患者,但仍有部分MRD中危的患者出现复发。因此,目前的MRD预后分层系统不能真正反映患者复发风险。本研究将诱导缓解第33天MRD和IKZFl基因型联合,分析两者对于儿童B-ALL无复发生存率的共同影响。结果提示,第33天MRD标危组中存在IKZF1基因功能亚型患儿的5年无复发生存率与功能缺失亚型阳性患儿的差异无统计学意义,中危组和高危组中存在IKZF1基因功能亚型患儿的5年无复发生存率均高于功能缺失亚型阳性患儿,提示IKZF1功能缺失亚型B-ALL患儿若同时存在高水平MRD则复发率很高,预后非常差,有必要调整或探求新的治疗方案。
总之,将MRD联合IKZF1基因表达进行ALL的预后分层,可能为B-ALL患儿的个体化治疗提供更多依据。
| [1] |
Pui CH, Pei D, Campana D, et al. A revised defnition for cure of childhood acute lymphoblastic leukemia[J]. Leukemia, 2014, 28(12): 2336-2343. DOI:10.1038/leu.2014.142 (  0) 0) |
| [2] |
Schmiegelow K, Forestier E, Hellebostad M, et al. Long-term results of NOPHO ALL-92 and ALL-2000 studies of childhood acute lymphoblastic leukemia[J]. Leukemia, 2010, 24(2): 345-354. DOI:10.1038/leu.2009.251 (  0) 0) |
| [3] |
Paganin M, Zecca M, Fabbri G, et al. Minimal residual disease is all important predictive factor of outcome in children with relapsed high-risk acute lymphoblastic leukemia[J]. Leukemia, 2008, 22(12): 2193-2200. DOI:10.1038/leu.2008.227 (  0) 0) |
| [4] |
Cui L, Li Z, Wu M, et al. Combined analysis of minimal residual disease at two time points and its value for risk stratification in childhood B-lineage acute lymphoblastic leukemia[J]. Leuk Res, 2010, 34(10): 1314-1319. DOI:10.1016/j.leukres.2009.11.031 (  0) 0) |
| [5] |
刘晓明, 邹尧, 王慧君, 等. CCLG-2008方案治疗标危中危儿童急性淋巴细胞白血病中期随访结果[J]. 中华儿科杂志, 2014, 52(6): 449-454. (  0) 0) |
| [6] |
安粉艳, 张淑红, 孔令军, 等. 微量残留病在儿童B系急性淋巴细胞白血病危险分层及预后中的临床意义[J]. 中国实验血液学杂志, 2017, 25(3): 729-735. (  0) 0) |
| [7] |
Mullighan CG, Su X, Zhang J, et al. Deletion of IKZF1 and prognosis in acute lymphoblastic leukemia[J]. N Engl J Med, 2009, 360(5): 470-480. DOI:10.1056/NEJMoa0808253 (  0) 0) |
| [8] |
张之南, 沈悌. 血液病诊断及疗效标准[M]. 第3版. 北京: 科学出版社, 2007, 19-23.
(  0) 0) |
| [9] |
陈晓娟, 邹尧, 杨文钰, 等. CCLG-ALL 2008方案治疗儿童急性淋巴细胞白血病复发患儿的特征分析[J]. 中国当代儿科杂志, 2015, 17(4): 321-326. DOI:10.7499/j.issn.1008-8830.2015.04.006 (  0) 0) |
| [10] |
Meleshko AN, Savva NN, Fedasenka UU, et al. Prognostic value of MRD-dynamics in childhood acute lymphoblastic leukemia treated according to the MB-2002/2008 protocols[J]. Leuk Res, 2011, 35(10): 1312-1320. DOI:10.1016/j.leukres.2011.04.013 (  0) 0) |
| [11] |
Pui CH, Pei D, Coustan-Smith E, et al. Clinical utility of sequential minimal residual disease measurements in the context of risk-based therapy in childhood acute lymphoblastic leukaemia:a prospective study[J]. Lancet Oncol, 2015, 16(4): 465-474. DOI:10.1016/S1470-2045(15)70082-3 (  0) 0) |
| [12] |
Vora A, Goulden N, Wade R, et al. Treatment reduction for children and young adults with low-risk acute lymphoblastic leukaemia defned by minimal residual disease (UKALL 2003):a randomised controlled trial[J]. Lancet Oncol, 2013, 14(3): 199-209. DOI:10.1016/S1470-2045(12)70600-9 (  0) 0) |
| [13] |
Vora A, Goulden N, Mitchell C, et al. Augmented post-remission therapy for a minimal residual disease-defined high-risk subgroup of children and young people with clinical standardrisk and intermediate-risk acute lymphoblastic leukaemia (UKALL 2003):a randomised controlled trial[J]. Lancet Oncol, 2014, 15(8): 809-818. DOI:10.1016/S1470-2045(14)70243-8 (  0) 0) |
| [14] |
张海英, 白海. Ikaros在急性B淋巴细胞白血病中的作用[J]. 中国实验血液学杂志, 2015, 23(4): 1194-1198. (  0) 0) |
| [15] |
Marke R, Havinga J, Cloos J, et al. Tumor suppressor IKZF1 mediates glucocorticoid resistance in B-cell precursor acute lymphoblastic leukemia[J]. Leukemia, 2016, 30(7): 1599-1603. DOI:10.1038/leu.2015.359 (  0) 0) |
| [16] |
Liu P, Lin Z, Qian S, et al. Expression of dominant-negative Ikaros isoforms and associated genetic alterations in Chinese adult patients with leukemia[J]. Ann Hematol, 2012, 91(7): 1039-1049. DOI:10.1007/s00277-012-1415-4 (  0) 0) |
| [17] |
黄小航, 陈静, 李本尚, 等. 急性B淋巴细胞白血病患儿IKZFI编码蛋白IKAROS异常表达研究[J]. 中国当代儿科杂志, 2013, 15(9): 743-747. DOI:10.7499/j.issn.1008-8830.2013.09.008 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


