川崎病(Kawasaki disease)是一种涉及全身中小血管的免疫相关性血管炎综合征,未治疗患儿20%~25%合并冠状动脉损害(coronary artery lesion, CAL),已成为儿童获得性心脏病的首要病因。该病至今病因未明,发病机制尚不明确[1]。近年的研究显示,脂肪细胞可产生、分泌100多种因子,其中脂联素(adiponectin)为研究热点之一,其在抗炎及心血管保护方面起重要作用[2]。已证实,脂联素多个位点基因多态性与冠心病的发病密切相关[3],其中以+45和+276位点的基因多态性研究较多。有研究显示血清脂联素增加与CAL的发生关系密切[4],但脂联素基因多态性与川崎病的关系的研究目前尚未见报道。本研究采用基因测序技术检测川崎病患儿脂联素基因+45T/G和+276G/T多态性,以探讨脂联素基因+45T/G和+276G/T多态性与川崎病及CAL发生的关系。
1 资料与方法 1.1 研究对象选取2014年1月至2016年12月在我院住院的川崎病患儿81例为病例组。川崎病及CAL的诊断采用《诸福棠实用儿科学》的诊断标准[5]。病例组中位年龄1.4岁(范围:3个月至6岁);男49例,女32例。另取同期在我院体检的健康儿童100例为正常对照组,均排除既往川崎病、肥胖、糖尿病等疾病史,体格检查、肝肾功能、尿常规等检查结果均正常。对照组中位年龄1.5岁(范围:4个月至6岁);男65例,女35例。病例组与对照组年龄、性别比较差异无统计学意义(P > 0.05)。病例组根据是否合并CAL,分为CAL组和冠状动脉正常组(非CAL组)。CAL组11例,均为轻度冠状动脉扩张,中位年龄1.0岁(范围:8个月至6岁);男8例,女3例。非CAL组70例,中位年龄1.45岁(范围:3个月至6岁);男47例,女23例。CAL组与非CAL组年龄、性别比较差异无统计学意义(P > 0.05)。对照组、病例组人群脂联素基因+45和+276基因型分布均符合Hardy-Weinberg遗传平衡定律(P > 0.05),表明选取的研究对象具有群体代表性。
1.2 DNA提取本研究获得我院伦理委员会批准,征得研究对象监护人知情同意后,取外周静脉血3 mL,经2 000 rpm离心分离后,使用全血基因组DNA提取试剂盒(上海生工生物工程有限公司,SK8224)提取DNA。采用紫外分光光度仪测定DNA的纯度及含量,A260/A280在1.7~2.0之间,计算产物浓度。4℃冰箱过夜,DNA保存于-80℃冰箱备用。
1.3 引物设计及PCR扩增利用Primer Premier 5.0分别设计两对引物,委托生工生物工程(上海)股份有限公司合成。脂联素基因+45及+276位点体外扩增所用引物如下:正向引物为5'-TCTCTCCATGGCTGACAGTG-3',反向引物为5'-AGATGCAGCAAAGCCAAAGT-3',片段大小为467 bp。PCR反应体系(25 μL):样本DNA 1 μL,正反向引物各0.5 μL,dNTP 10 mM 0.5 μL,Taq Buffer 2.5 μL,Taq酶5 U/μL 0.2 μL,蒸馏水20 μL。PCR反应条件:95℃预变性3 min;94℃变性30 s,58℃退火30 s,72℃延伸30~60 s,共35个循环;72℃终末延伸10 min。PCR产物经1.5%琼脂糖凝胶电泳分析,确定为目的产物。
1.4 基因分型PCR产物20 μL由生工生物工程(上海)股份有限公司测序。测序步骤:(1)制备样本(过膜或切胶);(2)双脱氧链终止法进行PCR扩增;(3)用3730xl DNA Analyzer测序仪测序,输出结果。
1.5 统计学分析采用SPSS 16.0软件进行统计学分析。非正态分布计量资料以中位数(范围)表示,两组间比较采用Kruskal-Wallis秩和检验;基因型频率及等位基因频率分布用百分率(%)表示,组间比较采用列联表χ2检验或Fisher精确概率检验;利用Hardy-Weinberg遗传平衡定律检验病例组及对照组是否具有群体代表性。P < 0.05表示差异有统计学意义。
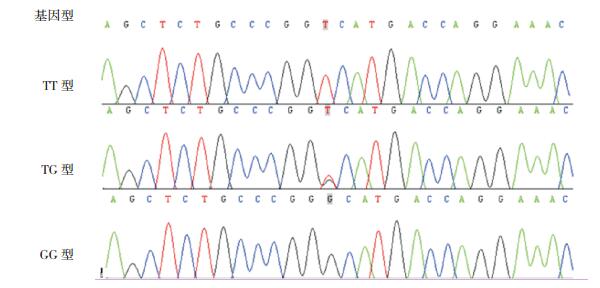
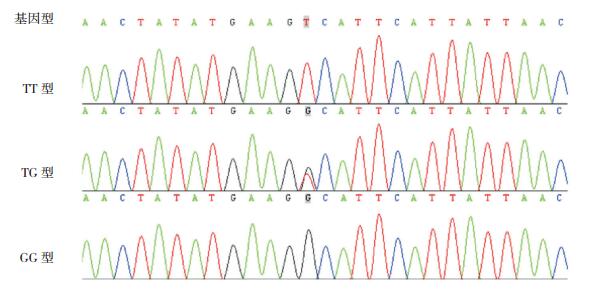
2 结果 2.1 PCR产物测序结果采用PCR产物纯化回收试剂盒(生工B518131),通过NCBI数据库查询得rs2241766(人脂联素基因+45T/G)基因序列CTCTGCCCGGKCA-TGACCAGG,测序结果出现3种基因型,即TT、TG和GG,见图 1。通过NCBI数据库查询得rs1501299(人脂联素基因+276G/T)基因序列CTATATGAAG GCATTCATTATTAAC,测序结果出现3种基因型,即TT、TG和GG,见图 2。
|
图 1 rs2241766(人脂联素基因+45T/G)基因型 测序结果出现3种基因型,即TT、TG和GG。 |
|
图 2 rs1501299(人脂联素基因+276G/T)基因型 测序结果出现3种基因型,即TT、TG和GG。 |
脂联素基因+45位点TT、TG、GG基因型频率及T、G等位基因频率在病例组和对照组之间进行比较,差异无统计学意义(P > 0.05),见表 1。
| 表 1 两组儿童脂联素基因+45T/G多态性分布 [例(%)] |
|
|
+276位点基因型频率TT、TG、GG及T、G等位基因频率在病例组和对照组之间进行比较差异有统计学意义(P < 0.05),见表 2。其中病例组+276位点GG基因型为川崎病发病的危险因素(OR=2.313,95%CI:1.250~4.233,P=0.006),TG基因型为川崎病发病的保护因素(OR=0.542,95%CI:0.295~0.993,P=0.046),T等位基因为川崎病发病的保护因素(OR=0.485,95%CI:0.294~0.801,P < 0.001),见表 2。
| 表 2 两组儿童脂联素基因+276G/T多态性分布 [例(%)] |
|
|
脂联素基因+45位点TT、TG、GG基因型频率及T、G等位基因频率在CAL和非CAL两组间的差异均无统计学意义(P > 0.05)(表 3)。+276位点TT、TG、GG基因型频率及T、G等位基因频率在两组间的差异亦无统计学意义(P > 0.05)(表 4)。
| 表 3 CAL组与非CAL组脂联素基因+45T/G多态性分布 |
|
|
| 表 4 CAL组与非CAL组脂联素基因+276G/T多态性分布 [例(%)] |
|
|
目前认为,川崎病是因免疫活化引发炎症风暴,从而导致血管内皮损伤[6]。近年来川崎病患儿有增加的趋势,亚洲人群发病率最高[7]。文献报道川崎病有一定的遗传学背景,已发现一些基因的单核苷酸多态性(SNP)与川崎病发生及并发CAL有关[1, 8]。脂肪细胞因子与炎症及免疫关系密切,其中脂联素主要由脂肪细胞特异性分泌的一种保护性细胞因子,具有调节脂质及葡萄糖代谢、抗炎、心血管保护、抗细胞凋亡等多种生物学效应。川崎病急性期脂联素水平明显降低,血清脂联素水平变化可能参与了川崎病全身炎症反应及CAL的发生,脂联素或可以作为川崎病等全身免疫炎症反应疾病的预测因子[4, 9]。目前脂联素与川崎病易感性有关的研究甚少,本研究发现脂联素基因+276多态性可能与川崎病的发生相关。
人类脂联素基因定位于3q27,全长17 kb,包含3个外显子和2个内含子,其中+45位点(外显子2)T/G多态性和+276位点(内含子2)G/T多态性的研究最多,已确定其与代谢综合征和炎症相关的疾病关系密切。Gupta等[10]和Peters等[11]对成人非酒精性脂肪肝及代谢综合征病人的研究显示,脂联素基因多态性能改变炎症因子浓度及脂联素血清学水平;另外,脂联素+45及+276基因多态性通过影响脂肪酸浓度改变全身系统性炎症状态[12]。有报道类风湿性关节炎与脂联素密切相关[13],脂联素可影响关节炎症及疾病活动,但脂联素基因+45位点及+276位点多态性在泰国及西班牙人群膝关节炎中无显著性差异[14-15]。本研究显示脂联素基因+276位点G/T多态性与川崎病发病相关,其中GG基因型可增加川崎病的发病风险,T等位基因及TG基因型为川崎病发病的保护因素;而+45位点G/T多态性与川崎病发病无关。在川崎病患儿中脂联素基因多态性是否能改变炎症因子浓度及脂联素血清学水平需进一步研究。
川崎病的主要危害为并发CAL。研究发现25%未治疗的川崎病及5%经静脉注射免疫球蛋白治疗的患儿在成年后将会出现冠状动脉瘤[16-17],提示川崎病患儿成年后患冠心病的风险较无川崎病病史的人群高。因此早期识别川崎病患儿是否出现CAL,以及探讨易感CAL的预测指标非常必要。大量研究表明脂联素基因多态性与冠心病密切相关。在汉族人群中脂联素基因+276位点T等位基因多态性能降低冠心病的发病率[18]。Cheung等[19]选取了9个潜在功能相关的脂联素SNP,发现+276位点可作为冠心病发展的独立预测因子,低脂联素水平可能受脂联素+276G/T多态性影响,患冠心病的风险更高。张闽等[3]对汉族人群的研究及一项新的Meta[20]分析显示,脂联素基因+45位点与冠心病的发生相关,而脂联素基因+276位点与冠心病的发生无关。本研究发现,脂联素基因+276位点及+45位点多态性与川崎病患儿CAL的发生均无关。但由于本研究样本量较少,脂联素基因+276及+45位点多态性与川崎病患儿CAL的关系有待扩大样本量进一步分析。
综上所述,本研究发现脂联素基因+276位点的多态性与川崎病的易感性相关,其GG基因型增加川崎病发病的风险,而T等位基因及TG基因型为川崎病发病的保护因素。由于本研究样本量偏小,存在一定的局限性,需进一步扩大样本作深入探讨。
| [1] |
McCrindle BW, Rowley AH, Newburger JW, et al. Diagnosis, treatment, and long-term management of Kawasaki disease:a scientific statement for health professionals from the American Heart Association[J]. Circulation, 2017, 135(17): e927-e999. DOI:10.1161/CIR.0000000000000484 (  0) 0) |
| [2] |
Villarreal-Molina MT, Antuna-Puente B. Adiponectin:antiinflammatory and cardioprotective effects[J]. Biochimie, 2012, 94(10): 2143-2149. DOI:10.1016/j.biochi.2012.06.030 (  0) 0) |
| [3] |
张闽, 彭瑜, 吕树铮. 脂联素基因多态性与早发心肌梗死的相关性研究[J]. 中华心血管病杂志, 2016, 44(7): 577-582. (  0) 0) |
| [4] |
黄秒, 董国庆, 蒋红英, 等. 川崎病患儿血清脂联素水平的变化[J]. 中国当代儿科杂志, 2015, 17(1): 35-39. DOI:10.7499/j.issn.1008-8830.2015.01.008 (  0) 0) |
| [5] |
杜忠东, 梁翊常. 皮肤黏膜淋巴结综合征[M]//胡亚美, 江载芳. 诸福棠实用儿科学. 第7版. 北京: 人民卫生出版社, 2002: 778-788.
(  0) 0) |
| [6] |
Denby KJ, Clark DE, Markham LW. Management of Kawasaki disease in adults[J]. Heart, 2017, 103(22): 1760-1769. DOI:10.1136/heartjnl-2017-311774 (  0) 0) |
| [7] |
Uehara R, Belay ED. Epidemiology of Kawasaki disease in Asia, Europe, and the United States[J]. J Epidemiol, 2012, 22(2): 79-85. DOI:10.2188/jea.JE20110131 (  0) 0) |
| [8] |
Onouchi Y. The genetics of Kawasaki disease[J]. Int J Rheum Dis, 2017, 21(1): 26-30. (  0) 0) |
| [9] |
Kim HJ, Choi EH, Kil HR. Association between adipokines and coronary artery lesions in children with Kawasaki disease[J]. J Korean Med Sci, 2014, 29(10): 1385-1390. DOI:10.3346/jkms.2014.29.10.1385 (  0) 0) |
| [10] |
Gupta AC, Misra R, Sakhuja P, et al. Association of adiponectin gene functional polymorphisms (-11377C/G and +45T/G) with nonalcoholic fatty liver disease[J]. Gene, 2012, 496(1): 63-67. DOI:10.1016/j.gene.2011.12.023 (  0) 0) |
| [11] |
Peters KE, Beilby J, Cadby G, et al. A comprehensive investigation of variants in genes encoding adiponectin (ADIPOQ) and its receptors (ADIPOR1/R2), and their association with serum adiponectin, type 2 diabetes, insulin resistance and the metabolic syndrome[J]. BMC Med Genet, 2013, 14: 15. (  0) 0) |
| [12] |
Maintinguer Norde M, Oki É, de Castro IA, et al. Influence of adiponectin gene variants and plasma fatty acids on systemic inflammation state association-A cross-sectional population-based study, São Paulo, Brazil[J]. Mol Nutr Food Res, 2016, 60(2): 278-286. DOI:10.1002/mnfr.v60.2 (  0) 0) |
| [13] |
曾婷, 施丹, 顾科峰, 等. 类风湿性关节炎患者脂联素水平与动脉粥样硬化的相关性[J]. 中华老年心脑血管病杂志, 2016, 18(2): 161-164. (  0) 0) |
| [14] |
Zhan D, Thumtecho S, Tanavalee A, et al. Association of adiponectin gene polymorphisms with knee osteoarthritis[J]. World J Orthop, 2017, 8(9): 719-725. DOI:10.5312/wjo.v8.i9.719 (  0) 0) |
| [15] |
Rodríguez-Rodríguez L, García-Bermúdez M, González-Juanatey C, et al. Lack of association between ADIPOQ rs266729 and ADIPOQ rs1501299 polymorphisms and cardiovascular disease in rheumatoid arthritis patients[J]. Tissue Antigens, 2011, 77(1): 74-78. DOI:10.1111/tan.2011.77.issue-1 (  0) 0) |
| [16] |
Daniels LB, Tjajadi MS, Walford HH, et al. Prevalence of Kawasaki disease in young adults with suspected myocardial ischemia[J]. Circulation, 2012, 125(20): 2447-2453. DOI:10.1161/CIRCULATIONAHA.111.082107 (  0) 0) |
| [17] |
Daniels LB, Gordon JB, Burns JC. Kawasaki disease:late cardiovascular sequelae[J]. Curr Opin Cardiol, 2012, 27(6): 572-577. DOI:10.1097/HCO.0b013e3283588f06 (  0) 0) |
| [18] |
Zhang BC, Li WM, Xu YW. A meta-analysis of the association of adiponectin gene polymorphisms with coronary heart disease in Chinese Han population[J]. Clin Endocrinol (Oxf), 2012, 76(3): 358-364. DOI:10.1111/j.1365-2265.2011.04167.x (  0) 0) |
| [19] |
Cheung CY, Hui EY, Cheung BM, et al. Adiponectin gene variants and the risk of coronary heart disease:a 16-year longitudinal study[J]. Eur J Endocrinol, 2014, 171(1): 107-115. DOI:10.1530/EJE-14-0079 (  0) 0) |
| [20] |
Hou H, Ge S, Zhao L, et al. An updated systematic review and meta-analysis of association between adiponectin gene polymorphisms and coronary artery disease[J]. OMICS, 2017, 21(6): 340-351. DOI:10.1089/omi.2017.0007 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


