人巨细胞病毒(human cytomegalovirus, HCMV)感染多发生在婴儿期,可引起多脏器损伤,如进行性肝损害、胆道梗阻或胆道闭锁、听力障碍等,以肝损害较多见[1]。体液免疫、细胞免疫及炎症因子与HCMV肝炎的发生发展密切相关[2-3]。CD4+CD25+调节性T淋巴细胞(regulatory T cell, Treg)是介导免疫耐受的重要细胞群,在病毒性肝炎、自身免疫性肝炎等肝脏疾病的发病机制中起着重要作用。IL-17、IL-27在固有免疫和适应性免疫中起调节作用,还可抑制CD4+CD25+Treg表达,共同参与肝脏炎症反应[4-5]。HLA-DR是单个核细胞活化的重要标志,可作为判断免疫抑制的重要指标,在自身免疫性肝炎、重症感染的发生机制中均有重要作用[6]。但这些细胞及细胞因子是否与HCMV感染患儿肝损害发生相关尚不清楚。因此,本研究通过比较是否合并肝损害的HCMV感染患儿CD4+CD25+Treg、HLA-DR及IL-17、IL-27的表达差异,探索HCMV感染肝损害的可能发病机制,发现巨细胞病毒肝炎治疗的潜在靶点。
1 资料与方法 1.1 研究对象以2016年1月至2017年12月徐州医科大学附属儿科医院确诊的1岁以内(不包括新生儿)的巨细胞病毒感染、且未进行规范抗病毒治疗的患儿为研究对象。根据肝功能损害的诊断标准[7],将HCMV感染患儿分为肝功能损害组及非肝功能损害组,每组21例。两组在年龄、性别构成以及巨细胞病毒DNA含量的差异无统计学意义(P > 0.05),见表 1。HCMV感染肝损组男13例、女8例,年龄为2~10(5.9±2.4)个月,表现为单纯肝功能损害的12例,合并肺炎7例,合并上呼吸道感染2例;而非肝损组男14例、女7例,年龄(5.3±2.7)个月,表现为无症状感染的10例,合并肺炎的8例,合并上呼吸道感染的3例。巨细胞病毒感染诊断依据《儿童巨细胞病毒性疾病诊断和防治的建议》[8],尿液聚合酶链式反应巨细胞病毒DNA阳性,均无胆道畸形、代谢性肝病、药物中毒性肝炎等;肝炎病毒、EB病毒、呼吸道病毒等常见病毒均阴性。肝损害诊断标准[7]:血清丙氨酸转氨酶或结合胆红素升高至正常上限2倍以上;或血清天冬氡酸转氨酶、碱性磷酸酶和总胆红素同时升高,且其中至少1项升高至正常上限2倍以上。
| 表 1 HCMV感染患儿肝损组与非肝损组的一般资料比较 |
|
|
本研究获医院临床伦理委员会批准及家长知情同意。
1.2 主要试剂及仪器PE-CD4抗体、FITC-CD25抗体、PerCP/Cy5.5-HLA-DR抗体购自美国Biolegend公司;抗人IL-17、IL-27 ELISA试剂盒购自徐州康美生物科技有限公司;FC500型流式细胞仪(法国Beckman Coulter公司)由我院中心实验室提供。
1.3 流式细胞仪检测CD4+CD25+Treg、HLA-DR细胞含量清晨空腹采集患儿外周血2 mL,EDTA抗凝,加入2 mL淋巴细胞分离液,密度梯度离心提取单个核细胞置于离心管,加入2 mL磷酸盐缓冲液(PBS)洗涤2次,弃上清液,分别加入相应的荧光标记抗体:PE-CD4抗体、FITC-CD25抗体或PerCP/Cy5.5-HLA-DR抗体,室温下震荡混匀,避光孵育约20 min;加入PBS 2 mL,1 500 r/min离心5 min,弃上清,再次加入PBS液,重复以上步骤后离心,弃上清,加PBS重悬细胞,取200 μL细胞进行流式细胞学检测,以CellQuest软件计算CD4+CD25+Treg、HLA-DR细胞的表达。
1.4 ELISA方法检测IL-17、IL-27水平所有患儿均清晨空腹采集外周血2 mL,EDTA抗凝,加入2 mL淋巴细胞分离液,1 500 r/min离心15 min,吸取血浆分装于EP管,-80℃冰箱冻存。应用IL-17、IL-27 ELISA试剂盒,采用酶联免疫吸附法检测IL-17、IL-27水平,操作按试剂盒说明书进行,并通过标准曲线计算IL-17、IL-27浓度。
1.5 统计学分析采用SPSS 16.0软件进行数据处理。正态分布的计量资料采用均数±标准差(x±s)表示,两组比较采用独立样本t检验;非正态分布计量资料采用中位数范围表示,两组比较采用Mann-Whitney U非参数检验。采用Pearson相关分析法对各项参数的相关性进行分析。P < 0.05为差异有统计学意义。
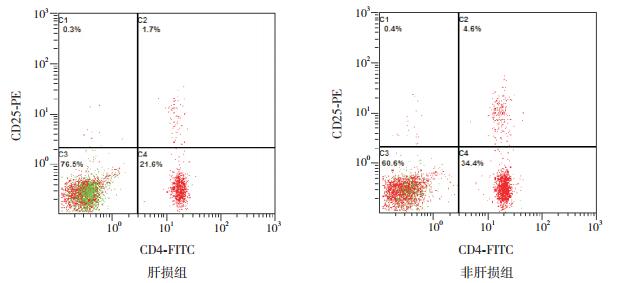
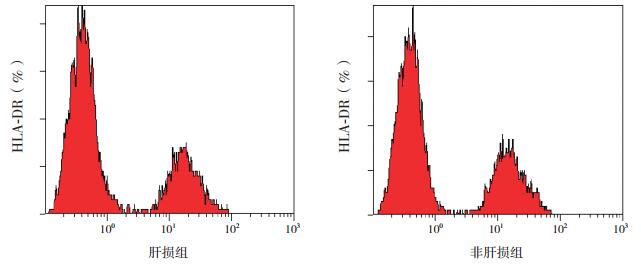
2 结果 2.1 两组HLA-DR、CD4+CD25+Treg、IL-17及IL-27的表达水平比较与HCMV感染非肝损组比较,肝损组Treg表达减低,IL-17、IL-27表达增高(P < 0.05),两组间HLA-DR水平的差异无统计学意义(P > 0.05)。见表 2、图 1~2。
| 表 2 HCMV感染患儿肝损组与非肝损组HLA-DR、CD4+CD25+Treg、IL-17及IL-27水平比较 (x±s) |
|
|
|
图 1 HCMV感染患儿外周血CD4+CD25+Treg细胞的表达 HCMV感染肝损组的Treg细胞表达(右上象限区域代表Treg细胞表达)低于非肝损组。 |
|
图 2 HCMV感染肝损与非肝损患儿外周血HLA-DR的表达 第二波形区域即为HLA-DR细胞阳性表达区域。 |
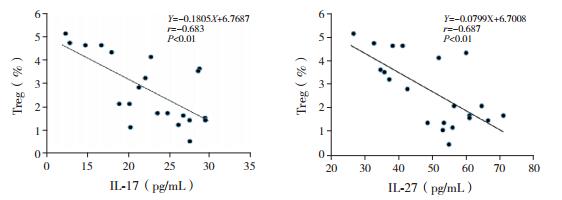
Pearson相关分析显示,HCMV感染肝损患儿外周血IL-17、IL-27水平与CD4+CD25+Treg表达呈负相关,P < 0.05。见图 3。
|
图 3 HCMV感染肝损患儿外周血IL-17、IL-27水平与Treg表达的相关性分析 |
HCMV感染可引起多脏器损伤,尤其以肝损害多见。目前HCMV感染肝损发生机制仍未完全明确,研究表明HCMV并不直接损伤肝细胞,感染后的免疫炎症反应可能是HCMV感染肝细胞损伤的重要因素[3]。
CD4+CD25+Treg细胞具有突出的免疫负调控作用,与感染性疾病关系密切,是维持机体免疫耐受的重要调控者[9]。有研究发现:CMV感染急性期Treg细胞比率下降,而恢复期Treg细胞比例增多[10]。郭声等[11]发现,乙肝患者Treg细胞表达随着肝损加重而降低,表明Treg细胞能抑制炎症反应、减轻肝细胞损伤。郭荻等[12]在自身免疫性肝炎患者中证明,Treg细胞表达下降与肝损进展密切相关。本研究中巨细胞病毒感染肝损组的CD4+CD25+Treg细胞表达较非肝损组明显降低,与文献相符。
IL-17由Thl7细胞产生,可刺激巨噬细胞、成纤维细胞、内皮细胞释放多种炎性细胞因子,从而促进炎症发生;IL-17的水平可反映Th17细胞的功能状态[13]。Zhang等[14]发现慢性乙肝患者血清和肝组织的IL-17与HBV-DNA、ALT水平呈正相关,提示IL-17参与了肝脏炎症反应,诱导炎症环境下肝脏的病理损伤。另一项研究表明,HCMV肝炎肝组织IL-17的表达强度与肝脏纤维化程度密切相关[15]。而Th17细胞与Treg细胞相互抑制、相互拮抗,抑制免疫耐受,导致免疫失衡[16-17]。本研究HCMV感染肝损组患儿的血浆IL-17明显高于非肝损组,并且IL-17与Treg细胞表达呈负相关,与文献相符,表明Th17细胞介导肝脏免疫反应增强,Th17细胞与Treg细胞相互拮抗促进HCMV感染患儿肝损害发生。
IL-27是IL-6/IL-12细胞因子家族成员之一,是抗原提呈细胞分泌的促炎因子。IL-27可以增强Th1型免疫反应,抑制Th2型免疫反应,诱导B细胞分化,促进辅助性T细胞分化,增强杀伤性T淋巴细胞活性,增强抗病毒作用[18-19]。IL-27还能抑制Treg细胞分化,减少Treg细胞数量,抑制其免疫调节作用[20]。有研究发现,慢性乙肝患者IL-27增高程度与肝损坏的严重程度正相关,IL-27促进乙肝病毒清除的同时可以增强肝脏的炎症反应[21]。本研究HCMV感染肝损患儿血浆IL-27水平高于非肝损组,而且表达水平与Treg细胞表达呈负相关,提示IL-27抑制Treg细胞分化,导致免疫耐受失衡、肝脏炎症反应增强,促使肝损发生。
HLA-DR作为单个核细胞活化的重要标志,与抗原提呈能力直接相关。HLA-DR的表达是判断免疫抑制的重要指标。有研究发现,自身免疫性肝病患者肝组织的HLA-DR表达减少,且其减低程度与转氨酶增高密切相关[22-23]。但本研究肝损组HLA-DR表达水平与非肝损组的差异无统计学意义,因此对于HLA-DR与HCMV感染肝损的关系还有待进一步研究。
综上所述,CD4+CD25+Treg细胞介导的免疫耐受失衡及IL-17、IL-27等炎症因子过度激活可能参与HCMV感染肝功能损害的发生。
| [1] |
卢光全, 李儒贵, 谭华炳, 等. 85例巨细胞病毒感染婴幼儿的临床特征[J]. 中华实验和临床感染病杂志(电子版), 2017(3): 282-286. (  0) 0) |
| [2] |
Zheng Q, Tao R, Gao H, et al. HCMV-encoded UL128 enhances TNF-α and IL-6 expression and promotes PBMC proliferation through the MAPK/ERK pathway in vitro[J]. Viral Immunol, 2012, 25(2): 98-105. DOI:10.1089/vim.2011.0064 (  0) 0) |
| [3] |
Griffths P, Baraniak I, Reeves M. The pathogenesis of human cytomegalovirus[J]. J Pathol, 2015, 235(2): 288-297. DOI:10.1002/path.4437 (  0) 0) |
| [4] |
Monin L, Gaffen SL. Interleukin 17 family cytokines:Signaling mechanisms, biological activities, and therapeutic implications[J]. Cold Spring Harb Perspect Biol, 2018, 10(4): a028522. DOI:10.1101/cshperspect.a028522 (  0) 0) |
| [5] |
郭月英, 李国忠. 白细胞介素-27研究进展[J]. 中华临床医师杂志(电子版), 2013, 7(21): 131-133. (  0) 0) |
| [6] |
Vester H, Dargatz P, Huberwagner S, et al. HLA-DR expression on monocytes is decreased in polytraumatized patients[J]. Eur Med Res, 2015, 20: 84. DOI:10.1186/s40001-015-0180-y (  0) 0) |
| [7] |
中华医学会肝病学分会药物性肝病学组. 药物性肝损伤诊治指南[J]. 肝脏, 2015, 20(10): 750-762. DOI:10.3969/j.issn.1008-1704.2015.10.002 (  0) 0) |
| [8] |
中华医学会儿科学分会感染学组, 全国儿科临床病毒感染协作组, 《中华儿科杂志》编辑委员会. 儿童巨细胞病毒性疾病诊断和防治的建议[J]. 中华儿科杂志, 2012, 50(4): 290-292. (  0) 0) |
| [9] |
Costantino CM, Baecher-Allan CM, Hafler DA. Human regulatory T cells and autoimmunity[J]. Eur J Immunol, 2008, 38(4): 921-924. DOI:10.1002/(ISSN)1521-4141 (  0) 0) |
| [10] |
李亚男, 周玉峰, 舒赛男, 等. MCMV感染对小鼠脾细胞调节性T细胞比率和Th1/Th2转录因子T-bet/GATA-3表达的影响[J]. 中华医学杂志, 2008, 88(42): 2999-3002. DOI:10.3321/j.issn:0376-2491.2008.42.012 (  0) 0) |
| [11] |
郭声, 程娜, 葛善飞, 等. Th17/Treg平衡在乙型肝炎重症化过程中的作用及临床意义[J]. 中华肝脏病杂志, 2016, 24(5): 341-346. (  0) 0) |
| [12] |
郭荻. CD4+CD25+FOXP3+调节性T细胞在自身免疫性肝炎中的作用研究[D]. 武汉: 华中科技大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10487-1016781361.htm
(  0) 0) |
| [13] |
Hemdan NY, Birkenmeier G, Wichmann G, et al. Interleukin-17-producing T helper cells in autoimmunity[J]. Autoimmun Rev, 2010, 9(11): 785-792. DOI:10.1016/j.autrev.2010.07.003 (  0) 0) |
| [14] |
Zhang JY, Zhang Z, Lin F, et al. Interleukin-17-producing CD4(+) T cells increase with severity of liver damage in patients with chronic hepatitis B[J]. Hepatology, 2010, 51(1): 81-91. DOI:10.1002/hep.23273 (  0) 0) |
| [15] |
吴海沁, 赵娟娟, 李捍卫, 等. 肝硬化患者Th1/Th22失衡特点及其与病程进展的关系[J]. 中华肝脏病杂志, 2017, 25(10): 738-743. DOI:10.3760/cma.j.issn.1007-3418.2017.10.004 (  0) 0) |
| [16] |
Kleinewietfeld M, Hafler DA. The plasticity of human Treg and Th17 cells and its role in autoimmunity[J]. Semin Immunol, 2013, 25(4): 305-312. DOI:10.1016/j.smim.2013.10.009 (  0) 0) |
| [17] |
Lee GR. The balance of Th17 versus Treg cells in autoimmunity[J]. Int J Mol Sci, 2018, 19(3): E370. (  0) 0) |
| [18] |
Villegas-Mendez A, de Souza JB, Lavelle SW, et al. IL-27 receptor signalling restricts the formation of pathogenic, terminally differentiated Th1 cells during malaria infection by repressing IL-12 dependent signals[J]. PLoS Pathog, 2013, 9(4): e1003293. DOI:10.1371/journal.ppat.1003293 (  0) 0) |
| [19] |
Lucas S, Ghilardi N, Li J, et al. IL-27 regulates IL-12 responsiveness of naïve CD4+ T cells through Stat1-dependent and -independent mechanisms[J]. Proc Natl Acad Sci U S A, 2003, 100(25): 15047-15052. DOI:10.1073/pnas.2536517100 (  0) 0) |
| [20] |
Hall AO, Beiting DP, Tato C, et al. The cytokines interleukin 27 and interferon-γ promote distinct Treg cell populations required to limit infection-induced pathology[J]. Immunity, 2012, 37(3): 511-523. DOI:10.1016/j.immuni.2012.06.014 (  0) 0) |
| [21] |
左维泽, 张丽丽. 乙型肝炎患者血清IL-27的检测及其意义[J]. 世界华人消化杂志, 2009, 17(3): 333-335. (  0) 0) |
| [22] |
Antoniades CG, Khamri W, Abeles RD, et al. Secretory leukocyte protease inhibitor:a pivotal mediator of antiinflammatory responses in acetaminophen-induced acute liver failure[J]. Hepatology, 2014, 59(4): 1564-1576. DOI:10.1002/hep.26933 (  0) 0) |
| [23] |
杨洋, 冷静, 彭丽珊, 等. 慢性HBV感染者CD8+T细胞CD95、CD38、HLA-DR表达的变化和意义[J]. 广东医学, 2016, 37(20): 3043-3045. DOI:10.3969/j.issn.1001-9448.2016.20.016 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


