2. 徐州医科大学附属医院儿科, 江苏 徐州 221000
肥胖作为一种慢性代谢性疾病,已经成为全球关注的健康问题。随着经济的发展,人类生活水平的提高,人们的饮食结构和生活方式发生了很大的改变,儿童肥胖在全球呈现一种逐年增加的趋势,引起全世界的关注。研究表明,肥胖严重影响了儿童的身心健康,也导致了成人疾病,如2型糖尿病、心血管系统疾病、部分恶性肿瘤等在儿童身上提前发生或发病率增加[1-2]。而肥胖不仅仅是脂肪组织的堆积这么简单,它伴随着一种慢性低度炎症反应,称之为“代谢性炎症反应”[3]。这种代谢性炎症反应可以通过Toll样受体途径引发[4]。脂氧素A4(LXA4)作为花生四烯酸的代谢产物[5],是第一个被发现的具有广泛抗炎、促炎症消退功能的内源性脂质介质,被誉为炎症反应的“刹车信号”[6]。脂多糖(LPS)是革兰氏阴性细菌细胞壁上的重要成分,它对宿主是有毒性的,只有当细菌死亡溶解或用人工方法破坏细菌细胞后才释放出来,所以也叫做内毒素。Toll样受体4(TLR4)的激活方式就是与革兰氏阴性菌的内毒素受体相结合并启动炎症反应[7]。肿瘤坏死因子受体相关因子6(TRAF6)是TLR4下游信号分子中最重要的一环,在敲除TRAF6基因的小鼠中,TLR4介导的炎症因子及趋化因子明显减少[8]。所以本实验通过观察LXA4处理后的脓毒症大鼠肝脏组织中TLR4和TRAF6及下游炎症因子的表达,探讨LXA4发挥抗炎作用的机制及其保护作用。
1 材料与方法 1.1 实验动物及饲料健康雄性3周龄Sprague-Dawley(SD)大鼠60只,体重30~50 g,购自徐州医科大学实验动物中心[许可证号:SCXK(苏)2010-0003]。普通饲料购自徐州医科大学实验动物中心;高脂饲料委托徐州医科大学实验动物中心加工(10.0%猪油、5.0%蛋黄、2.0%胆固醇、0.2%丙基硫氧嘧啶、0.2%胆盐和82.6%普通饲料)。
1.2 主要试剂及仪器LXA4(美国Cayman公司)、LPS(美国Sigma公司)、大鼠IL-6、TNF-α ELISA试剂盒(美国eBioscience公司)、兔抗人多克隆抗体TLR4(100 KD)(美国Abcam公司)、兔抗人多克隆抗体TRAF6(60 KD)(武汉三鹰生物技术有限公司),小鼠单克隆抗体β-actin(42 KD)、辣根过氧化物酶标记羊抗小鼠二抗及HRP标记羊抗兔二抗(武汉博士德生物工程有限公司),TRIzol(北京Aidlab公司),总RNA提取试剂盒及实时荧光定量PCR试剂盒(北京TIANGEN公司)。离心机(湖南湘仪实验室仪器开发有限公司)、酶标仪(美国Thermo公司)、电泳器材(北京六一仪器厂)、实时荧光定量PCR仪(美国Illumina公司)。
1.3 动物模型制备及分组60只SD大鼠随机分为两组(n=30)。一组给予普通饲料喂养,另一组给予高脂饲料喂养。饲养6周后(大鼠9周龄时),过夜禁食12 h,分别予以称重并测量身长,计算Lee's指数= ³√[体重(g)×1 000/身长(cm)]。以高脂饲料喂养组大鼠体重超过普通饲料喂养组大鼠平均体重的20%作为肥胖大鼠[9]。分别将造模成功的30只肥胖大鼠以及30只普通大鼠依据随机数字表法分成对照组、脓毒症组和脂氧素干预组(n=10)。脓毒症组予LPS 3 mg/kg腹腔注射制备脓毒症模型[10];脂氧素干预组予LPS 3 mg/kg腹腔注射后予LXA4 10 μg/kg对侧腹腔注射[11-12];对照组予等量生理盐水腹腔注射。各组大鼠观察12 h,未达到观察时间点而死亡大鼠予以剔除。
1.4 标本采集每组各10只大鼠实验结束时均存活,每组随机选取8只大鼠用于后续实验。各组大鼠予10%水合氯醛0.3 mL/100 g腹腔注射麻醉,心脏取血留取血清,打开腹腔剪取肝脏组织,PBS液冲洗后部分置于4%多聚甲醛溶液中固定,部分储存于-80℃冰箱,用于Western blot和RT-PCR实验。
1.5 ELISA法检测大鼠血清IL-6和TNF-α的水平将各组大鼠心脏取血经2 000 r/min离心20 min,取得血清后,使用IL-6和TNF-α的ELISA试剂盒,按说明书操作检测IL-6、TNF-α水平,使用酶标仪在450 nm处读取数据,绘制标准曲线,并依据此计算IL-6、TNF-α浓度。
1.6 实时荧光定量PCR检测大鼠肝脏组织中TLR4和TRAF6 mRNA的表达水平从Home-Gene-NCBI中查找并获得目的基因序列,利用引物及探针设计软件Primer Premier 5.0设计,获得上下游引物序列。同时经过NCBI-Blast分析,引物序列具有较高的特异性。委托北京擎科生物技术有限公司合成。β-actin作为内参对照。具体引物序列及目的基因扩增产物大小见表 1。
| 表 1 引物序列及相关参数 |
|
|
采用TRIzol法提取肝脏组织总RNA,逆转录形成cDNA后,10倍稀释进行实时荧光定量PCR反应。实时荧光定量PCR反应体系(20 μL):cDNA(10×)4 μL,上下游引物(100 μmol/L)各0.4 μL,SYBR Green/Florurscein qPCR Master Mix(2×)10 μL,ddH2O 5.2 μL。反应条件:50℃ 2 min,95℃ 10 min;95℃ 30 s,60℃ 30 s,40个循环。绘制溶解曲线,最终数据以2-△△Ct法分析基因相对表达量。
1.7 Western blot检测大鼠肝脏组织TLR4和TRAF6蛋白的表达水平将大鼠肝脏组织从-80℃冰箱中取出,充分匀浆及裂解后4℃下以12 000 r/min离心10 min,取上清,用BCA蛋白浓度测定试剂盒测定蛋白浓度。取蛋白提取液样品,加上样缓冲液100℃煮沸10 min变性,进行SDS-PAGE凝胶电泳,将蛋白转移至PVDF膜。转膜后用封闭液稀释相应的一抗4℃孵育过夜(β-actin稀释比例为1 : 200,TRAF6、TLR4稀释比例为1 : 500)。PBS-T洗膜后加入辣根过氧化物酶标记的二抗(稀释比例为1 : 50 000),37℃摇床孵育2 h。ECL显色、拍照,用Image J图像分析系统对蛋白条带进行分析,结果以目的蛋白与内参蛋白的灰度值比值表示相对表达量。
1.8 统计学分析采用SPSS 16.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,两组间比较采用两样本t检验;多组间比较采用随机配伍的两因素3×2析因设计资料的方差分析,饮食因素两水平,给药因素三水平,总处理组为6=3×2,多重比较采用SNK-q检验,P < 0.05为差异有统计学意义。
2 结果 2.1 两组大鼠体重及Lee's指数变化饲养至9周龄时,测得各组大鼠体重及身长,计算Lee's指数。结果显示高脂饮食组平均体重和Lee's指数高于普通饮食组(P < 0.05),见表 2。
| 表 2 两组大鼠体重及Lee's指数比较 (x±s) |
|
|
不同饮食组大鼠IL-6和TNF-α水平比较差异有统计学意义(P < 0.001),结合均数,肥胖组显著高于普通组。不同给药处理组间IL-6和TNF-α水平比较差异有统计学意义(P < 0.001),结合均数及多重比较结果,脓毒症组较对照组IL-6和TNF-α水平显著升高(P < 0.01),脂氧素组较脓毒症组IL-6和TNF-α水平显著降低(P < 0.01)。见表 3。
| 表 3 各组大鼠血清IL-6及TNF-α水平比较 (x±s,pg/mL,n=8) |
|
|
不同饮食组大鼠TLR4和TRAF6 mRNA水平比较差异有统计学意义(P < 0.001),结合均数,肥胖组显著高于普通组。不同给药处理组间TLR4和TRAF6 mRNA水平比较差异有统计学意义(P < 0.001),结合均数及多重比较结果,脓毒症组较对照组TLR4和TRAF6 mRNA相对表达量显著升高(P < 0.01),脂氧素组较脓毒症组TLR4和TRAF6 mRNA相对表达量显著降低(P < 0.01)。见表 4。
| 表 4 各组大鼠肝脏组织TLR4及TRAF6 mRNA相对表达量比较 (x±s,n=8) |
|
|
不同饮食组大鼠TLR4和TRAF6蛋白水平比较差异有统计学意义(P < 0.05),结合均数,肥胖组显著高于普通组。不同给药处理组间TLR4和TRAF6蛋白水平比较差异有统计学意义(P < 0.001),结合均数及多重比较结果,脓毒症组较对照组TLR4和TRAF6蛋白表达显著升高(P < 0.01),脂氧素组较脓毒症组TLR4和TRAF6蛋白表达显著降低(P < 0.01)。见图 1,表 5。
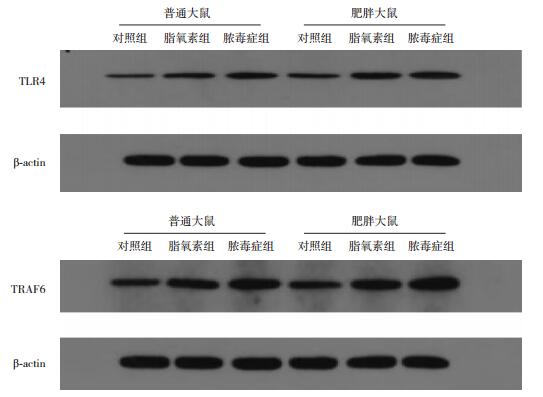
|
图 1 各组大鼠肝脏组织TLR4(上)及TRAF6(下)蛋白电泳图 |
| 表 5 大鼠肝脏组织TLR4和TRAF6蛋白相对表达量比较 (x±s,n=8) |
|
|
近年来人们对肥胖的认识越来越深,越来越多的证据表明肥胖会导致体内炎性因子增多[13]。进一步研究肥胖对感染的影响,探索肥胖患者受感染的防治方法具有重要的临床意义。众多文献对肥胖所造成炎症反应的发病机制进行了研究,许多因素参与其中,而炎症介质的作用不可忽视。脂肪组织作为一个庞大的高度活化的内分泌器官,分泌一系列的炎症介质导致机体慢性炎症反应持续存在[14]。Pal等[15]研究发现,脂肪细胞中存在TLR4的信号通路,LPS作为TLR4主要配体,可以激活TLR4通路,进而激活NF-κB信号通路,启动TNF-α及IL-6细胞因子基因转录,从而诱导炎性细胞激活,诱导炎症发生[7]。
肥胖大鼠的模型有很多种,包括基因敲除大鼠、遗传性肥胖大鼠、食源性肥胖大鼠等,通过与其他大鼠相比,食源性肥胖大鼠其临床和病理表现与人肥胖病程发展相似,所以应用更为广泛。而脓毒症模型的建立以LPS诱导和盲肠结扎穿孔法较为常见。本实验通过给予高脂饲料喂养来建立食源性肥胖大鼠模型,LPS腹腔注射建立大鼠脓毒症模型。
Toll样受体是炎症信号转导的门户蛋白[16],主要参与固有免疫,TLR4是Toll样受体家族中最重要的成员,主要在免疫细胞表面表达[17]。研究表明,肥胖状态下,血清FFA水平升高,可以激活TLR4信号通路诱导炎症反应[18]。TLR4可以通过识别外源性的病原相关的分子模式,主要是革兰氏阴性菌的LPS,并与之结合,通过一系列级联反应,活化下游TRAF6,进而激活NF-κB,导致多种促炎因子的合成和释放。TRAF6作为TLR4信号通路中最重要的一环,发挥了促炎及凋亡的作用。LPS作为TLR4主要配体,激活炎性通路,诱导炎症发生。
在本实验中,通过Western blot和RT-PCR证实了在脓毒症影响下肥胖大鼠肝脏组织TLR4及下游TRAF6水平较普通大鼠明显升高,ELISA检测IL-6和TNF-α水平的升高,证实了炎症的开启和TLR4通路有关。
LXA4是炎症过程中花生四烯酸通过脂质氧合酶途径产生的代谢产物[19],是白细胞三烯的内源性拮抗剂,主要功能是抑制中性粒细胞的趋化反应及黏附于内皮细胞,可能与炎症的消散有关[20],最早是由Serhan等[21]发现。它能够与其G蛋白耦联受体结合,通过多种信号通路下调炎症因子在组织中的表达[22],能够抑制白细胞向炎症部位的趋化,并促进巨噬细胞吞噬凋亡的粒细胞和其他损伤细胞,从而抑制炎症过程促进炎症消散,在炎症感染相关的疾病中发挥特有的抗感染促炎症消退的作用[23]。
有实验证明,LXA4对于LPS诱导的大鼠急性肺损伤,可以使血清IL-1、IL-6和TNF-α水平降低,急性肺损伤得到改善可能与LXA4抑制NF-κB细胞信号传导途径有关[24]。LXA4还能减轻牛磺胆酸诱导的胰腺炎大鼠胰腺组织中细胞间黏附因子-1(ICAM-1)和NF-κBp65的表达[25]。新近研究还发现,LXA4对免疫细胞如DC和T细胞等的功能也有一定的负性调节作用,因而LXA4在感染、自身免疫性疾病等慢性炎症相关性疾病中也能发挥重要的调节作用[26]。LXA4还可以减少脂肪组织内IL-6、TNF-α和CRP的mRNA表达水平,并可有效降低血清炎性因子的浓度,在幼年期代谢综合征(MS)大鼠早期动脉粥样硬化形成过程中起到保护性作用[27]。大量的实验数据已经确立了LXA4和相关的受体具有抗炎和促炎症消退的作用,对感染起到了保护作用。
本实验发现,脂氧素干预下肝脏组织TLR4、TRAF6水平较脓毒症组明显降低,说明LXA4能够抑制脓毒症致肝脏损伤过程中TLR4、TRAF6的表达,提示了LXA4可能抑制TLR4-TRAF6信号通路的激活。此外,ELISA检测的结果提示脂氧素干预组较脓毒症组大鼠血清IL-6、TNF-α下降,由于TLR4通路最终可以导致炎症因子的释放,其机制可能与LXA4能下调TLR4、TRAF6表达有关。
综上所述,LXA4能够降低血清中IL-6、TNF-α水平并且抑制肝脏组织TLR4、TRAF6的表达,对脓毒症引起的肝脏损伤具有保护作用,其机制可能是通过抑制TLR4信号传导途径来实现的。
| [1] |
Juonala M, Magnussen CG, Berenson GS, et al. Childhood adiposity, adult adiposity, and cardiovascular risk factors[J]. N Engl J Med, 2011, 365(20): 1876-1885. DOI:10.1056/NEJMoa1010112 (  0) 0) |
| [2] |
Reilly JJ, Kelly J. Long-term impact of overweight and obesity in childhood and adolescence on morbidity and premature mortality in adulthood:systematic review[J]. Int J Obes (Lond), 2011, 35(7): 891-898. DOI:10.1038/ijo.2010.222 (  0) 0) |
| [3] |
Masoodi M, Kuda O, Rossmeisl M, et al. Lipid signaling in adipose tissue:connecting inflammation & metabolism[J]. Biochim Biophys Acta, 2015, 1851(4): 503-518. DOI:10.1016/j.bbalip.2014.09.023 (  0) 0) |
| [4] |
Cullberg KB, Larsen JØ, Pedersen SB, et al. Effects of LPS and dietary free fatty acids on MCP-1 in 3T3-L1 adipocytes and macrophages in vitro[J]. Nutr Diabetes, 2014, 4: e113. DOI:10.1038/nutd.2014.10 (  0) 0) |
| [5] |
Li Q, Tian Y, Wang ZF, et al. Involvement of the spinal NALP1 inflammasome in neuropathic pain and aspirin-triggered-15-epilipoxin A4 induced analgesia[J]. Neuroscience, 2013, 254: 230-240. DOI:10.1016/j.neuroscience.2013.09.028 (  0) 0) |
| [6] |
Wu R, Zhou W, Chen S, et al. Lipoxin A4 suppresses the development of endometriosis in an ALX receptor-dependent manner via the p38 MAPK pathway[J]. Br J Pharmacol, 2014, 171(21): 4927-4940. DOI:10.1111/bph.12816 (  0) 0) |
| [7] |
Wu H, Zhao G, Jiang K, et al. Plantamajoside ameliorates lipopolysaccharide-induced acute lung injury via suppressing NF-κB and MAPK activation[J]. Int Immunopharmacol, 2016, 35: 315-322. DOI:10.1016/j.intimp.2016.04.013 (  0) 0) |
| [8] |
Guo Z, Hu Q, Xu L, et al. Lipoxin A4 reduces inflammation through formyl peptide receptor 2/p38 MAPK signaling pathway in subarachnoid hemorrhage rats[J]. Stroke, 2016, 47(2): 490-497. DOI:10.1161/STROKEAHA.115.011223 (  0) 0) |
| [9] |
万涛梅, 袁贵强, 王正义, 等. 肥胖对非致死性肺炎小鼠血液生理指标、4种细胞因子和免疫器官指数的影响[J]. 浙江农业学报, 2016, 28(9): 1485-1492. (  0) 0) |
| [10] |
畅怡, 聂秀红, 蔡彦宁, 等. 脓毒血症对大鼠膈肌Glut-1和Glut-4 mRNA表达的影响[J]. 首都医科大学学报, 2010, 31(5): 20-23. (  0) 0) |
| [11] |
辛显芳, 高莉莉, 关凤军, 等. 脂氧素A4干预幼年肥胖大鼠血管内皮功能损伤的作用研究[J]. 中国保健营养(下旬刊), 2013, 23(2): 896-897. (  0) 0) |
| [12] |
Börgeson E, Johnson AM, Lee YS, et al. Lipoxin A4 attenuates obesity-induced adipose inflammation and associated liver and kidney disease[J]. Cell Metab, 2015, 22(1): 125-137. DOI:10.1016/j.cmet.2015.05.003 (  0) 0) |
| [13] |
姜红堃, 李雷, 姜红, 等. 肥胖相关性肾小球病小鼠肿瘤坏死因子α表达的变化[J]. 实用儿科临床杂志, 2012, 27(23): 21-24. (  0) 0) |
| [14] |
Rosenfeld ME. Inflammation and atherosclerosis:direct versus indirect mechanisms[J]. Curr Opin Pharmacol, 2013, 13(2): 154-160. DOI:10.1016/j.coph.2013.01.003 (  0) 0) |
| [15] |
Pal D, Dasgupta S, Kundu R, et al. Fetuin-A acts as an endogenous ligand of TLR4 to promote lipid-induced insulin resistance[J]. Nat Med, 2012, 18(8): 1279-1285. DOI:10.1038/nm.2851 (  0) 0) |
| [16] |
Ma C, Jiang Y, Zhang X, et al. Isoquercetin ameliorates myocardial infarction through anti-inflammation and antiapoptosis factor and regulating TLR4-NF-κB signal pathway[J]. Mol Med Rep, 2018, 17(5): 6675-6680. (  0) 0) |
| [17] |
Jiang K, Guo S, Zhang T, et al. Downregulation of TLR4 by miR-181a provides negative feedback regulation to lipopolysaccharide-induced inflammation[J]. Front Pharmacol, 2018, 9: 142. DOI:10.3389/fphar.2018.00142 (  0) 0) |
| [18] |
刁红杰, 鲁燕. Toll样受体4介导的炎症反应与肥胖和胰岛素抵抗的研究进展[J]. 中国糖尿病杂志, 2016, 24(11): 1044-1048. DOI:10.3969/j.issn.1006-6187.2016.11.19 (  0) 0) |
| [19] |
Börgeson E, McGillicuddy FC, Harford KA, et al. Lipoxin A4 attenuates adipose inflammation[J]. FASEB J, 2012, 26(10): 4287-4294. DOI:10.1096/fj.12-208249 (  0) 0) |
| [20] |
Lv W, Lv C, Yu S, et al. Lipoxin A4 attenuation of endothelial inflammation response mimicking pancreatitis-induced lung injury[J]. Exp Biol Med (Maywood), 2013, 238(12): 1388-1395. DOI:10.1177/1535370213502611 (  0) 0) |
| [21] |
Serhan CN, Hamberg M, Samuelsson B. Lipoxins:novel series of biologically active compounds formed from arachidonic acid in human leukocytes[J]. Proc Natl Acad Sci U S A, 1984, 81(17): 5335-5339. DOI:10.1073/pnas.81.17.5335 (  0) 0) |
| [22] |
Cattaneo F, Parisi M, Ammendola R. Distinct signaling cascades elicited by different formyl peptide receptor 2(FPR2) agonists[J]. Int J Mol Sci, 2013, 14(4): 7193-7230. DOI:10.3390/ijms14047193 (  0) 0) |
| [23] |
邓莉莉, 钟玲, 雷建蓉, 等. 脂氧素A4对横纹肌溶解所致急性肾损伤大鼠肾的保护作用[J]. 细胞与分子免疫学杂志, 2012, 28(9): 15-18. (  0) 0) |
| [24] |
金胜威, 张力, 姚尚龙, 等. 脂氧素A4对内毒素性肺损伤小鼠的保护作用[J]. 中华急诊医学杂志, 2006, 15(11): 7-10. (  0) 0) |
| [25] |
孙洪伟, 汪茂名, 张涛, 等. LXA4对ANP诱发SIRS过程中NF-κB、ICAM-1表达的影响[J]. 医学研究杂志, 2012, 41(3): 30-33. (  0) 0) |
| [26] |
Alvarez AM, Mulla MJ, Chamley LW, et al. Aspirin-triggered lipoxin prevents antiphospholipid antibody effects on human trophoblast migration and endothelial cell interactions[J]. Arthritis Rheumatol, 2015, 67(2): 488-497. DOI:10.1002/art.v67.2 (  0) 0) |
| [27] |
徐会会, 高莉莉, 关凤军, 等. 脂氧素A4干预幼年期大鼠代谢综合征的意义[J]. 中华实用儿科临床杂志, 2016, 31(7): 522-526. (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


