患儿,男,23个月,因抽搐6个月就诊。患儿于17个月时出现抽搐发作,表现为“双眼向左凝视,左上肢抖动”,每次持续1~2 min,视频脑电图示右侧Rolandic区及前颞区棘波、棘慢波,诊断为癫癎,给予左乙拉西坦口服(目前30 mg/kg/d),仍1~2个月发作一次。患儿5个月能抬头,8个月翻身,15个月独坐,目前不能独站,无明确追视、不能分辨熟人,无有意义语言,伴手指刻板行为。患儿系第二胎第一产,足月顺产出生,出生体重3 kg。新生儿期有巨细胞病毒感染史。父母体健,非近亲结婚,患儿出生时母亲27岁、父亲29岁。否认家族遗传病史。
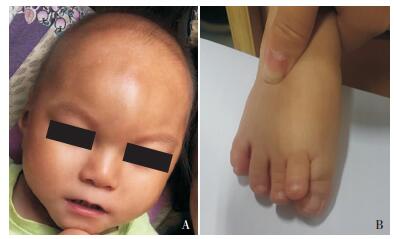
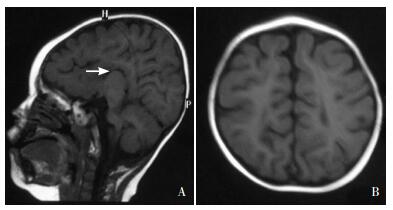
体格检查:身长81 cm(< P3),体重10 kg(P3~P15),头围39.5 cm(< P3)。发稀,表情淡漠,特殊面容(图 1A):前额中部突出,眼裂小、眼距宽、鼻梁略低,口唇薄。四肢肌张力低,膝腱反射可引出。足趾畸形(图 1B)。尿道下裂,阴茎短小。辅助检查:TORCH抗体中巨细胞病毒抗体IgG阳性,余均阴性;血串联质谱及尿气相色谱质谱检测(由金域检验公司完成)未见异常;染色体核型分析:46,XY;头部MRI(图 2)平扫示胼胝体缺如,双侧额、颞、顶叶脑沟深,脑回细。Gesell发育量表评估示各能区重-极重度发育缺陷。
|
图 1 患儿特殊面容(A)和足趾畸形(B) |
|
图 2 头部MRI平扫 A:胼胝体缺如(如箭头所示);B:双侧额、颞、顶叶脑沟深,脑回细。 |
予以患儿行为干预。患儿因“追视差”于眼科就诊,发现眼球及角膜小,晶状体后极部略混浊,眼底检查及视觉诱发电位无异常,诊断为先天性小眼球、小角膜、先天性白内障。
征得监护人知情同意,采集患儿外周静脉血3 mL,采用高通量测序法进行认知与矮小障碍的相关基因(包含RAB3GAP1、RAB3GAP2、RAB18和TBC1D20)检测,由康旭医学检验所完成。利用芯片比较基因组杂交技术(array comparative genomic hybridization, aCGH)检测染色体微小重排(于北京大学第一医院遗传诊断实验室完成)。结果提示,认知与矮小障碍相关基因如RAB3GAP1、RAB3GAP2、RAB18和TBC1D20未发现异常;1号染色体q43-q44有片段缺失,大小9.508 Mb,坐标:chr1: 239604192-249212668。诊断为Warburg-Micro综合征(Warburg-Micro syndrome, WARBM)。
讨论:WARBM综合征于1993年首次报道,是一种罕见的常染色体隐性遗传性疾病,主要特点为小头畸形,先天性白内障,小眼球,小角膜,严重的精神发育迟滞,胼胝体发育不全和生殖器畸形,其他较少见的症状还包括面部畸形、癫癎、脑皮质发育不良、痉挛性四肢瘫、肌张力低下等[1-2]。2013年Handley等[3]对144例文献报道的WARBM综合征患儿进行总结,显示53%是由RAB3GAP1、RAB3GAP2、RAB18基因突变所致。WARBM综合征被分为4型,WARBM 1型是由位于2q21的基因RAB3GAP1发生纯合子突变所致,WARBM 2型因1q41的基因RAB3GAP2发生纯合子突变所致,WARBM 3型是由10p12.1的基因RAB18出现纯合子或复合杂合突变所致[3]。Liegel等[4]发现,20p13的TBC1D20基因纯合子突变也可导致WARBM综合征表型出现,被定义为WARBM4型。
本例患儿表现为小头畸形,先天性白内障、小眼球、小角膜、严重的精神发育迟滞,胼胝体发育不全和生殖器畸形,并伴有面部畸形、癫癎、肌张力低下,符合WARBM综合征的临床特征。但未发现RAB3GAP1、RAB3GAP2、RAB18和TBC1D20基因突变,aCGH结果显示1q43-q44缺失,运用UCSC基因组浏览器(University of California Santa Cruz Genome Browser),将本例与文献[5-8]报道的19例1q43-q44缺失患儿的临床表型进行比较(表 1),本例及Zaki[5]、Arroyo-Carrera[6]、van Bon[7]报道的患者缺失片段均大于7.5 Mb,缺失片段起始点更靠近染色体着丝粒,导致包含致病基因CHRM3、FMN2、GREM2、RGS7、OPN3、CHML在内的上百种基因缺失。本例与其中2例患儿除存在胼胝体异常、精神发育迟滞和特殊面容外,均存在小角膜等眼部发育异常。CHRM3、RGS7、CHML和OPN3基因与G蛋白偶联受体相关,G蛋白偶联受体在脑、视网膜、心脏和肾脏广泛表达。CHRM3编码毒蕈碱型胆碱能受体,属于G蛋白偶联受体家族。Pomper等[9]发现CHRM3可以调节人瞳孔括约肌的自主神经传递。RGS7是G蛋白信号7的调节器,在神经元内高度表达,并在突触囊泡中快速调节神经元兴奋性[10]。CHML基因的表达产物为RAB护送蛋白2(RAB escort protein 2, REP2),REP2蛋白71%的氨基酸残基与CHM基因的编码产物REP-1相同,REP-1、REP-2缺陷均可导致黄斑区视网膜脉络膜萎缩[1-12]。
| 表 1 本例与既往文献报道的19例1q43-q44缺失患儿缺失基因和临床表型比较 |
|
|
此外,REP-2可辅助多种RAB蛋白有效的香叶酰化。RAB蛋白存在于质膜和细胞器膜,是一类小分子GTP结合蛋白(小G蛋白),是RAS超家族中最大的亚家族,在真核细胞囊泡运输和膜运输中起重要调节作用,这种细胞内膜的交通可使多个基因的效应器信号相互联系[13]。RAB3参与了神经递质和激素的胞外调节,其中RAB3A在大脑突触和神经递质囊泡中表达丰富,可以调节钙离子触发的突触小泡的融合。Ruediger等[14]研究表明,RAB3A缺陷的小鼠海马苔藓纤维表达降低,从而前馈抑制增长被解除,导致记忆精确性降低;RAB3B在垂体前叶中有高水平表达,可以调节垂体激素的分泌,特别是与促肾上腺皮质激素和促性腺激素分泌有关[15]。OPN3编码蛋白是G蛋白的超家族成员,通过激活G蛋白和效应酶发挥作用,广泛分布于脑、视网膜、心脏和肾脏。因此,CHRM3、RGS7、CHML和OPN3基因缺失可能导致G蛋白偶联受体功能的异常及垂体分泌激素调节异常,从而导致WARBM综合征患儿眼部及脑发育的异常及身材矮小等症状。
此外,Sanders等[16]发现GREM2在胚胎发育和组织分化过程中可以调节成骨蛋白基因BMPs。因此,本例的足趾畸形可能与BMPs功能改变有关。Petersen等[17]报道1例缺失片段仅包含CHRM3一个致病基因,临床表现为孤独症的1q43微缺失患儿。本例的表情淡漠、手指刻板行为等孤独症样表现是否与CHRM3基因缺失有关,有待进一步研究。本例患儿缺失片段与Zaki[5]及Arroyo-Carrera等[6]报道的类似,但临床表现有差异,提示对于染色体微缺失伴多种畸形的患儿,应考虑到基因功能水平分子通路的相互联系。
综上,本文报道1例1q43-q44缺失所致WARBM综合征患儿,并分析了可能的分子病理学机制,为进一步认识该综合征提供了有益的补充。
| [1] |
Warburg M, Sjö O, Fledelius HC, et al. Autosomal recessive microcephaly, microcornea, congenital cataract, mental retardation, optic atrophy, and hypogenitalism. Micro syndrome[J]. Am J Dis Child, 1993, 147(12): 1309-1312. DOI:10.1001/archpedi.1993.02160360051017 (  0) 0) |
| [2] |
Kabzińska D, Mierzewska H, Senderek J, et al. Warburg micro syndrome type 1 associated with peripheral neuropathy and cardiomyopathy[J]. Folia Neuropathol, 2016, 54(3): 273-281. (  0) 0) |
| [3] |
Handley MT, Morris-Rosendahl DJ, Brown S, et al. Mutation spectrum in RAB3GAP1, RAB3GAP2, and RAB18 and genotype-phenotype correlations in warburg micro syndrome and Martsolf syndrome[J]. Hum Mutat, 2013, 34(5): 686-696. DOI:10.1002/humu.22296 (  0) 0) |
| [4] |
Liegel RP, Handley MT, Ronchetti A, et al. Loss-of-function mutations in TBC1D20 cause cataracts and male infertility in blind sterile mice and Warburg-Micro syndrome in humans[J]. Am J Hum Genet, 2013, 93(6): 1001-1014. DOI:10.1016/j.ajhg.2013.10.011 (  0) 0) |
| [5] |
Zaki MS, Gillessen-Kaesbach G, Vater I, et al. Bladder exstrophy and extreme genital anomaly in a patient with pure terminal 1q deletion:expansion of phenotypic spectrum[J]. Eur J Med Genet, 2012, 55(1): 43-48. DOI:10.1016/j.ejmg.2011.09.003 (  0) 0) |
| [6] |
Arroyo-Carrera I, de Zaldívar Tristancho MS, Bermejo-Sánchez E, et al. Deletion 1q43-44 in a patient with clinical diagnosis of Warburg-Micro syndrome[J]. Am J Med Genet A, 2015, 167(6): 1243-1251. DOI:10.1002/ajmg.a.36878 (  0) 0) |
| [7] |
van Bon BW, Koolen DA, Borgatti R, et al. Clinical and molecular characteristics of 1qter microdeletion syndrome:delineating a critical region for corpus callosum agenesis/hypogenesis[J]. J Med Genet, 2008, 45(6): 346-354. DOI:10.1136/jmg.2007.055830 (  0) 0) |
| [8] |
Nagamani SC, Erez A, Bay C, et al. Delineation of a deletion region critical for corpus callosal abnormalities in chromosome 1q43-q44[J]. Eur J Hum Genet, 2012, 20(2): 176-179. DOI:10.1038/ejhg.2011.171 (  0) 0) |
| [9] |
Pomper JK, Wilhelm H, Tayebati SK, et al. A novel clinical syndrome revealing a deficiency of the muscarinic M3 receptor[J]. Neurology, 2011, 76(5): 451-455. DOI:10.1212/WNL.0b013e31820a0a75 (  0) 0) |
| [10] |
Tayou J, Wang Q, Jang GF, et al. Regulator of G protein signaling 7(RGS7) can exist in a Homo-oligomeric form that is regulated by Gαo and R7-binding protein[J]. J Biol Chem, 2016, 291(17): 9133-9147. DOI:10.1074/jbc.M115.694075 (  0) 0) |
| [11] |
Cai XB, Huang XF, Tong Y, et al. Novel CHM mutations identifed in Chinese families with choroideremia[J]. Sci Rep, 2016, 6: 35360. DOI:10.1038/srep35360 (  0) 0) |
| [12] |
Cremers FP, Armstrong SA, Seabra MC, et al. REP-2, a Rab escort protein encoded by the choroideremia-like gene[J]. J Biol Chem, 1994, 269(3): 2111-2117. (  0) 0) |
| [13] |
Uno T, Furutani M, Watanabe C, et al. Rab proteins in the brain and corpus allatum of Bombyx mori[J]. Histochem Cell Biol, 2016, 146(1): 59-69. DOI:10.1007/s00418-016-1422-y (  0) 0) |
| [14] |
Ruediger S, Vittori C, Bednarek E, et al. Learning-related feedforward inhibitory connectivity growth required for memory precision[J]. Nature, 2011, 473(7348): 514-518. DOI:10.1038/nature09946 (  0) 0) |
| [15] |
Rotondo F, Scheithauer BW, Kovacs K, et al. Rab3B immunoexpression in human pituitary adenomas[J]. Appl Immunohistochem Mol Morphol, 2009, 17(3): 185-188. DOI:10.1097/PAI.0b013e31818fa0ed (  0) 0) |
| [16] |
Sanders LN, Schoenhard JA, Saleh MA, et al. BMP antagonist gremlin 2 limits inflammation after myocardial infarction[J]. Circ Res, 2016, 119(3): 434-449. DOI:10.1161/CIRCRESAHA.116.308700 (  0) 0) |
| [17] |
Petersen AK, Ahmad A, Shafiq M, et al. Deletion 1q43 encompassing only CHRM3 in a patient with autistic disorder[J]. Eur J Med Genet, 2013, 56(2): 118-122. DOI:10.1016/j.ejmg.2012.11.003 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20
