3-羟基异丁酰辅酶A水解酶缺乏症是缬氨酸分解代谢紊乱的罕见病症,由于HIBCH基因突变所致,符合常染色体隐性遗传。临床特征为重度精神运动发育迟缓、神经变性、乳酸水平增高和大脑基底神经节病变等,普遍认为预后不良。目前国外已报道18例,国内仅北京大学第一医院[1]报道1例5岁5个月女性患儿,表现为发育落后、左侧肢体姿势异常,头颅MRI提示双侧基底节对称性病变、脑干病变及小脑萎缩,基因检测发现HIBCH基因复合杂合突变:c.1027C > G(p.H343D)和剪切突变c.79-1G > T,双杂合突变遗传自双亲,家族史及出生史无异常。本文对1例HIBCH基因杂合突变导致的3-羟基异丁酰辅酶A水解酶缺乏症患儿的临床特征、治疗、预后及其遗传学特点进行总结,并结合文献进行讨论,以期为临床医师提高对该病的认识提供帮助。
1 资料与方法 1.1 研究对象患儿,男,1岁6个月,因腹泻8 d、发热7 d、精神运动发育倒退5 d入院。患儿在发热、腹泻之后出现烦躁、嗜睡、易激惹、哭声细弱,阵发性肌张力增高,以及发育倒退:不能竖头、独坐,不能分辨熟人,眼神交流差,追光逐物差。当地医院查头颅CT示两侧内囊区斑片状低密度影。患儿系第3胎、第3产,试管婴儿双胎之小,剖宫产出生,出生胎龄35+2周,出生体重2.43 kg,出生时无窒息史,无产伤史。3个月抬头,8个月独坐,1岁4个月扶走,目前仅能扶走,无意识叫“妈妈”。父母非近亲结婚,父母及一姐姐均体健,母亲第一胎自然流产,其哥哥(双胎之大)生长发育较同龄儿稍落后,大运动发育正常,目前能无意识叫“妈妈”。体格检查:烦躁,嗜睡,追光逐物差,头围48 cm,毛发分布正常,头颅无畸形,右耳前可见小肉赘,皮肤巩膜无黄染。心肺、腹部(-),肢体扭转,四肢肌张力增高,双侧膝腱反射活跃,双侧踝阵挛(+),脑膜刺激征阴性。
辅助检查:血常规WBC 13.3×109/L,余项正常;乳酸脱氢酶322 U/L(参考值:120~250 U/L);乳酸2.2 mmol/L(参考值:1.4~1.9 mmol/l);血气分析、血氨、肝肾功能、电解质、甲状腺功能、铜蓝蛋白、血糖等无异常。脑脊液常规、生化、病原学均无异常。动态心电图:窦性心律不齐。心脏彩超未见异常;血、尿遗传代谢病筛查未见明显异常。脑电图:清醒期、睡眠期在弥漫性低-中波幅1.5~5 Hz的混合慢波、复合多量低波幅快波背景上,可见双侧后头部或弥漫性中-高波幅δ波阵发或连续发放;睡眠期双侧前头部小棘波偶发;发作同期脑电图未见癎样放电。头颅MRI(图 1A)示双侧基底节区信号异常。
|
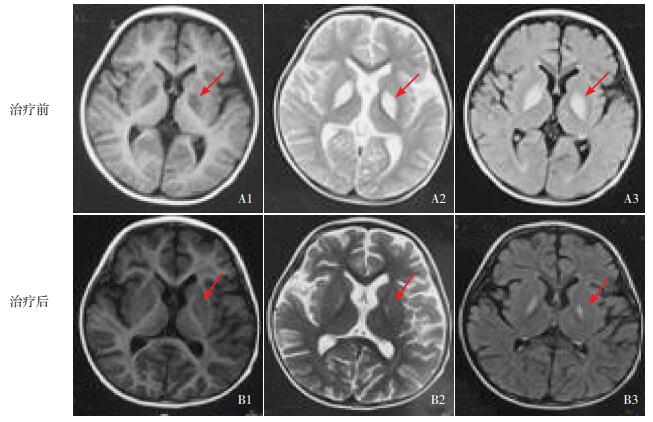
图 1 3-羟基异丁酰辅酶A水解酶缺乏症患儿治疗前后的头颅MRI 患儿治疗前头部MRI的T1(A1)、T2(A2)和T2 Flair(A3)相显示双侧基底节区对称的斑片状异常信号(如箭头所指);治疗后MRI T1(B1)、T2(B2)和T2Flair(B3)相显示双侧基底节区对称的斑片状异常信号影缩小(如箭头所示)。 |
本研究经医院医学伦理委员会批准并获得患儿父母知情同意。
1.2 线粒体基因组全长及线粒体相关疾病核基因检测采集患儿及其父母外周静脉血3~5 mL(EDTA抗凝),按照盐析法血液DNA提取试剂盒(美基生物,中国)说明书提取基因组DNA 3~5 μg。线粒体基因组全长检测使用线粒体特异性引物进行线粒体基因扩增,然后采用超声波方法将线粒体基因扩增产物打断,并使用KAPA HTP Library Preparation Kit(KAPA BIOSYSTEMS,美国)建立线粒体基因文库,使用NextSeq 500测序仪(Illumina公司,美国)进行高通量测序并进行基因序列的生物信息学分析,测序平均深度不小于4000X。
线粒体相关疾病核基因检测首先采用超声波方法将提取的基因组DNA打断,建立全基因组文库;并使用液相捕获探针(Roche,美国)捕获线粒体疾病相关核基因(POLG,TK2,TYMP,RRM2B,COQ2,COQ9,PDSS1等1 042个基因),然后使用NextSeq 500测序仪(Illumina公司,美国)对捕获后的探针文库进行高通量测序,测序平均深度不小于200X。
查询HGMD、ClinVar、1 000 g、ESP6500、ExAC、gnomaAD等数据库对候选变异的收录情况,根据ACMG(American College of Medical Genetics and Genomics,美国医学遗传学与基因组学学会)变异解读指南进行致病性分析。
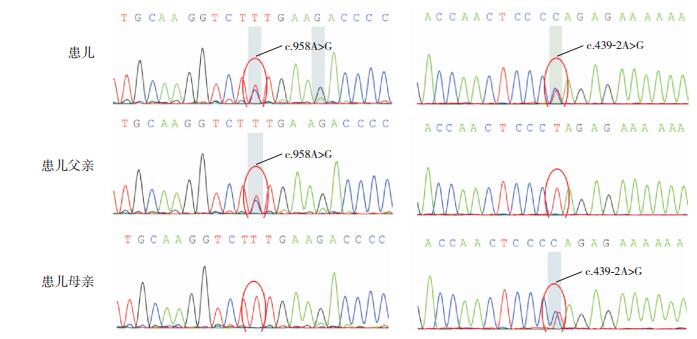
2 结果 2.1 线粒体基因组全长及线粒体相关疾病核基因检测结果患儿的线粒体基因组全长检测未发现致病突变,线粒体相关疾病核基因优选项目检测(图 2)发现HIBCH基因(NM014362.3)c.439-2A > G和c.958A > G(p.K320E)的复合杂合变异,分别遗传自其父母。c.439-2A > G、c.958A > G在HGMD、ClinVar、1 000 g、ESP6500、ExAC等数据库未见报道;c.439-2A > G在gnomAD数据库未见报道,c.958A > G在gnomAD数据库仅有一个来自东亚人群(东亚人群频率为0.0006165,总体人群频率为0.00003230)的杂合子报道。按照ACMG指南进行分析,c.958A > G(腺嘌呤 > 鸟嘌呤)突变导致翻译的蛋白质氨基酸由赖氨酸变为谷氨酸,临床意义不明;c.439-2A > G(腺嘌呤 > 鸟嘌呤)为3'端剪切突变,改变RNA前体的剪接方式,使得产生的成熟RNA中含有内含子或缺失外显子序列,可导致翻译的氨基酸序列改变,为可能致病性变异。
|
图 2 3-羟基异丁酰辅酶A水解酶缺乏症患儿及其父母的基因测序 患儿的HIBCH基因存在c.958A > G和c.439-2A > G的复合杂合突变;患儿父亲的HIBCH基因存在c.958A > G杂合突变;患儿母亲的HIBCH基因存在c.439-2A > G杂合突变。 |
本研究患儿感染后出现发育倒退、肌张力障碍,头部MRI提示双侧基底节对称性病变,考虑线粒体病-Leigh综合征可能,予以鸡尾酒疗法即大剂量维生素B1、B2、B6、C、E以及精氨酸、左卡尼汀、艾地苯醌、生物素等治疗,并予以硝基安定、苯海索、巴氯芬改善肌张力障碍,补充能量以及液体平衡等支持治疗。线粒体相关疾病核基因检测发现HIBCH基因突变,确诊3-羟基异丁酰辅酶A水解酶缺乏症,予以低缬氨酸饮食,治疗2周后,患儿肌张力不全症状改善,运动以及智能较前缓慢进步;复查头部MRI(图 1B)提示双侧基底节病变较前明显缩小。
3 讨论线粒体病是由于基因异常引起线粒体代谢酶缺陷,导致ATP合成障碍而出现的一组多系统受累疾病,遗传方式既有孟德尔遗传、又有线粒体母系遗传;常累及神经、肌肉系统,表现为体格矮小,认知障碍,卒中样发作,癫癎,共济失调,肌张力障碍等,症状可呈慢性进行性加重,也可在感染、外伤等应激事件时加重,表现为运动智力倒退;还可累及眼、耳、消化、内分泌、心血管、肾脏及血液等多个系统而出现相应临床表现[2]。Leigh综合征是较为常见的一种线粒体病,其临床特征为肌张力障碍、运动和认知急剧退化、共济失调,以及头颅MRI基底节或脑干对称性病灶;比较多见的线粒体病还有多发性线粒体呼吸链酶缺乏、丙酮酸脱氢酶缺乏症等。线粒体病临床表现多样,缺乏特定的生物学标记物,涉及2个基因组的遗传方式,诊断困难,确诊需要对线粒体基因组全长及线粒体相关疾病核基因进行变异检测。本例患儿在感染后出现智力运动发育倒退、肌张力障碍,头颅MRI双侧基底节信号异常,符合线粒体病尤其是Leigh综合征的临床特点。进行线粒体基因组全长、线粒体相关疾病核基因优选检查发现,患儿的HIBCH基因存在c.958A > G和c.439-2A > G复合杂合突变,分别遗传自其父母,根据ACMG变异解读指南进行分析,c.958A > G临床意义未明,c.439-2A > G是可疑致病突变。确诊为3-羟基异丁酰辅酶A水解酶缺乏症。
3-羟基异丁酰辅酶A水解酶缺乏症是由于HIBCH基因突变致3-羟基异丁酰辅酶A水解酶缺乏,缬氨酸分解代谢途径阻断,缬氨酸代谢物积累在线粒体中,最终导致线粒体功能障碍,是一种多发性线粒体功能障碍综合征,符合常染色体隐性遗传方式[3]。3-羟基异丁酰辅酶A水解酶缺乏症的HIBCH基因突变有纯合突变和复合杂合突变,常见的纯合突变有c.287C > A(p.A96D、p.Y122C、p.G317E、p.K74Lfs*13)、c.950G > A(p.Gly317Glu)、c.1128-1129insT(p.Lys377*)、c.913A > G(p.T305A);复合杂合突变有c.517+ 1G > A、c.410C > T(p.A137V)、c.(129dupA)、c.1027C > G,(p.H343D)、c.79-1G > Tc.(1033G > A)、c.365A > G(Y122C)和IVS2-3C > G,其中纯合突变所致者死亡率高[1, 4-11]。3-羟基异丁酰辅酶A水解酶缺乏症罕见,至2018年3月共检索到9篇相关的中外文献[1, 4-11],共报道18例,起病年龄3~6个月,表现为肌张力障碍18例、典型Leigh综合征16例、酮症酸中毒1例、癫癎发作2例;检查提示乳酸升高6例,血、尿遗传代谢病筛查异常7例;MRI表现为双侧基底节病变16例,脑萎缩3例,视神经萎缩1例;其中HIBCH纯合突变14例、复合杂合突变4例;死亡6例,其中纯合突变5例,有的出生后就起病,未限制缬氨酸饮食,均在3岁以内死亡;存活12例,其中10例(纯合突变9例)日常生活不能自理,均在4个月至4岁起病,仅给与鸡尾酒疗法和对症支持治疗,未限制缬氨酸饮食,随访时间最长的至43岁;存活病例中2例为复合杂合突变,3~5月龄起病,给与鸡尾酒疗法和限制缬氨酸饮食治疗,患儿日常活动与社会交流基本正常(最大随访至5岁)。本研究患儿为HIBCH基因复合杂合突变,起病较晚(1岁半左右),经治疗后病情好转,符合该病的基因型-表型特点。
3-羟基异丁酰辅酶A水解酶缺乏症预后不良,死亡率高,大多于幼儿期死于严重代谢性酸中毒等,予以“鸡尾酒疗法”(维生素B1、B2、B6、C、E、精氨酸、左卡尼汀、艾地苯醌等)和限制缬氨酸饮食后,部分患者预后改善。本例予以“鸡尾酒疗法”及限制缬氨酸饮食,临床症状改善,复查头颅MRI双侧基底节异常信号灶缩小。
综上所述,HIBCH基因突变所致的3-羟基异丁酰辅酶A水解酶缺乏症是多发性线粒体功能障碍综合征的一种,对于慢性进行性或者感染、外伤后出现的运动智力倒退、肌张力障碍、典型Leigh综合征、酮症酸中毒等表现者需要注意此病,可以进行线粒体相关疾病核基因检测明确诊断,尽早予以缬氨酸饮食限制可明显改善患者症状。
| [1] |
朱红敏, 包新华, 张尧. 以Leigh样综合征为临床表现的3-羟基异丁酰辅酶A水解酶缺陷症一例并文献复习[J]. 中华儿科杂志, 2015, 53(8): 626-630. (  0) 0) |
| [2] |
方方. 儿童常见线粒体病的临床表现和遗传特征[J]. 中华实用儿科临床杂志, 2014, 29(24): 1841-1843. (  0) 0) |
| [3] |
Hawes J W, Jaskiewicz J, Shimomura Y, et al. Primary structure and tissue-specific expression of human beta-hydroxyisobutyryl-coenzyme A hydrolase[J]. J Biol Chem, 1996, 271(42): 26430-26434. DOI:10.1074/jbc.271.42.26430 (  0) 0) |
| [4] |
Stiles AR, Ferdinandusse S, Besse A, et al. Successful diagnosis of HIBCH deficiency from exome sequencing and positive retrospective analysis of newborn screening cards in two siblings presenting with Leigh's disease[J]. Mol Genet Metab, 2015, 115(4): 161-167. DOI:10.1016/j.ymgme.2015.05.008 (  0) 0) |
| [5] |
Soler-Alfonso C, Enns GM, Koenig MK, et al. Identification of HIBCH gene mutations causing autosomal recessive Leigh syndrome:a gene involved in valine metabolism[J]. Pediatr Neurol, 2015, 52(3): 361-365. DOI:10.1016/j.pediatrneurol.2014.10.023 (  0) 0) |
| [6] |
Yamada K, Naiki M, Hoshino S, et al. Clinical and biochemical characterization of 3-hydroxyisobutyryl-CoA hydrolase (HIBCH) deficiency that causes Leigh-like disease and ketoacidosis[J]. Mol Genet Metab Rep, 2014, 1: 455-460. DOI:10.1016/j.ymgmr.2014.10.003 (  0) 0) |
| [7] |
Loupatty FJ, Clayton PT, Ruiter JP, et al. Mutations in the gene encoding 3-hydroxyisobutyryl-CoA hydrolase results in progressive infantile neurodegeneration[J]. Am J Hum Genet, 2007, 80(1): 195-199. DOI:10.1086/510725 (  0) 0) |
| [8] |
Ferdinandusse S, Waterham HR, Heales SJ, et al. HIBCH mutations can cause Leigh-like disease with combined deficiency of multiple mitochondrial respiratory chain enzymes and pyruvate dehydrogenase[J]. Orphanet J Rare Dis, 2013, 8: 188. DOI:10.1186/1750-1172-8-188 (  0) 0) |
| [9] |
Reuter MS, Sass JO, Leis T, et al. HIBCH deficiency in a patient with phenotypic characteristics of mitochondrial disorders[J]. Am J Med Genet A, 2014, 164A(12): 3162-3169. (  0) 0) |
| [10] |
Peters H, Ferdinandusse S, Ruiter JP, et al. Metabolite studies in HIBCH and ECHS1 defects:Implications for screening[J]. Mol Genet Metab, 2015, 115(4): 168-173. DOI:10.1016/j.ymgme.2015.06.008 (  0) 0) |
| [11] |
Schottmann G, Sarpong A, Lorenz C, et al. A movement disorder with dystonia and ataxia caused by a mutation in the HIBCH gene[J]. Mov Disord, 2016, 31(11): 1733-1739. DOI:10.1002/mds.26704 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


