2. 首都儿科研究所遗传研究室、儿童发育营养组学北京市重点实验室, 北京 100020;
3. 北京大学第一医院儿科, 北京 100034;
4. 北京大学第一医院实验中心, 北京 100034
额外标记染色体(small supernumerary marker chromosomes, sSMC)是指形态上可辨认,但来源和特征通常不能被传统的染色体显带技术所识别的结构异常的多余染色体。sSMC的实质为基因拷贝数增加,可以存在于正常的二倍体核型,也可在染色体数目或结构异常的基础上发生。由于sSMC来源不同,导致表型的异质性,可以没有任何临床表现,也可能存在严重的多发畸形和智力运动障碍[1]。15q来源的sSMC患者可表现为15q重复综合征,是一种罕见的染色体异常,多为散发,且大部分是由于母源减数分裂Ⅰ期发生15号同源染色体分裂错误所致[2-3]。sSMC在普通人群的发生率为1/30 000[4],中国人群中仅见数例报道[5-6]。15q11.2-13.2拷贝数增加可导致严重的神经系统表型,如癫癎及智力障碍等。本研究报道一例15号额外标记染色体致智力障碍、难治性癫癎伴中枢性性早熟患儿,通过联合应用G显带核型分析、荧光原位杂交(fluorescence in situ hybridization, FISH)、多重连接依赖性探针扩增技术(multiplex ligation dependent probe amplification, MLPA)和微阵列比较基因组杂交(array comparative genome hybridization, array-CGH)等多种细胞、分子遗传学检测方法,最终明确sSMC的来源、结构、受累范围及基因组重排形式。
1 资料与方法 1.1 病历介绍患儿,女,9岁半,自幼智力、运动发育落后,乳房增大2年余,抽搐、愣神发作1年。患儿4个月能抬头,8个月会独坐,1岁6个月会独走,2岁会叫“爸爸、妈妈”;现小学二年级,学习成绩差,能简单对答,喜转圈,手无刻板行为,步态蹒跚。7岁半时发现乳房增大。8岁半时出现抽搐及愣神发作,愣神发作表现为突然停止正在进行的动作,呼之不应,持续数秒,不伴四肢抖动以及面色改变,无大小便失禁,缓解后不能回忆,每日发作2~3次;抽搐每日发作10余次,发作时双眼向左凝视,呼之不应,四肢强直,左上肢屈曲抖动。患儿足月顺产出生,出生体重4 300 g。父母健康,非近亲婚配,家族中无类似病史,母亲否认妊娠期糖尿病史和围产期异常。查体:身高139cm(P50~P75),体重30 kg(P50),神清,反应可,眼神交流差,不能正确对答,面容无特殊,无高腭弓、颈蹼、肘外翻和盾形胸,皮肤未见色素沉着,左侧面颊及左侧小腿各可见1块牛奶咖啡斑:大小2 cm×3 cm,心、肺、腹部查体未见异常,四肢肌力、肌张力正常,膝腱反射正常。专科查体:双侧乳房隆起,可触及硬结、直径约3 cm,无触痛,乳晕色泽无加深,乳头不突出、无分泌物,TannerⅡ期,未见腋毛;女童外生殖器外观:阴蒂无增大及色素沉着,大、小阴唇发育正常,未见阴毛,TannerⅠ期。辅助检查:甲胎蛋白、癌胚抗原、肝肾功能、电解质、甲状腺功能均未见异常。7岁半时基础黄体生成素(LH)1.1 IU/L、卵泡刺激素(FSH)8.05 IU/L,促性腺激素释放激素(LHRH)激发试验:峰值LH 41.9 IU/L、FSH 22.9 IU/L、LH/FSH=1.8(LH > 5.0 IU/L,且LH/FSH ≥0.6可诊断为中枢性性早熟)。视频脑电图显示双侧后头部短中程7~8 Hz节律,各导联大量4~6 Hzθ波,大量高波幅棘波、棘-慢波、多棘波以及15~30次/s的快节律,监测到数次强直发作及不典型失神发作。两次头颅MRI及一次垂体增强核磁共振未见异常。骨龄(7岁半时):10岁半。B超(7岁半时):子宫发育型,双侧可见增大卵泡,最大卵泡0.5 cm×0.5 cm。血、尿串联质谱分析均未见异常。韦氏智力测试IQ:46分。孤独症行为筛查量表39分,孤独症依据不足。认知评估:空间、推理、短时记忆和声音直觉差。癫癎相关基因高通量测序未见异常。患儿及父母的全外显子测序未见异常。诊断为中枢性性早熟、癫癎、智力障碍。予促性腺激素释放激素类似物(GnRHa,曲普瑞林)治疗,定期监测卵泡刺激素、黄体生成素、雌二醇、睾酮、催乳素等正常;予以左乙拉西坦口服(每日50 mg/kg),治疗2个月无效后加用丙戊酸钠(750 mg/d),1周后发作减少50%,2个月后患儿愣神、强直发作再次增多,并出现频繁痉挛发作,表现为点头、耸肩,伴或不伴上肢上抬,逐渐加用奥卡西平(750 mg/d)、托吡酯治疗(200 mg/d)、拉莫三嗪治疗(100 mg/d),5种抗癫癎药物联合治疗仍无效。
患儿基因检测虽未见异常,但自幼智力、运动发育落后,应行染色体核型分析、芯片等检查进一步除外染色体或基因组水平疾病。
1.2 细胞和分子遗传学分析 1.2.1 染色体核型分析取患儿及父母外周血行淋巴细胞培养72 h,加入适量秋水仙素,2 h后加入氯化钾溶液低渗处理、卡诺固定液固定2次,滴片及烤片后进行胰酶消化和Giemsa染色,油镜下阅片,镜检30个分裂相,分析5个核型。
1.2.2 外周血DNA提取取患儿及父母外周血5 mL(EDTA抗凝),提取DNA(天根生化科技有限公司)。
1.2.3 微阵列比较基因组杂交分析应用Agilent SurePrint G3 Human Genome CGH Microarray(array-CGH)8×60 K芯片(Agilent Technologies,美国)进行比较基因组芯片杂交,按照说明书进行操作。应用荧光素(cy3/cy5)标记患者和参照样本的DNA,然后进行芯片杂交和杂交后洗涤,荧光图像由Agilent芯片扫描仪获取,应用Feature Extraction软件(Agilent Technologies)读取数据,并进行标准化处理。应用Genomic Workbench(Agilent Technologies)进行数据分析,发现拷贝数改变区域。基因组中的位置判断根据2009年2月UCSC数据库提供的人类基因组参考序列(GRCh37/hg19)。基因相关的临床信息通过在线人类孟德尔遗传(OMIM, www.ncbi.nlm.nih.gov/Omim/getmorbid.cgi)进行鉴定。
1.2.4 甲基化多重连接依赖性探针扩增应用甲基化特异性的多重连接依赖的探针扩增(methylation-specific MLPA, MS-MLPA)试剂盒ME028(MRC-Holland公司,荷兰)进行检测,判断基因组的甲基化状态。该试剂盒在染色体15q11-13的关键区域设有25个特异性探针,其中5个探针针对包含有甲基化特异的限制性内切酶Hha Ⅰ识别位点。甲基化异常的判定:Hha Ⅰ酶切后甲基化特异位点的探针信号峰值较未行酶切时减少50%,说明相应位点甲基化无异常,即父源性非甲基化拷贝与母源性甲基化拷贝各有1拷贝;Hha Ⅰ酶切后甲基化特异位点的探针信号完全消失,提示该位点母源性甲基化拷贝缺失;Hha Ⅰ酶切后甲基化特异位点的探针信号峰值与未酶切基因组MLPA无显著差异,提示相应位点母源性甲基化拷贝增加1个拷贝。
1.2.5 荧光原位杂交选用15q11.2-13特异性FISH探针LSI SNRPN、LSI PML、CEP15(D15Z1)(Vysi,美国)进行原位杂交,操作按说明书进行。杂交完成后用DAPI复染、封片。采用日本Olympus荧光显微镜观察结果并采集最终图像。
2 结果 2.1 染色体核型结果患儿染色体核型(图 1)为47, XX, +mar,所有细胞染色体均可见多l条mar,其大小与20号染色体相似,其父母外周血染色体核型分别为46, XY和46, XX。
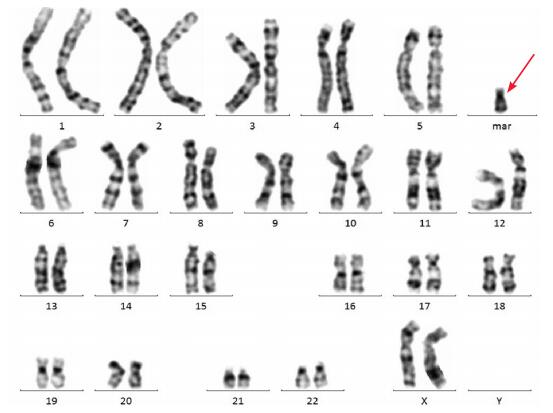
|
图 1 患者G显带染色体核型分析 核型为47, XX, +mar。箭头示mar。 |
array-CGH分析显示,15号染色体长臂1区1带1亚带至1区3带3亚带区(15q 11.1-13.3)拷贝数2倍剂量增加,大小约12.3 Mb,基因位点在20102541~30404023之间。见图 2。
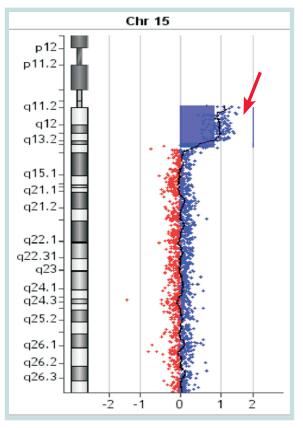
|
图 2 患者array-CGH分析结果 偏移比为1提示拷贝数剂量增加2倍。箭头示重复区。 |
和健康对照Hha Ⅰ酶切处理前的MS-MLPA峰值图相比,患者5个甲基化特异位点的探针信号峰值与健康对照探针的比值约是健康对照比值的两倍(图 3),说明患者5个甲基化特异位点的拷贝数是正常人的2倍,即4个拷贝。患者和健康对照Hha Ⅰ酶切处理后的峰值图相比,5个甲基化特异位点的探针信号峰值与对照探针的比值约是健康对照比值的3倍(图 3),说明患者5个甲基化特异位点的母源性拷贝数是正常人的3倍,那么患者4个拷贝中有3个母源性的,1个父源性的。健康对照的5个甲基化特异位点因为是1个母源性的拷贝和1个父源性的拷贝,所以Hha Ⅰ酶切处理后5个甲基化特异位点峰值与Hha Ⅰ酶切处理前的比值约是1 : 2;而患者因为有3个母源的拷贝,因此Hha Ⅰ酶切处理后5个甲基化特异位点的峰值与Hha Ⅰ酶切处理前的比值约是3 : 4。
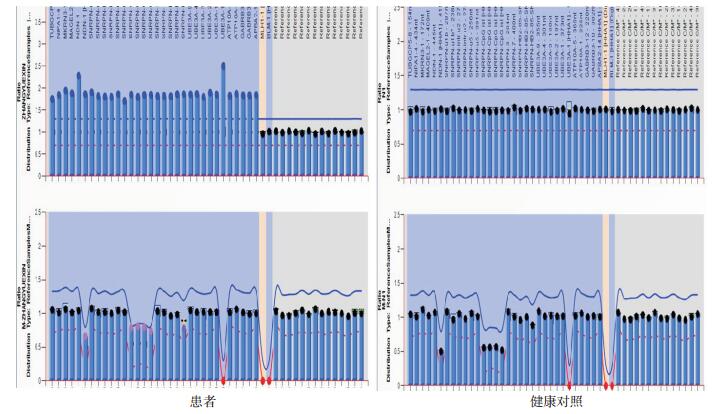
|
图 3 患者和健康对照的MS-MLPA分析结果 Hha Ⅰ酶切前(上图)与酶切后(下图)的MS-MLPA峰值图;纵轴代表荧光强度,横轴代表探针及片段大小。 |
sSMC包括着丝粒信号D15Z1(蓝色)2个,基因SNRPN(红色)信号2个,见图 4。
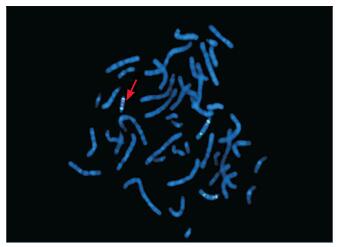
|
图 4 患者FISH检测图 sSMC(如箭头所示)包括着丝粒信号D15Z1(蓝色)2个、基因SNRPN(红色)信号2个。 |
sSMC是额外增加的小染色体,多数情况下小于20号染色体,其结构可能是倒位、重复、环状或者其它微小结构。Liehr等[7]进行了sSMC病例报道的总结:产前得以确诊的病例中sSMC发生率为0.077%,其中胎儿超声检查发现异常的胎儿中sSMC发生率增高到2.04%;新生儿sSMC发生率为0.043%;发育迟滞或智力障碍者sSMC发生率为0.288%,比正常人群高7倍左右;不孕人群中sSMC发生率为0.125‰,男女比例为7.5 : 1。sSMC对表型的影响很大程度依赖基因剂量以及衍生于哪条染色体,表型从正常到严重多结构畸形、智力障碍不等(70%表型正常,30%存在不同程度异常),有的可能导致生殖障碍,如无精症、少弱畸精症、闭经、习惯性流产等[9-10];所有病例中70%为新生性,20%遗传自母亲,10%遗传自父亲[8]。
在新生儿中,以15号额外标记染色体最为常见,约占sSMC的50%[11-13]。15号染色体是含印记基因的近端着丝粒染色体,约包含人类基因组的5%,是基因组最不稳定区域之一,易发生基因组重排[14]。其中,15q11-13拷贝数重复的发生率为2%~3%,与复杂的神经精神性疾病密切相关,包括癫癎、智力障碍、精神分裂症及孤独症等[11, 15]。而结构变异多为倒位重复、等臂双着丝粒,一个着丝粒失活被称为idic(15)、psu dic(15)或inv dup(15)。idic(15)不仅发病率较其他sSMC高,而且个体表型差异大,因此选择正确的诊断手段明确基因剂量、受累范围、染色体起源及基因组重排形式非常重要。本例患儿及其父母的染色体核型分析表明患儿的sSMC为新生性;应用微阵列比较基因组杂交技术确认了患儿15q11-13区域拷贝数、变异范围及基因位点、片段大小,MS-MLPA分析进一步证实了患儿拷贝数重复来自母亲,FISH分析明确了异常位点与着丝粒、端粒的位置关系,结合array-CGH结果,提示患儿sSMC为15号染色体以长臂q13为断裂点的双着丝粒异常染色体,即sSMC(15)。综合检测结果,mar来源于15号染色体,由两份倒位15q11-q13、两个着丝粒、15p和端粒组成,分子细胞核型分析为47, XX, +inv dup(15)(pter →q13:q13→pter)。然而,本病例若不结合细胞遗传学染色体核型分析,只应用微阵列比较基因组杂交技术就不能发现15号标记染色体的宏观异常。因此,联合应用多种遗传学方法进行分析,有利于互补与验证。
15q重复综合征的主要表现包括轻微面部畸形、肌张力低下、发育迟缓、中度或重度智力障碍、语言障碍、惊厥发作和孤独症样表现等。进入青春期后性腺发育不良则成为突出的表现,如乳房未发育、无月经初潮等,少数病例可表现出中枢性性早熟[16]。本研究患儿查体虽无肌张力低,但独坐、独走延迟可能与当时肌张力低有关,患儿的智力障碍、刻板动作等表现与文献相符。60%的本病患儿有癫癎表现,甚至是难治性的;部分患儿虽无惊厥发作,但脑电图可存在异常。具有癫癎表现的本病患儿的临床特点为:65%的癫癎发作形式多样,包括强直、痉挛、不典型失神等,其中50%于10岁前出现癫癎症状,30%以婴儿痉挛症起病;偶尔有猝死发生;EEG可见各种异常,背景活动慢,全导联阵发性的棘波、多棘波、棘慢波节律最常见;头颅MRI无异常[17]。本研究患儿发作形式中有晚发型癫癎性痉挛发作、不典型失神及强直发作等多种形式,抗癫癎药物治疗无效,为难治性癫癎,与文献相符。本例患者影像学检查未见明显结构性改变,排除了感染性、免疫性、代谢性等因素的参与,结合其智力障碍、中枢性性早熟特点,遗传学因素致病的可能性大。但患儿及其父母癫癎相关基因全外显子测序未见异常,经过染色体核型分析、芯片检测等最终诊断为15q重复综合征。近年来二代测序技术尤其是全外显子组基因测序的先进性和适应症被盲目夸大。全外显子组基因测序并不适用于所有遗传性疾病的诊断,如以脆性X综合征为代表的动态突变病例,以佩梅病、假肥大型肌营养不良为代表的拷贝数变异,以Prader-Willi综合征和Angelman综合征为代表的甲基化异常等。
本研究患儿8岁前出现乳房增大,骨龄超过实际年龄1岁以上,盆腔B超显示子宫、卵巢容积增大,且卵巢内可见多个直径 > 4 mm的卵泡,下丘脑促性腺激素释放激素(GnRH)激发试验LH > 5.0 IU/L且LH/FSH≥0.6,中枢性性早熟诊断明确。本患儿头颅及垂体MRI正常,可排除继发的中枢性性早熟。约20%的15q重复综合征病人存在性发育不良,但性早熟较少见,既往考虑与遗传及临床异质性有关。近年来随着分子遗传学尤其是二代测序的快速发展,一些既往认为的综合征表型被证实为不同基因位点突变所致[18-19]。本研究患儿的病变区域包含一个MKRN3基因,该基因是父系遗传的印迹基因。Settas等[20]在1位性早熟女孩及其青春早启动的哥哥体内均发现了新的MKRN3基因突变(c.1018T > G p.Cys340Gly),患者父亲及祖母均携带此突变而无相关临床表现。本研究患儿及其父母全外显子组基因测序未发现中枢性性早熟相关基因如MKRN3、GABRA1、NPY-Y1R、LIN28B、TAC3、TACR3、KISS1、KISS1R[21]的异常,尤其是MKRN3基因未见来自父源的变异,推断认为患儿的中枢性性早熟可能仍与15q重复综合征有关。
综上,建议对于不明原因智力障碍伴癫癎表现的患儿,应予以高分辨染色体核型分析。全外显子组基因测序并不适用于所有遗传性疾病的诊断。不同的遗传学检测手段各有优势及局限性,需合理应用方能揭示疾病的全貌。
| [1] |
Liehr T, Karamysheva T, Merkas M, et al. Somatic Mosaicism in cases with small supernumerary marker chromosomes[J]. Curr Genomics, 2010, 11(6): 432-439. DOI:10.2174/138920210793176029 (  0) 0) |
| [2] |
Park DH, Lim S, Park ES, et al. A nine-month-old boy with isodicentric chromosome 15:A case report[J]. Ann Rehabil Med, 2013, 37(2): 291-294. DOI:10.5535/arm.2013.37.2.291 (  0) 0) |
| [3] |
Battaglia A, Parrini B, Tancredi R. The behavioral phenotype of the idic(15) syndrome[J]. Am J Med Genet C Semin Med Genet, 2010, 154C(4): 448-455. DOI:10.1002/ajmg.c.v154c:4 (  0) 0) |
| [4] |
Schinzel A, Niedrist D. Chromosome imbalances associated with epilepsy[J]. Am J Med Genet, 2001, 106(2): 119-124. DOI:10.1002/(ISSN)1096-8628 (  0) 0) |
| [5] |
李小燕, 陈倩, 谢华, 等. 15q11.2-13.2微重复四倍体综合征1例并文献复习[J]. 中国循证儿科杂志, 2015, 10(4): 292-296. (  0) 0) |
| [6] |
赵建慧, 张雷红, 申桂芝, 等. 携带15号额外标记染色体孤独症谱系障碍1例报告[J]. 中国当代儿科杂志, 2015, 17(3): 290-291. DOI:10.7499/j.issn.1008-8830.2015.03.019 (  0) 0) |
| [7] |
Liehr T, Weise A. Frequency of small supernumerary marker chromosomes in prenatal, newborn, developmentally retarded and infertility diagnostics[J]. Int J Mol Med, 2007, 19(5): 719-731. (  0) 0) |
| [8] |
Jafarighahfarokhi H, Moradichaleshtori M, Liehr T, et al. Small supernumerary marker chromosomes and their correlation with specific syndromes[J]. 2015, 4(1): 140.
(  0) 0) |
| [9] |
Balkan M, Isi H, Gedik A, et al. A small supernumerary marker chromosome, derived from chromosome 22, possibly associated with repeated spontaneous abortions[J]. Genet Mol Res, 2010, 9(3): 1683-1689. DOI:10.4238/vol9-3gmr947 (  0) 0) |
| [10] |
Manvelyan M, Riegel MM, Santos M, et al. Thirty-two new cases with small supernumerary marker chromosomes detected in connection with fertility problems:detailed molecular cytogenetic characterization and review of the literature[J]. Int J Mol Med, 2008, 21(6): 705-714. (  0) 0) |
| [11] |
Magri C, Sacchetti E, Traversa M, et al. New copy number variations in schizophrenia[J]. PLoS One, 2010, 5(10): e13422.. DOI:10.1371/journal.pone.0013422 (  0) 0) |
| [12] |
Wang NJ, Liu D, Parokonny AS, et al. High-resolution molecular characterization of 15q11-q13 rearrangements by array comparative genomic hybridization (Array CGH) with detection of gene dosage[J]. Am J Hum Genet, 2004, 75(2): 267-281. DOI:10.1086/422854 (  0) 0) |
| [13] |
Mignon-Ravix C, Depetris D, Luciani JJ, et al. Recurrent rearrangements in the proximal 15q11-q14 region:a new breakpoint cluster specific to unbalanced translocations[J]. Eur J Hum Genet, 2007, 15(4): 432-440. DOI:10.1038/sj.ejhg.5201775 (  0) 0) |
| [14] |
Locke DP, Segraves R, Nicholls RD, et al. BAC microarray analysis of 15q11-q13 rearrangements and the impact of segmental duplications[J]. J Med Genet, 2004, 41(3): 175-182. DOI:10.1136/jmg.2003.013813 (  0) 0) |
| [15] |
Wang NJ, Parokonny AS, Thatcher KN, et al. Multiple forms of atypical rearrangements generating supernumerary derivative chromosome 15[J]. BMC Genet, 2008, 9: 2. (  0) 0) |
| [16] |
Al Ageeli E, Drunat S, Delanoë C, et al. Duplication of the 15q11-q13 region:clinical and genetic study of 30 new cases[J]. Eur J Med Genet, 2014, 57(1): 5-14. DOI:10.1016/j.ejmg.2013.10.008 (  0) 0) |
| [17] |
Verrotti A, Sertorio F, Matricardi S, et al. Electroclinical features of epilepsy in patients with InvDup(15)[J]. Seizure, 2017, 47: 87-91. DOI:10.1016/j.seizure.2017.03.006 (  0) 0) |
| [18] |
Khokhar A, Agarwal S, Perez-Colon S. Williams syndrome and 15q duplication:Coincidence versus association[J]. Mol Syndromol, 2017, 8(1): 50-54. DOI:10.1159/000452360 (  0) 0) |
| [19] |
刘玉鹏, 丁圆, 李溪远, 等. 甲基丙二酸尿症合并先天性肾上腺皮质增生症1例报告[J]. 临床儿科杂志, 2016, 34(3): 208-211. (  0) 0) |
| [20] |
Settas N, Dacou-Voutetakis C, Karantza M, et al. Central precocious puberty in a girl and early puberty in her brother caused by a novel mutation in the MKRN3 gene[J]. J Clin Endocrinol Metab, 2014, 99(4): 647-651. DOI:10.1210/jc.2013-4084 (  0) 0) |
| [21] |
Shin YL. An update on the genetic causes of central precocious puberty[J]. Ann Pediatr Endocrinol Metab, 2016, 21(2): 66-69. DOI:10.6065/apem.2016.21.2.66 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


