2. 北京金准基因科技有限责任公司, 北京 100191
患儿,女(社会性别),14岁9个月,汉族,北方人。因发现血压升高11 d入院。患儿因体检时血压130/80 mm Hg,进行血压监测:收缩压138~150 mm Hg、舒张压90~100 mm Hg,患儿无头晕、头痛、呕吐、乏力等症状,眼科检查未见异常。起病以来,精神、食欲、睡眠好,大小便正常。患儿既往未测过血压。患儿为第2胎第1产,足月剖宫产出生,出生体重3 300 g,出生史无异常。尚无月经来潮,智力正常。父母非近亲结婚,母亲生育时年龄33岁,母亲第1胎人工流产,父亲有原发性高血压、2型糖尿病家族史。
体格检查:体温36.8℃,呼吸18次/min,脉搏108次/min(四肢脉搏对称),四肢血压:右上肢146/90 mm Hg、左上肢146/86 mm Hg、右下肢170/89 mm Hg、左下肢170/80 mm Hg,体重47 kg(P50~75),身高156 cm(P25~50),BMI 19.1 kg/m2。神志清楚,精神好,肤色略黑,皮肤弹性好,毛发无异常,无胡须、腋毛、阴毛。无特殊面容,眼睑无水肿,眼窝无凹陷,口腔粘膜湿润,咽无充血,扁桃体无肿大。未见喉结,甲状腺无肿大,颈无抵抗。乳腺未发育,双肺无啰音,心率108次/min、律齐、心音有力、未闻及杂音,腹软,无压痛,肝脾未触及,双侧腹股沟未触及肿物。肛门未见异常,外阴可见大阴唇,未见小阴唇、阴蒂、阴道及处女膜。脊柱、四肢、关节未见异常,双下肢无水肿。四肢肌力、肌张力无异常,双侧肱二头肌、肱三头肌、膝腱反射、跟腱反射无异常,克氏征、布氏征阴性,巴氏征阴性。
实验室检查:血、尿、便常规无异常。动脉血气分析、血电解质(钾、钠、氯、钙、镁)、肝肾功能、尿酸、血脂、心肌酶谱、肌钙蛋白T、血糖、胰岛素、糖化血红蛋白、甲状腺功能、甲状旁腺素、C反应蛋白、类风湿因子、抗核抗体等均未见异常,24 h尿3-甲基4-羟基苦杏仁酸、17-羟及17-酮皮质类固醇未见异常。卧位:肾素0.03 ng/mL(参考值:0.05~0.79 ng/mL),血管紧张素Ⅱ、醛固酮未见异常;立位:肾素 < 0.10 ng/mL(参考值:0.93~6.56 ng/mL),血管紧张素Ⅱ43.75 pg/mL(参考值:55.30~115.30 pg/mL),醛固酮未见异常。皮质醇:0 AM < 1.00 μg/dL(参考值:< 5.00 μg/dL),8 AM 1.30 μg/dL(参考值:5.00~25.00 μg/dL),4 PM < 1.00 μg/dL(参考值:2.00~10.00 μg/dL)。促肾上腺皮质激素(adrenocorticotropic hormone, ACTH)77.70 pg/mL(参考值:7.20~63.30 pg/mL)。硫酸去氢表雄酮 < 15.00 μg/dL(参考值:男性76~382 μg/dL、女性114~486 μg/dL),雄烯二酮 < 0.15 nmol/L(参考值:男性2.8~7.3 nmol/L、女性2.8~8.8 nmol/L),睾酮 < 0.69 nmol/L(参考值:男性9.7~38.2 nmol/L、女性0.9~2.9 nmol/L),雌二醇168 pmol/L(参考值:男性 < 180 pmol/L、女性110~220 pmol/L),促卵泡生成素96.20 mIU/mL(参考值:男性2.60~11.00 mIU/mL、女性1.00~ 9.20 mIU/mL),促黄体生成素51.42 mIU/mL(参考值:男性0.40~7.00 mIU/mL、女性0.40~11.70 mIU/mL),17-羟孕酮未见异常。绒毛膜促性腺激素、甲胎蛋白未见异常。染色体:46, XY。
24 h动态血压示:收缩压115~168 mm Hg,平均143 mm Hg,> 140 mm Hg的占81.10%;舒张压66~116 mm Hg,平均90 mm Hg,> 90 mm Hg的占67.60%。胸片、心电图、超声心动图、颈动静脉、肾动静脉及腹部超声均未见异常。妇科超声未见卵巢及子宫。骨龄落后,腕部可见7块骨化中心,各掌、指骨及尺、桡骨远端骨骺已出,未见闭合。肾上腺CT平扫及增强示双侧肾上腺皮质增粗。腹部、盆腔CT平扫及增强示双侧腹股沟区可见隐睾。垂体MRI平扫及增强示Rathke囊肿。
2 诊断思维患儿14岁9个月,社会性别为女性,血压高于中国同龄男性和女性血压的第99百分位,严重高血压诊断成立。应进行继发性高血压鉴别诊断。(1)肾实质疾病:患儿无肾脏病史,无少尿、水肿、血尿、蛋白尿,尿常规、肾功能均未见异常,不支持此类疾病。(2)肾动脉狭窄:患儿无血管杂音,而且肾素水平低,肾动脉超声未见异常,不支持此病。(3)主动脉缩窄:患儿四肢脉搏对称,双下肢血压较双上肢更高,无血管杂音,超声心动图未见异常,不符合此病的特点。(4)常见内分泌性高血压:①甲状腺功能亢进症。本例患儿无心悸、突眼等表现,无甲状腺肿大及甲状腺功能异常,不支持此病。②皮质醇增多症:患儿无此病的满月脸、水牛背、向心性肥胖、多毛等典型表现以及皮质醇增高的特点。③嗜铬细胞瘤:患儿为持续高血压,无交感神经兴奋症状,24 h尿3-甲基4-羟基苦杏仁酸未见异常,不支持该病。(5)本研究患儿血压增高,伴肾素水平降低,需进一步与下述内分泌或肾小管疾病鉴别:①原发性醛固酮增多症:为一组与遗传有关的肾上腺皮质分泌醛固酮过多的疾病,特点为高血压、低血钾、肾素水平降低以及血、尿醛固酮浓度升高。本例患儿有高血压、肾素水平降低,但无低钾血症,醛固酮未见异常,并且伴有性发育异常,低皮质醇,高ACTH,性激素水平异常,不能用原发性醛固酮增多症解释。②假性醛固酮增多症(Liddle综合征):为一种常染色体显性遗传的远端肾小管功能障碍性疾病,多在幼年起病,表现为体重不增、多尿多饮、低血钾及重度高血压,血醛固酮和肾素水平降低,血皮质醇浓度正常。本研究患儿无体重不增、多尿多饮、低血钾等特点,皮质醇浓度降低而且伴有性发育异常,不支持此病。③假性醛固酮减少症Ⅱ型:是一种遗传性的远端肾小管功能障碍性疾病,由于基因突变导致肾小管对钠离子、氯离子重吸收增加,钾离子分泌减少,临床特点为不同程度的高血钾、高血氯和容量依赖性高血压,伴有代谢性酸中毒,血醛固酮水平正常或略升高,肾素水平减低或正常。本例患儿无电解质紊乱及酸中毒,而且有性发育异常,不支持此病。(6)本例患儿有低肾素性高血压伴性发育异常,低皮质醇,高ACTH,以及肾上腺皮质增生的影像学证据,应与先天性肾上腺皮质增生症伴高血压的类型鉴别。①11β-羟化酶缺乏症:临床特点为高血钠、低血钾、碱中毒及高血容量,常伴有高血压,因雄激素增多表现的女性男性化、男性性发育提前、17-羟孕酮升高。本研究患儿无电解质紊乱和女性男性化,雄激素水平降低,血17-羟孕酮、尿17-羟、17-酮类固醇均未见异常,不支持该病。②17α-羟化酶缺乏症(17α hydroxylase deficiency, 17OHD):此病特点为低肾素性高血压,男性假两性畸形和女性性幼稚,雄激素水平降低,卵泡刺激素和黄体生成素升高。本例患儿14岁,以高血压就诊,伴有男性假两性畸形,肾素、雄激素水平降低,卵泡刺激素和黄体生成素增高,血17-羟孕酮无异常,符合17α-羟化酶缺乏症特点,最终经基因诊断证实为此病。还需要与其他引起男性假两性畸形的以下疾病相鉴别:5α-还原酶缺陷症,此病与17α-羟化酶缺乏症类似,均为睾酮合成通路中酶缺陷,不能催化睾酮转化为具有生物活性的双氢睾酮,而双氢睾酮与阴囊和前列腺的发育有关,因此5α-还原酶缺陷症患者的染色体为46, XY,有发育完好的睾丸,但外阴男性化不全,典型患者的外生殖器呈女性表型,但具有男性性腺,至青春期因睾酮分泌增多,呈现男性青春发育,表现为睾丸下降并增大。此病不伴有高血压及低钾症状。本研究患儿已达青春期,无睾丸下降增大的表现,并且伴有高血压,不符合5α-还原酶缺陷症特点。雄激素不敏感综合征:因雄激素受体缺陷导致的病变,患者核型为46, XY,出生时呈女性表型,青春期乳房发育好,但阴毛稀少、阴道呈盲端、无子宫,此病无高血压及低钾血症的表现。本研究患儿青春期仍无乳房发育,并且有高血压症状。3β-羟基类固醇脱氢酶缺陷症,此病也存在睾酮合成通路中的酶缺陷,性腺和肾上腺的激素合成受累,临床表现为小阴茎、尿道下裂,有盲端的阴道。本研究患儿无小阴茎、尿道下裂表现,并且无盐皮质激素异常。
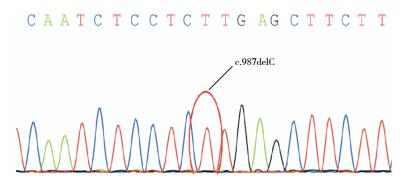
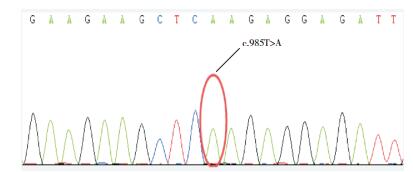
3 进一步检查征得患儿父母知情同意,采集患儿及父母外周血进行全基因组测序分析(北京金准基因科技有限责任公司),发现患儿CYP17A1基因外显子区域存在2个纯合突变,分别为c.985T > C(胸腺嘧啶突变为腺嘌呤)和c.987delC(缺失突变),均为已报道的致病突变。见图 1、2。父母存在上述2个位点的杂合突变。
|
图 1 患儿CYP17A1基因外显子区域存在del C的纯合突变 |
|
图 2 患儿CYP17A1基因外显子区域存在c.985T > A的纯合突变 |
依据患儿主要临床表现、肾上腺相关激素水平以及全基因组测序分析结果,确诊为先天性肾上腺皮质增生症17α-羟化酶缺乏症(17OHD)。依据:(1)严重高血压伴男性假两性畸形,无第二性征,骨龄落后;(2)低肾素,低皮质醇,高ACTH,低雄激素,高促性腺激素;(3)有双侧肾上腺皮质增生及双侧腹股沟区隐睾的影像学证据;(4)全基因组测序证实CYP17A1基因外显子区域存在2个纯合突变,为已报道的致病突变。
5 临床经过给予患儿氢化可的松口服,每日20 mg(早晨10 mg、中午5 mg、下午5 mg)。治疗2个月后复查:血压恢复正常,ACTH较治疗前下降,皮质醇恢复正常,见表 1。患儿及其父母要求继续按女性治疗,给予雌激素口服替代;手术切除双侧隐睾以防恶变,双侧隐睾病理提示曲细精管内可见支持细胞、未见生精细胞、间质细胞灶状增生。
| 表 1 患儿治疗前后皮质醇、促肾上腺皮质激素、卵泡生成素、促黄体生成素及雌二醇变化 |
|
|
先天性肾上腺皮质增生症(congenital adrenal hyperplasia, CAH)是常染色体隐性遗传性皮质醇相关的酶功能缺陷,包括21-羟化酶缺乏症、11β-羟化酶缺乏症及17OHD等类型[1-3],17OHD较罕见,约占CAH的1%[3]。17OHD发病率低,目前全世界仅报道160余例,国内报道约60余例。我国报道[4-5]的病例大多数为生育年龄的成年人,因“不孕”、“原发性闭经”就诊,或因严重高血压、低血钾症状而就诊,在儿童期早期诊断的病例极为少见。17OHD是由于编码17α-羟化酶的CYP17A1基因突变所致,该基因定位于10q24.3,包括8个外显子和7个内含子[6]。17α-羟化酶是肾上腺皮质激素和性激素合成途径中的关键酶之一,CYP17A1基因缺陷导致该酶活性改变,因而肾上腺皮质激素和性激素合成障碍[7]。
17OHD患者由于糖皮质激素生成减少,导致ACTH分泌增加、肾上腺皮质增生、孕烯醇酮及孕酮底物堆积,而具有盐皮质激素类作用的皮质酮及去氧皮质醇分泌大量增加,保钠、排钾,血容量增加,表现为不同程度的高血压,可有低血钾;由于性激素合成不足,女性表现为原发性闭经,外生殖器呈幼稚型,而男性外生殖器在胚胎期即发育停滞,外观呈女性幼稚型,阴道呈盲端,无子宫、卵巢,在腹腔或腹股沟多有发育不良的睾丸,因此,此酶缺乏的患者社会性别均为女性。此病由于缺乏性激素,常有骨龄落后[8-9]。患者常常因为原发性闭经或高血压就诊,可有逐渐加重的乏力和骨骼疼痛等,体检可见体型瘦长、肤色黑以及性发育落后,实验室检查可发现促性腺激素增高,雌激素、雄激素、皮质醇、肾素减低,影像学检查可见双侧肾上腺皮质增生[10-11]。CYP17A1基因纯合突变能够协助确诊[12]。
本研究患儿14岁,因高血压就诊,无低血钾的症状,患儿及家长也未意识到患儿存在性发育落后,体格检查无第二性征,影像学未见卵巢及子宫、骨龄落后、双侧肾上腺皮质增生、双侧腹股沟区可见隐睾,而且具有低肾素、低皮质醇、高ACTH、低雄激素、高促性腺激素等特点,具有17OHD的典型临床特点。最终经过全基因组测序确诊为17α-羟化酶缺乏症。
17OHD的治疗主要是终生应用糖皮质激素补充不足的皮质醇,从而减少水钠潴留、降低血压、提高血钾水平,减少成年身高受损,糖皮质激素剂量可在血压稳定后逐渐减少到维持量。糖皮质激素替代治疗的药物可选择地塞米松、强的松或氢化可的松,氢化可的松在儿童和青少年更常用[13]。但外源性皮质醇难以模拟皮质醇的正常脉冲分泌及昼夜节律,以及体内ACTH与皮质醇之间的生理性负反馈关系,因此替代治疗容易发生剂量不足导致水钠潴留、高血压难以改善,也可出现剂量过度抑制生长,甚至发生医源性库欣综合征。应注意治疗的个体化,维持治疗作用及副作用间的平衡。关于性别选择方面,如果表型及遗传性别均为女性,青春期补充雌激素可促使乳房、阴毛等性征发育;如果遗传性别为男性,外生殖器为女性表型,一般按照女性抚养,需手术切除腹腔或腹股沟内发育不良的睾丸,以防止睾丸恶变,到青春发育期予以雌激素替代治疗,如果发育不良的阴茎类似女孩阴蒂肥大,则做手术切除或阴道成形术[14-15]。雌激素替代治疗方案可以依据患者月经情况或第二性征发育情况调节。单用雌激素虽不能促进乳腺发育,但可促进阴毛发育[16]。对于染色体为46, XX表型的患者,可以应用雌激素及孕激素治疗以形成正常月经周期[17]。同时注意给予辅助心理治疗[18]。本研究患儿经过氢化可的松治疗,血压恢复正常。患儿及家长要求继续女性身份,加用小剂量雌激素口服,并切除隐睾。
7 结语17OHD为先天性肾上腺皮质增生症罕见类型,报道较少。本例患儿因高血压就诊,体格检查发现性发育异常;实验室检查提示低肾素、低皮质醇、高ACTH、低性激素、高促性腺激素,结合基因分析结果,确诊为17OHD。高血压为儿科门诊常见症状,在儿童高血压的鉴别诊断方面,也应注意儿童性发育情况,筛查ACTH和皮质醇,以免误诊;对低肾素性高血压伴性发育落后者应注意鉴别罕见病17α-羟化酶缺乏症。
| [1] |
Turcu AF, Auchus RJ. The next 150 years of congenital adrenal hyperplasia[J]. J Steroid Biochem Mol Biol, 2015, 153: 63-71. DOI:10.1016/j.jsbmb.2015.05.013 (  0) 0) |
| [2] |
Hinz L, Pacaud D, Kline G. Congenital adrenal hyperplasia causing hypertension:an illustrative review[J]. J Hum Hypertens, 2017, 32(2): 150-157. (  0) 0) |
| [3] |
Fleming L, Van Riper M, Knafl K. Management of childhood congenital adrenal hyperplasia-An integrative review of the literature[J]. J Pediatr Health Care, 2017, 31(5): 560-577. DOI:10.1016/j.pedhc.2017.02.004 (  0) 0) |
| [4] |
周莹, 黄爱洁, 符金香, 等. 17α-羟化酶/17, 20-碳链裂解酶缺陷症不典型病例1例报告[J]. 中国实用内科杂志, 2016, 36(8): 716-717. (  0) 0) |
| [5] |
刘杰, 黄沁松. 17α-羟化酶缺乏症男性假两性畸形1例报告[J]. 中国实用妇科与产科杂志, 2017, 33(12): 1311-1312. (  0) 0) |
| [6] |
Wu C, Fan S, Qian Y, et al. 17α-hydroxylase/17, 20-lyase deficiency:clinical and molecular characterization of eight Chinese patients[J]. Endocr Pract, 2017, 23(5): 576-582. DOI:10.4158/EP161610.OR (  0) 0) |
| [7] |
Auchus RJ. Steroid 17-hydroxylase and 17, 20-lyase deficiencies, genetic and pharmacologic[J]. J Steroid Biochem Mol Biol, 2017, 165(Pt A): 71-78. (  0) 0) |
| [8] |
Miller WL. The syndrome of 17, 20 lyase deficiency[J]. J Clin Endocrinol Metab, 2012, 97(1): 59-67. DOI:10.1210/jc.2011-2161 (  0) 0) |
| [9] |
Deeb A, Al Suwaidi H, Attia S, et al. 17-hydroxylase/17, 20-lyase deficiency due to a R96Q mutation causing hypertension and poor breast development[J]. Endocrinol Diabetes Metab Case Rep, 2015, 150069. (  0) 0) |
| [10] |
Soveid M, Rais-Jalali GA. Seventeen alpha-hydroxylase deficiency associated with absent gonads and myelolipoma:A case report and review of literature[J]. Iran J Med Sci, 2016, 41(6): 543-547. (  0) 0) |
| [11] |
Küçükemre-Aydın B, Öğrendil-Yanar Ö, Bilge I, et al. An easily missed diagnosis:17-alpha-hydroxylase/17, 20-lyase deficiency[J]. Turk J Pediatr, 2015, 57(3): 277-281. (  0) 0) |
| [12] |
Kim YM, Kang M, Choi JH, et al. A review of the literature on common CYP17A1 mutations in adults with 17-hydroxylase/17, 20-lyase deficiency, a case series of such mutations among Koreans and functional characteristics of a novel mutation[J]. Metabolism, 2014, 63(1): 42-49. DOI:10.1016/j.metabol.2013.08.015 (  0) 0) |
| [13] |
中华医学会儿科学分会内分泌遗传代谢病学组. 先天性肾上腺皮质增生症21羟化酶缺陷诊治共识[J]. 中华儿科杂志, 2016, 54(8): 569-576. (  0) 0) |
| [14] |
Xu S, Hu S, Yu X, et al. 17α hydroxylase/17, 20 lyase deficiency in congenital adrenal hyperplasia:A case report[J]. Mol Med Rep, 2017, 15(1): 339-344. DOI:10.3892/mmr.2016.6029 (  0) 0) |
| [15] |
Fernández-Cancio M, García-García E, González-Cejudo C, et al. Discordant genotypic sex and phenotype variations in two spanish siblings with 17α-Hydroxylase/17, 20-Lyase deficiency carrying the most prevalent mutated CYP17A1 alleles of Brazilian patients[J]. Sex Dev, 2017, 11(2): 70-77. DOI:10.1159/000468160 (  0) 0) |
| [16] |
Turan S, Bereket A, Guran T, et al. Puberty in a case with novel 17-hydroxylase mutation and the putative role of estrogen in development of pubic hair[J]. Eur J Endocrinol, 2009, 160(2): 325-330. (  0) 0) |
| [17] |
Kim SM, Rhee JH. A case of 17 alpha-hydroxylase deficiency[J]. Clin Exp Reprod Med, 2015, 42(2): 72-76. DOI:10.5653/cerm.2015.42.2.72 (  0) 0) |
| [18] |
Jiang JF, Xue W, Deng Y, et al. Gonadal malignancy in 202 female patients with disorders of sex development containing Y-chromosome material[J]. Gynecol Endocrinol, 2016, 32(4): 338-341. DOI:10.3109/09513590.2015.1116509 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


