2. 四川大学华西第二医院临床营养科, 四川 成都 610041;
3. 四川大学华西第二医院临床产科, 四川 成都 610041
近年来,儿童过敏性疾病的发病率呈上升趋势,WHO已将其列为“二十一世纪重点防治的三大疾病之一”,主要包括湿疹、过敏性鼻炎、过敏性皮炎、哮喘等[1]。“卫生假说”认为生命早期因环境微生物暴露减少,引起免疫系统发育不成熟,从而增加患过敏性疾病的可能性[2]。婴儿出生后0~1岁是肠道菌群发育成熟的重要时期,多数研究指出婴儿出生后第一年肠道菌群紊乱与食物过敏、哮喘等过敏性疾病的发生有关[3-5]。
双歧杆菌是人体肠道微生物的重要组成部分,也是婴儿肠道最早出现的有益菌、优势菌群之一,对维持人体健康具有极其重要的作用[6]。已有研究表明,宿主肠道的双歧杆菌可促进婴儿免疫系统的发育和成熟,其菌种构成及多样性对过敏性疾病的影响受到广泛关注[7-9]。
然而,国内外对过敏婴儿肠道双歧杆菌的研究主要为属水平上的鉴定,多为单一时间点横断面研究,影响过敏性疾病的关键时期尚不清楚。为了全面地观察过敏组婴儿双歧杆菌的定植时间、种类及数量情况,本研究采用实时荧光定量PCR的方法,对0~1岁健康组和过敏组婴儿在不同时间点粪便中的双歧杆菌属及人体最常见的8种双歧杆菌菌种进行定性及定量检测,系统地比较健康组与过敏组婴儿肠道双歧杆菌的构建规律,探讨婴儿肠道双歧杆菌影响过敏性疾病的关键期,为婴儿过敏性疾病的防治提供理论依据。
1 资料与方法 1.1 研究对象及样本采集选取2015年出生于四川大学华西第二医院的正常足月新生儿48例为研究对象,根据1岁以内是否患过敏性疾病分为健康组(n=26)和过敏组(n=22)。用无菌粪便收集管采集新生儿出生后第0(胎便)、2、7、15天,以及生后1、6、12月时共7次新鲜粪便样品,采集粪便后立即暂存于-20℃,24~48 h内转移至-80℃超低温冰箱待测,共收集粪便样品292份(表 1)。通过问卷调查和统计学比较,两组婴儿的基础人口学信息(性别、生产方式、喂养方式、家族过敏性疾病史、母亲孕期服用益生菌)差异均无统计学意义(表 2)。
| 表 1 健康组与过敏组婴儿不同时间点的粪便样品数 |
|
|
| 表 2 健康组与过敏组婴儿的基础人口信息比较 |
|
|
健康组纳入标准:(1)婴儿0~1岁间的粪便样品采样率达到80%;(2)1岁以前未患过敏性疾病。
过敏组纳入标准:(1)婴儿0~1岁间的粪便样品采样率达到80%;(2)1岁以前经县级以上医院确诊为过敏性疾病(包括湿疹、食物过敏、药物过敏、过敏性哮喘等)中任意一种的患儿[10-11]。
两组排除标准均为:(1)新生儿患严重疾病或先天性疾病;(2)婴儿0~1岁间因各种原因服用抗生素;(3)婴儿0~1岁间行肠道侵入性检查或治疗。
本研究遵循赫尔辛基原则,经医院伦理委员会批准,并由纳入对象的父亲或母亲签署知情同意书。
1.3 材料和试剂粪便细菌基因组DNA提取试剂盒(北京天根生化科技有限公司);引物合成(上海生工生物工程有限公司)、SYBR Premix Ex TaqTMⅡ(大连宝生物工程有限公司);八联管(上海生工生物工程有限公司);双歧杆菌标准菌株(日本理化学研究所微生物保存施设);实时荧光定量PCR仪(美国BIO-RAD公司)。
1.4 粪便样品基因组DNA提取称取200 mg粪便,按照粪便细菌基因组DNA提取试剂盒实验步骤提取,最终获得50 μL DNA溶液,-80℃保存备用。
1.5 实时荧光定量PCR检测针对双歧杆菌菌种的特定基因,分别选取双歧杆菌属及人体肠道特有的8种不同的双歧杆菌种引物(表 3)进行实时荧光定量PCR检测。采用25 μL体系进行实时荧光定量PCR反应,包括SYBR Premix Ex TaqTMⅡ 12.5 μL,上、下游引物(10 μmol/L)各1.0 μL,ddH2O 8.5 μL,模板DNA 2.0 μL。反应条件为:95℃预变性10 s;94℃变性20 s,55℃退火20 s,72℃延伸50 s,共40个循环。每次实验均设立阴性对照,同时做熔解曲线,检查有无非特异性扩增。采用文献[12]的方法,根据标准曲线及提取过程得到浓度的换算方程式,对粪便样品基因组DNA的Ct值进行细菌浓度换算,计算每克粪便样品中的细菌浓度。各双歧杆菌菌种的检出限在104~107 CFU/g之间。
| 表 3 双歧杆菌属/种PCR特异性引物序列 |
|
|
采用SPSS 22.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,两组双歧杆菌检出数量比较采用独立样本t检验;两组各时间点双歧杆菌检出菌种数比较采用重复测量资料的混合线性模型。计数资料以率(%)表示,两组双歧杆菌检出率比较采用卡方检验或Fisher确切概率法,P < 0.05为差异有统计学意义。
2 结果 2.1 健康组与过敏组婴儿双歧杆菌检出率比较在双歧杆菌属水平上,健康组婴儿胎便中双歧杆菌属的检出率为33%;第2天时,检出率为14%,与第0天比有降低趋势,但差异无统计学意义(P > 0.05);第7、15天和1月时的检出率分别为44%、55%,96%,6月及12月时的检出率为100%,与第0天比检出率均增加,且从第1月起差异有统计学意义(P < 0.05)。过敏组婴儿胎便中双歧杆菌属的检出率较低,为6%;第2、7、15天和1月时的检出率分别为16%、42%、53%,95%,6月及12月时的检出率为100%,与第0天比检出率逐渐升高,从第7天起差异有统计学意义(P < 0.05)。见表 4。
| 表 4 健康组与过敏组婴儿双歧杆菌属的检出率比较 |
|
|
在双歧杆菌种水平上,健康组婴儿最早定植的种类(在第0天检出)是B.adolescentis、B.breve、B.catenulatum、B.bifidum、B.infantis、B.dentium,其中,B.bifidum、B.infantis、B.breve的检出率随时间变化情况与双歧杆菌属类似(图 1);过敏组婴儿最早定植的种类是B.angulatum、B.breve、B.catenulatum、B.bifidum、B.dentium,其中,B.longum、B.infantis、B.breve的检出率随时间变化情况与双歧杆菌属类似(图 2)。在第15天时,健康组的B.breve检出率(59%)高于过敏组(26%,χ2=4.447,P < 0.05),其他双歧杆菌菌种的检出率在两组各时间点比较差异均无统计学意义(P > 0.05)。
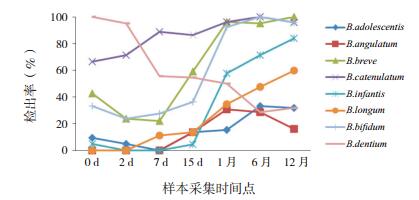
|
图 1 健康组婴儿8种双歧杆菌的检出率 |
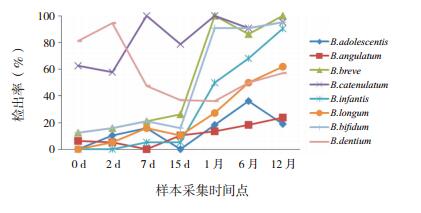
|
图 2 过敏组婴儿8种双歧杆菌的检出率 |
两组婴儿双歧杆菌检出菌种数的混合线性模型分析结果显示,过敏组和健康组之间的菌种数差异无统计学意义(P=0.552),但两组各时间点之间差异有统计学意义(P < 0.001)(表 5)。
| 表 5 混合线性模型的固定效应 |
|
|
根据重复测量资料的两两比较分析结果显示,健康组婴儿胎便中双歧杆菌平均检出种类数为3.0种,其中检出菌种数为2种的最多(共9例)。第2天时,平均检出菌种数为2.3种,与第0天比有降低趋势,但差异无统计学意义(P > 0.05)。第7、15天的婴儿粪便中双歧杆菌平均检出种类数分别为2.5、3.4种,检出种数多为1种或2种,检出4种及以上菌种的情况较少。第1月时,检出菌种数明显增加;第6月时达到定植种类高峰,检出菌种数为4~8种;第12月与第6月基本一致,平均检出菌种数为6.4种。从第1月起与第0天相比检出菌种数明显增加(P < 0.05)。
过敏组婴儿胎便中双歧杆菌平均检出菌种数为1.8种,其中检出菌种数为2种的最多(共8例)。第2、7、15天的婴儿粪便中双歧杆菌平均检出菌种数分别为2.2、2.7、2.4种,检出菌种数多为1种或2种,检出4种及以上菌种的情况较少。第1、6、12月检出5种及以上双歧杆菌菌种的婴儿占多数,平均为5.3、6.6、6.6种;至第12月时,7种检出者最多(共10例)。第2天及之后的检出菌种数均高于第0天,从第1月起与第0天相比检出菌种数差异有统计学意义(P < 0.05)。在第0天时,健康组双歧杆菌检出菌种数有高于过敏组的趋势,但差异无统计学意义(P > 0.05)。见表 6,图 3。
| 表 6 健康组与过敏组婴儿双歧杆菌检出菌种数比较 |
|
|
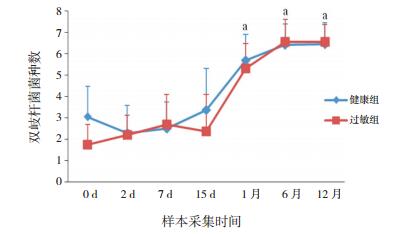
|
图 3 健康组与过敏组婴儿双歧杆菌检出菌种数比较 a示与第0天相比,P < 0.05。 |
在第1月时,健康组的双歧杆菌属平均检出量(2.1×108 CFU/g)高于过敏组(3.0×107 CFU/g)(P < 0.05)。第6月和第12月两组双歧杆菌属检出量比较差异均无统计学意义(P > 0.05)。见表 7。
| 表 7 健康组与过敏组婴儿双歧杆菌属检出量比较 |
|
|
随着过敏性疾病发病率的逐年上升,过敏性疾病的早期防治受到了高度重视。双歧杆菌是婴儿肠道菌群的优势菌群之一,有研究指出其数量和多样性可能与婴儿免疫系统的发育有关,从而与过敏性疾病发生相关[6-7, 13]。本研究采用实时荧光定量PCR的方法,设计了前密后疏的多个时间点,从检出率、检出菌种数及检出数量方面比较健康组与过敏组婴儿肠道双歧杆菌属及8个种的构建规律,探讨双歧杆菌构建规律与过敏性疾病发生的关系及其影响过敏性疾病的关键时期。
在双歧杆菌检出率方面,本研究发现健康组婴儿0~1岁双歧杆菌属的构建规律为出生时即携带双歧杆菌属,在出生后第2天检出率呈下降趋势,之后又回升的“重建”特征,并在1月至1岁趋于稳定,检出率基本达到100%。与健康组婴儿相比,过敏组婴儿0~1岁双歧杆菌属的构建规律为出生时双歧杆菌属携带较少,且随时间的增加而逐渐升高,整个过程未出现“重建”特征,仍在1月至1岁趋于稳定。在双歧杆菌数量方面,本研究发现过敏组婴儿第1月检出双歧杆菌属的菌量显著低于健康组婴儿,说明过敏组婴儿双歧杆菌属的检出率虽然在第1月时与健康组婴儿相当,但仍无法达到健康组婴儿同水平的菌量。在双歧杆菌菌种数方面,在第0天时,过敏组婴儿双歧杆菌菌种数有低于健康组的趋势,提示其出生时双歧杆菌多样性较低。并且,两组婴儿菌种数表现出与检出率类似的构建规律。
传统研究认为,双歧杆菌在婴儿出生后开始定植,并持续存在于婴儿肠道内[12, 14]。近期也有研究发现,健康新生儿的母亲孕期羊水、胎盘、胎膜及脐血中也有细菌存在[15]。本研究发现双歧杆菌在健康组婴儿胎便中即存在,但过敏组婴儿胎便中则检出率较低,推测该差异可能在出生前便存在,提示婴儿肠道双歧杆菌的构建始点和差异可能追溯到母亲子宫内,母体内的构建规律还有待进一步研究。目前,多数研究主要为比较健康婴儿与过敏婴儿双歧杆菌的时间点横断面差异[16],而未比较其构建过程的动态变化。本研究发现两组婴儿出生后双歧杆菌的构建过程也存在差异,健康组婴儿的双歧杆菌并非在出生后持续存在,而是在第2天后呈现重新构建的过程;而过敏组婴儿的双歧杆菌在出生后呈现从少到多的构建过程,不存在重建过程。由此推测双歧杆菌的重建过程也可能是影响过敏性疾病发生的潜在因素,但其重建机制有待进一步研究。
最近的一项系统综述和Meta分析显示,母亲在妊娠后期和(或)婴儿出生后1个月内使用益生菌能明显降低发生湿疹的风险[17]。本研究显示两组婴儿的双歧杆菌差异和构建规律差异主要集中在出生后0~1月,提示0~1月可能是婴儿出生后过敏性疾病防治的关键期。
本研究的双歧杆菌种水平结果显示,两组婴儿出生后B.infantis和B.breve的构建规律均与其双歧杆菌属水平类似。近年研究指出,B.infantis和B.breve属于婴儿型双歧杆菌,具有调节免疫平衡、抗炎症作用,是健康婴儿肠道中主要的双歧杆菌菌种[14, 18]。双歧杆菌菌种变化与过敏、代谢疾病等炎症性疾病有密切的关系,不同双歧杆菌的免疫调节特性不同[12]。有研究显示,低过敏性疾病发病率地区的婴儿粪便中主要检测出B.infantis,B.infantis的定植可能与过敏性疾病低发病率有关。本研究结果与之相似,过敏组婴儿的B.infantis相比健康组定植延迟,在第7天才被检出。此外,第15天时过敏组婴儿B.breve的检出率显著低于健康组婴儿,提示婴儿在生命早期低水平B.breve可能与过敏性疾病有关。其中,B.infantis的结果与多数研究相似,例如Young等[19]发现B.infantis是加纳过敏性疾病低发生率婴儿主要的双歧杆菌菌种。但B.breve在其他类似研究中少有提到,推测可能是因为不同地区的饮食习惯、环境因素等差异导致不同地区婴儿肠道中重要菌种有所不同。例如He等[18]发现健康婴儿肠道中具有典型的婴儿型双歧杆菌,主要为B.bifidum,而过敏患儿主要定植B.adolescentis。Akay等[20]发现土耳其过敏儿童的粪便样品中仅有B.longum的检出率显著低于健康儿童。B.longum是英国和新西兰(过敏性疾病发生率较高)婴儿主要的双歧杆菌菌种。综上,本研究提示B.infantis和B.breve可能是成都地区婴儿比较重要的双歧杆菌菌种,其对该地区婴儿过敏性疾病的早期防治可能具有关键作用。
综合上述研究结果,发现过敏组婴儿肠道双歧杆菌与健康组婴儿在出生时即存在差异,其后两组婴儿肠道双歧杆菌的构建规律也存在差异,该差异主要集中在0~1个月,且主要差异菌种为B.infantis和B.breve。因此,婴儿出生后0~1月的肠道双歧杆菌及其构建规律可能与过敏性疾病的发生有关,该时期可能是婴儿出生后过敏性疾病的防治关键期。上述结果为婴儿过敏性疾病的早期预防提供了理论依据,有利于进一步研究如何通过调节婴儿肠道菌群防治过敏性疾病。
基于本研究结果,为进一步探讨婴儿肠道双歧杆菌在过敏性疾病中的作用,应多中心、扩大样本量,并结合有机酸代谢组学、生理性免疫指标的研究。此外,还可继续观察该群体小孩在1岁后的肠道菌群变化,进行更全面、长远的研究。
志谢: 本研究由公共卫生与预防医学省级实验教学中心和食品安全监测与风险评估四川省重点实验室支持。
| [1] |
Warner JO, Kaliner MA, Crisci CD, et al. Allergy practice worldwide:a report by the World Allergy Organization Specialty and Training Council[J]. Int Arch Allergy Immunol, 2006, 139(2): 166-174. DOI:10.1159/000090502 (  0) 0) |
| [2] |
Strachan DP. Hay fever, hygiene, and household size[J]. BMJ, 1989, 299(6710): 1259-1260. DOI:10.1136/bmj.299.6710.1259 (  0) 0) |
| [3] |
Bokulich NA, Chung J, Battaglia T, et al. Antibiotics, birth mode, and diet shape microbiome maturation during early life[J]. Sci Transl Med, 2016, 8(343): 343ra82. DOI:10.1126/scitranslmed.aad7121 (  0) 0) |
| [4] |
Ling Z, Li Z, Liu X, et al. Altered fecal microbiota composition associated with food allergy in infants[J]. Appl Environ Microbiol, 2014, 80(8): 2546-2554. DOI:10.1128/AEM.00003-14 (  0) 0) |
| [5] |
Stokholm J, Blaser MJ, Thorsen J, et al. Maturation of the gut microbiome and risk of asthma in childhood[J]. Nat Commun, 2018, 9(1): 141. DOI:10.1038/s41467-017-02573-2 (  0) 0) |
| [6] |
Rautava S, Luoto R, Salminen S, et al. Microbial contact during pregnancy, intestinal colonization and human disease[J]. Nat Rev Gastroenterol Hepatol, 2012, 9(10): 565-576. DOI:10.1038/nrgastro.2012.144 (  0) 0) |
| [7] |
Fanaro S, Chierici R, Guerrini P, et al. Intestinal microflora in early infancy:composition and development[J]. Acta Paediatr Suppl, 2003, 91(441): 48-55. (  0) 0) |
| [8] |
Bisgaard H, Li N, Bonnelykke K, et al. Reduced diversity of the intestinal microbiota during infancy is associated with increased risk of allergic disease at school age[J]. J Allergy Clin Immunol, 2011, 128(3): 646-652. DOI:10.1016/j.jaci.2011.04.060 (  0) 0) |
| [9] |
Nylund L, Satokari R, Nikkilä J, et al. Microarray analysis reveals marked intestinal microbiota aberrancy in infants having eczema compared to healthy children in at-risk for atopic disease[J]. BMC Microbiol, 2013, 13: 12. DOI:10.1186/1471-2180-13-12 (  0) 0) |
| [10] |
中华医学会儿科学分会免疫学组. 婴儿过敏性疾病预防、诊断和治疗专家共识[J]. 中华儿科杂志, 2009, 47(11): 835-838. DOI:10.3760/cma.j.issn.0578-1310.2009.11.009 (  0) 0) |
| [11] |
刘光辉. 过敏性疾病诊疗指南[M]. 北京: 科学出版社, 2013.
(  0) 0) |
| [12] |
何苗, 李鸣, 王舒悦, 等. 使用实时荧光定量PCR解析婴儿肠道双歧杆菌构建规律[J]. 四川大学学报(医学版), 2016, 47(4): 527-532. (  0) 0) |
| [13] |
Sjögren YM, Tomicic S, Lundberg A, et al. Influence of early gut microbiota on the maturation of childhood mucosal and systemic immune responses[J]. Clin Exp Allergy, 2009, 39(12): 1842-1851. DOI:10.1111/j.1365-2222.2009.03326.x (  0) 0) |
| [14] |
Nagpal R, Kurakawa T, Tsuji H, et al. Evolution of gut Bifidobacterium population in healthy Japanese infants over the first three years of life:a quantitative assessment[J]. Sci Rep, 2017, 7(1): 10097. DOI:10.1038/s41598-017-10711-5 (  0) 0) |
| [15] |
Martin R, Makino H, Cetinyurek Yavuz A, et al. Early-life events, including mode of delivery and type of feeding, siblings and gender, shape the developing gut microbiota[J]. PLoS One, 2016, 11(6): e0158498. DOI:10.1371/journal.pone.0158498 (  0) 0) |
| [16] |
杨成彬, 赵梅珍, 杨平常, 等. 肠道菌群与婴幼儿食物过敏的研究进展[J]. 实用临床医学, 2014, 15(8): 117-119. (  0) 0) |
| [17] |
Zuccotti G, Meneghin F, Aceti A, et al. Probiotics for prevention of atopic diseases in infants:systematic review and meta-analysis[J]. Allergy, 2015, 70(11): 1356-1371. DOI:10.1111/all.2015.70.issue-11 (  0) 0) |
| [18] |
He F, Ouwehand AC, Isolauri E, et al. Comparison of mucosal adhesion and species identification of bifidobacteria isolated from healthy and allergic infants[J]. FEMS Immunol Med Microbiol, 2001, 30(1): 43-47. DOI:10.1111/fim.2001.30.issue-1 (  0) 0) |
| [19] |
Young SL, Simon MA, Baird MA, et al. Bifidobacterial species differentially affect expression of cell surface markers and cytokines of dendritic cells harvested from cord blood[J]. Clin Diagn Lab Immunol, 2004, 11(4): 686-690. (  0) 0) |
| [20] |
Akay HK, Bahar Tokman H, Hatipoglu N, et al. The relationship between bifidobacteria and allergic asthma and/or allergic dermatitis:a prospective study of 0-3 years-old children in Turkey[J]. Anaerobe, 2014, 28: 98-103. DOI:10.1016/j.anaerobe.2014.05.006 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


