进行性家族性肝内胆汁淤积症2型(progressive familial intrahepatic cholestasis type Ⅱ, PFIC-2)是由ABCB11基因突变引起的遗传性胆汁淤积症,曾被称为Byler综合征[1-2]。ABCB11基因位于染色体2q24,共有28个外显子,除1号外显子外,其余外显子均参与编码位于肝细胞毛细胆管膜上的胆盐输出泵(bile salt export pump, BSEP)。BSEP蛋白由1 321个氨基酸组成,分子量约160 kDa,其功能是可作为三磷酸腺苷(ATP)依赖性胆汁酸转运体,通过水解ATP逆浓度梯度转运胆盐至毛细胆管内[3-4]。作为肝脏唯一具有胆盐转运功能的蛋白,BSEP蛋白表达水平和/或功能异常可严重影响胆盐分泌,引起肝内胆汁淤积[3]。PFIC-2患儿最突出的生化特点为γ-谷氨酰转肽酶(GGT)活性正常或偏低[1],这有别于一般的肝内胆汁淤积症。本病主要临床表现为黄疸、皮肤瘙痒、肝脾大、发育迟缓,病情往往进展迅速,几年之内可发展为终末期肝病;部分患者在婴儿期就需要肝移植,未接受肝移植的患者可能出现肝癌或胆管癌[5-7]。
目前已报道的与PFIC-2相关的ABCB11致病性变异约有150种,包括错义、缺失、插入、移码和无义变异等[8]。近年来国内该病相关的报道主要来自上海、北京、广州、武汉等中心城市的大型医院[9-12]。因此,PFIC-2诊治经验还需要大力推广普及,其临床和实验室特征也需要进一步研究总结。本文报道1例PFIC-2患儿的临床和遗传学特征,希望为PFIC-2的诊治进一步积累经验。
1 资料与方法 1.1 研究对象患儿,男,2.4月龄,因发现皮肤巩膜黄染2月余就诊。患儿生后第2天即出现皮肤、巩膜黄染,一直未消退。在当地医院查肝功能异常,予护肝等相关处理(具体不详),黄疸逐渐加重,并出现白陶土样大便及茶色尿。1.9月龄时于小儿外科就诊,体格检查发现除全身皮肤、巩膜黄染外,肝脏右肋下5 cm、质地中等,脾脏不大;丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、总胆红素(TBIL)、结合胆红素(DBIL)、总胆汁酸(TBA)均明显升高,但GGT不高,以“梗阻性黄疸”收入院。住院期间血串联质谱筛查发现游离肉碱显著增高,尿串联质谱及凝血功能无异常。磁共振胰胆管造影(MRCP)+上腹部MRI+呼吸门控检查未见明显器质性病变。住院后予积极抗炎、护肝、利胆治疗半个月,期间多次复查肝功能均无好转(见表 1)。为进一步明确诊断,转我院就诊。起病以来,精神反应一般,吃奶尚可。患儿系第2胎第2产,足月顺产出生,出生体重为3 650 g,身长51 cm。父母非近亲结婚,否认遗传性疾病家族史。其母孕期有皮肤瘙痒病史。祖母曾患胆结石。
| 表 1 患儿历次生化检查结果 |
|
|
体格检查:神清,反应可。皮肤、巩膜黄染,浅表淋巴结无肿大。头颅五官无畸形,前囟平软。双侧瞳孔等大等圆,对光反射灵敏。双肺呼吸音清,未闻及干湿啰音。心音有力,律齐,各瓣膜听诊区未闻及病理性杂音。腹不胀,肝右肋下3.0 cm、质地中等,脾不大。四肢肌张力正常,腹壁和膝腱反射可引出,克氏、布氏和巴氏征均阴性。
1.2 代谢性肝病组基因二代测序患儿生后第二天起病,肝功能提示梗阻性黄疸,但GGT基本正常,因此需要考虑遗传性胆汁淤积症,通过二代测序(NGS)技术查代谢性肝病组基因,以明确病因。
采集患儿外周静脉血2 mL(EDTA抗凝),用Mini kit试剂盒(Simgen公司,中国)提取基因组DNA,建立含有与代谢性肝病(包括胆汁淤积症)相关基因(ACADVL、B4GALT1、C10orf2、DBT、EARS2、FADD、SLC25A13、VIPAS39及VPS33B等共233个基因)的基因组文库。用液相捕获试剂盒(迈基诺公司,中国)捕获上述目标基因,采用新一代测序仪IlluminaHiSeq2000(Illumina公司,美国)进行高通量测序。测序平均深度不小于200。根据文献[13],将测序数据进行基因序列生物信息学分析。
1.3 Sanger测序验证突变提取患儿及其父母的外周血DNA,根据二代测序的检测结果,采用Sanger测序验证ABCB11突变基因。根据ABCB11基因的DNA序列,使用Primer Premier 5.0软件设计聚合酶链反应引物(如表 2,北京迈基诺基因科技股份有限公司合成)。聚合酶链反应体系:2×Goldstar Buffer Mix 10 μL,上、下游引物各1 μL,DNA 1 μL,灭菌双蒸水7 μL,共20 μL。反应条件参照文献[13]:95℃预变性10 min;随后分为4步,即第1步94℃变性30 s,62℃退火30 s,72℃延伸45 s,共3个循环;第2步94℃变性30 s,60℃退火30 s,72℃延伸45 s,共5个循环;第3步94℃变性30 s,58℃退火30 s,72℃延伸45 s,共10个循环;第4步94℃变性30 s,56℃退火30 s,72℃延伸45 s,共17个循环;最后再72℃延伸5 min。
| 表 2 Sanger测序验证ABCB11基因突变位点所在DNA序列的扩增和测序引物 |
|
|
通过Ensembl Genome Browser(http://www.ensembl.org)中人ABCB11基因的直系同源列表收集112个同源肽的氨基酸序列,然后使用BLAST / BLAT Ensembl软件(http:/ //www.ensembl.org/Multi/Tools/Blast?db=core)进行比对。
采用MutationTaster(http://www.mutationtaster.org/)、PROVEAN(http://provean.jcvi.org/seq_submit.php)、PolyPhen 2(http://genetics.bwh.harvard.edu/pph2/)、SIFT(http://sift.jcvi.org/www/SIFT_chr_coords_submit.html)等在线软件工具,预测变异的致病性。
为评估由ABCB11基因新型变异p.Val501Gly引起的蛋白质结构变化,使用SWISS-MODEL蛋白质建模服务器(https://swissmodel.expasy.org/)构建受影响的蛋白分子。将p.Val501野生型模型的第501位氨基酸由Val变成Gly进行模型能量最小化,并比对两者构象差异[13]。
本研究通过暨南大学附属第一医院医学伦理委员会批准,并获得患儿父母知情同意。
2 结果 2.1 遗传学分析NGS检测发现患儿ABCB11基因存在两个错义变异,分别为c.1493T > C(p.Ile498Thr)和c.1502T > G(p.Val501Gly),均位于该基因的外显子14(图 1)。前者为文献[14]报道的致病性变异。

|
图 1 患儿外显子捕获测序截图 ABCB11基因互补链c.1502位点的腺嘌呤A部分突变为胞嘧啶C,c.1493位点的腺嘌呤A部分突变为鸟嘌呤G。 |
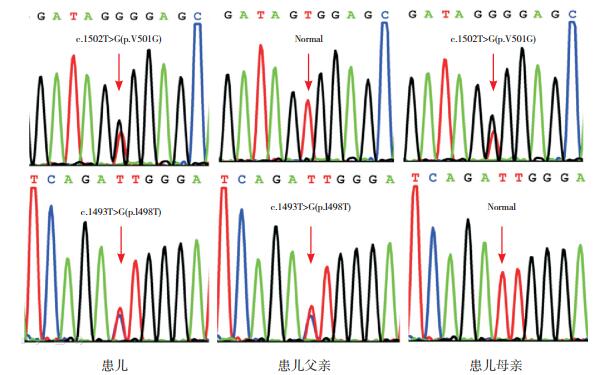
进一步通过Sanger测序验证,确认患儿以上变异,并证实两个变异分别来自其父母,见图 2。
|
图 2 患儿及其父母ABCB11基因突变的Sanger测序 患儿系c.1502T > G和c.1493T > C的复合杂合子,其父为c.1493T > C突变携带者,其母为c.1502T > G突变携带者。突变位点如箭头所示。 |
在千人基因组计划(http://browser.1000genomes.org)、人类基因突变数据库(http://www.hgmd.cf.ac.uk/ac/index.php)、外显子组测序项目(https://esp.gs.washington.edu/drupal/)中均未检索到c.1502T > G(p.Val501Gly)变异,查阅中国知网、PubMed等文献数据库,也未见该变异的文献报道。
c.1502T > G(p.Val501Gly)的MutationTaster软件预测得分109,提示具有致病性;PROVEN预测得分-6.036,提示该变异有害;PolyPhen-2预测得分为1.000,提示可能有害;而SIFT软件预测得分为0,提示变异对蛋白质的功能有影响。
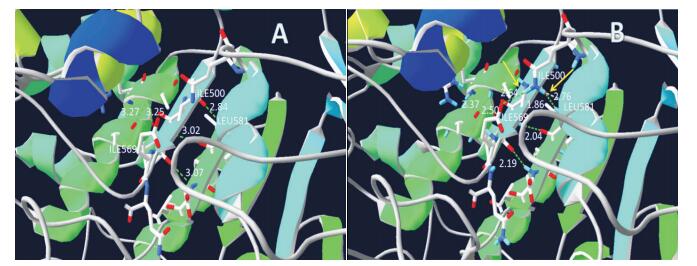
c.1502T > G变异累及的p.Val501氨基酸残基在从低等单细胞生物到灵长类动物的112个物种的BSEP同源肽中高度保守。图 3显示39种代表性物种同源肽氨基酸序列的比较排序结果,可见人类BSEP蛋白同源肽的相应位点氨基酸均为缬氨酸。采用SWISS-Pdb Viewer 4.1.0软件预测发现,该变异使得第501位氨基酸由缬氨酸变成甘氨酸,使其附近氨基酸之间的氢键距离改变,同时伴有新的氢键生成,见图 4。

|
图 3 39个代表性物种BSEP蛋白同源肽比较排序 ABCB11基因变异c.1502T > G累及的p.Val501氨基酸残基(红色标记的V)从低等单细胞生物到灵长类动物均高度保守。 |
|
图 4 p.Val501Gly突变前后BSEP蛋白空间结构预测图 图A为野生型BSEP蛋白结构模型,图B为突变后蛋白结构模型。第501位氨基酸由缬氨酸(A)变为甘氨酸(B),附近氨基酸之间的氢键距离发生改变(虚线表示氢键,白色数字为氢键距离),同时伴有新的氢键生成(图B黄色箭头所示为新生氢键,分别在p.ILE500和p.ILE569以及p.ILE500和p.LEU581之间生成)。 |
本研究患儿经NGS及Sanger测序验证,最终确诊为ABCB11基因突变导致的PFIC-2。予熊去氧胆酸口服治疗,并随访至3.8月龄,患儿黄疸和肝肿大等临床表现无改善,转氨酶、胆红素和胆汁酸等仍显著异常,但GGT基本正常(表 1)。3.8月龄以后失访,结局不明。
3 讨论进行性家族性肝内胆汁淤积症(PFIC)是一组以肝内胆汁淤积为主要表现的遗传性疾病。根据致病基因不同,可将PFIC分为PFIC1、PFIC2和PFIC3等类型,分别由ATP8B1、ABCB11和ABCB4等基因突变引起。PFIC1、PFIC2和PFIC3皆可表现为黄疸和瘙痒,但前两者GGT基本正常,PFIC2进展较PFIC1剧烈、但无PFIC1的肝外症状;PFIC3瘙痒症状较轻,但GGT水平持续增高,可与其它两型区分。近年来,越来越多的PFIC类型被发现,此类疾病的确诊不能仅仅依靠临床表现和血生化结果,基因诊断被认为是确诊此类疾病的最可靠依据[1, 15-17]。
本研究患儿胆汁淤积症表现典型,但GGT基本正常,不符合胆道闭锁特点而高度提示遗传性肝病。有类似临床特征的遗传胆汁淤积症病因复杂,已报道的致病基因多达数百个,因此通过NGS查找病因。结果发现患儿为ABCB11基因c.1493T > C(p.Ile498Thr)和c.1502T > G(p.Val501Gly)的复合杂合子,分别来自父母。前者为已报道的致病变异[14];后者未见文献报道,但多种生物信息学软件分析均提示该变异具有致病性。有研究表明,ABCB11错义变异的携带者临床表现可为良性复发性的肝内胆汁淤积2型(BRIC-2),怀孕为胆汁淤积的诱发因素[18]。值得注意的是,患儿母亲携带新变异c.1502T > G(p.Val501Gly),孕期有皮肤瘙痒病史(孕期生化检查结果缺如),也提示新变异具有致病性可能。有文献报道,游离肉碱水平增高可见于肉碱棕榈酰转移酶-1缺乏症、继发于肝功能损伤、也可继发于口服或静滴左卡尼丁等情况[19]。本例患儿的血串联质谱筛查游离肉碱显著增高,考虑继发于PFIC-2引起的肝功能损伤。
BSEP蛋白由2个跨膜结构域和2个核苷酸结合折叠区组成,每一个跨膜结构域含6个跨膜区,而每一个核苷酸结合折叠区均包含1个高度保守的ATP结合盒(ABC),其中第一个ATP结合盒位于p.Asp482与p.Arg575之间。本例患儿检出的ABCB11新变异c.1502T > G(p.Val501Gly)累及的氨基酸残基就位于第一个ATP结合盒附近,可能影响BSEP蛋白与ATP结合,导致胆汁酸的转运异常,从而导致黄疸和肝大等肝内胆汁淤积表现[20]。生物信息学分析也表明,p.Val501Gly突变可以扭曲BSEP蛋白分子结构影响其胆盐转运功能。BSEP蛋白在内质网合成和折叠,糖基化后被转运至肝细胞胆管膜发挥转运胆盐的功能。据报道,错义变异p.Glu297Gly和p.Asp482Gly均可导致BSEP的错误折叠而滞留在内质网,而滞留在内质网的BSEP蛋白由于不稳定被降解,导致肝细胞胆管膜上的BSEP蛋白减少[21-22]。本文发现的新错义变异也可能通过类似机制导致BSEP蛋白不能正常到达肝细胞胆管膜并发挥功能。
PFIC-2的内科治疗主要包括熊去氧胆酸和利福平。低GGT水平的PFIC患者约有35%~40%对熊去氧胆酸有效。利福平可缓解某些患者的瘙痒症状,但对降低PFIC-2患者血清胆红素和转氨酶升高无长期作用[23-24]。其他药物,如苯扎贝特和S-腺苷蛋氨酸的疗效尚待进一步验证[25]。一些PFIC-2患者可从外科胆汁分流术获益[4]。对于上述治疗失败进展到终末期肝病的PFIC-2患者,可考虑肝移植。肝移植可有效缓解黄疸等胆汁淤积症状,改善患儿的生长发育迟缓[26]。个别PFIC-2患者肝移植后复发,并检测到抗BSEP的自身抗体,这种情况在严重的ABCB11突变中容易出现[27]。PFIC-2患儿有相当大的风险进展为肝肿瘤,因此建议婴儿期早期确诊和临床干预[28]。遗憾的是,本研究患儿确诊后失访,无法得知其结局。
综上所述,本文报道1例PFIC-2患儿,具有典型的黄疸、肝大和肝功异常等胆汁淤积症特征,而GGT正常。新变异c.1502T > G(p.Val501Gly)的发现为确诊和家系遗传咨询提供了遗传学依据。
| [1] |
Vitale G, Gitto S1, Raimondi F, et al. Cryptogenic cholestasis in young and adults:ATP8B1, ABCB11, ABCB4, and TJP2 gene variants analysis by high-throughput sequencing[J]. J Gastroenterol, 2018, 53(8): 945-958. DOI:10.1007/s00535-017-1423-1 (  0) 0) |
| [2] |
田辉. 进行性家族性肝内胆汁淤积症的最新研究进展[J]. 实用肝脏病杂志, 2009, 12(6): 477-480. DOI:10.3969/j.issn.1672-5069.2009.06.031 (  0) 0) |
| [3] |
Chan J, Vandeberg JL. Hepatobiliary transport in health and disease[J]. Clin Lipidol, 2012, 7(2): 189-202. DOI:10.2217/clp.12.12 (  0) 0) |
| [4] |
Kubitz R, Dröge C, Stindt J, et al. The bile salt export pump (BSEP) in health and disease[J]. Clin Res Hepatol Gastroenterol, 2012, 36(6): 536-553. DOI:10.1016/j.clinre.2012.06.006 (  0) 0) |
| [5] |
邓宝成, 刘沛. 进行性家族性肝内胆汁淤积症的研究现状[J]. 临床肝胆病杂志, 2015, 31(10): 1599-1604. DOI:10.3969/j.issn.1001-5256.2015.10.009 (  0) 0) |
| [6] |
Brinkert F, Pukite I, Krebs-Schmitt D, et al. Allogeneic hematopoietic stem cell transplantation eliminates alloreactive inhibitory antibodies after liver transplantation for bile salt export pump deficiency[J]. J Hepatol, 2018, https://doi.org/10.1016/j.jhep.2018.06.003.
(  0) 0) |
| [7] |
Alsalloom A. Hepatocellular carcinoma in a boy with progressive familial intrahepatic cholestasis type Ⅱ:Challenging identification:Case report[J]. Int J Health Sci (Qassim), 2013, 7(2): 252-255. DOI:10.12816/0006048 (  0) 0) |
| [8] |
Dröge C, Schaal H, Engelmann G, et al. Exon-skipping and mRNA decay in human liver tissue:molecular consequences of pathogenic bile salt export pump mutations[J]. Sci Rep, 2016, 6: 24827. DOI:10.1038/srep24827 (  0) 0) |
| [9] |
李晓峰, 龚敬宇, 王建设. 胆汁酸的肠肝循环与胆汁淤积性肝病[J]. 临床肝胆病杂志, 2017, 33(10): 1922-1927. DOI:10.3969/j.issn.1001-5256.2017.10.014 (  0) 0) |
| [10] |
刘圣烜, 黄志华, 董琛. 婴儿胆汁淤积症1106例临床分析[J]. 中国实用儿科杂志, 2013, 28(8): 585-589. (  0) 0) |
| [11] |
陆怡, 刘丽艳, 王晓红, 等. 低血清谷氨酸转肽酶进行性家族性肝内胆汁淤积症23例临床分析[J]. 中国循证儿科杂志, 2012, 7(3): 172-177. DOI:10.3969/j.issn.1673-5501.2012.03.003 (  0) 0) |
| [12] |
李龙, 刘垚. 进行性家族性肝内胆汁淤积症外科治疗[J]. 中国实用儿科杂志, 2013, 28(4): 260-262. (  0) 0) |
| [13] |
程映, 梁红, 蔡娜莉, 等. 微绒毛包涵体病一家系临床特点和MYO5B基因突变分析[J]. 中国当代儿科杂志, 2017, 19(9): 968-974. (  0) 0) |
| [14] |
Lam CW, Cheung KM, Tsui MS, et al. A patient with novel ABCB11 gene mutations with phenotypic transition between BRIC2 and PFIC2[J]. J Hepatol, 2006, 44(1): 240-242. DOI:10.1016/j.jhep.2005.09.013 (  0) 0) |
| [15] |
Gomez-Ospina N, Potter CJ, Xiao R, et al. Mutations in the nuclear bile acid receptor FXR cause progressive familial intrahepatic cholestasis[J]. Nat Commun, 2016, 7: 10713. DOI:10.1038/ncomms10713 (  0) 0) |
| [16] |
舒赛男, 骆冉. 进行性家族性肝内胆汁淤积症诊治及研究进展[J]. 中国实用儿科杂志, 2013, 28(4): 300-304. (  0) 0) |
| [17] |
Qiu YL, Gong JY, Feng JY, et al. Defects in myosin VB are associated with a spectrum of previously undiagnosed low γ-glutamyltransferase cholestasis[J]. Hepatology, 2017, 65(5): 1655-1669. DOI:10.1002/hep.29020 (  0) 0) |
| [18] |
van Mil SW, van der Woerd WL, van der Brugge G, et al. Benign recurrent intrahepatic cholestasis type 2 is caused by mutations in ABCB11[J]. Gastroenterology, 2004, 127(2): 379-384. DOI:10.1053/j.gastro.2004.04.065 (  0) 0) |
| [19] |
韩连书. 遗传代谢病检测技术的应用及其结果的临床判读[J]. 中国实用儿科杂志, 2014, 29(8): 569-574. (  0) 0) |
| [20] |
Strautnieks SS, Bull LN, Knisely AS, et al. A gene encoding a liver-specific ABC transporter is mutated in progressive familial intrahepatic cholestasis[J]. Nat Genet, 1998, 20(3): 233-238. DOI:10.1038/3034 (  0) 0) |
| [21] |
Jacquemin E, Hermans D, Myara A, et al. Ursodeoxycholic acid therapy in pediatric patients with progressive familial intrahepatic cholestasis[J]. Hepatology, 1997, 25(3): 519-523. DOI:10.1002/(ISSN)1527-3350 (  0) 0) |
| [22] |
Stapelbroek JM, van Erpecum KJ, Klomp LW, et al. Liver disease associated with canalicular transport defects:current and future therapies[J]. J Hepatol, 2010, 52(2): 258-271. DOI:10.1016/j.jhep.2009.11.012 (  0) 0) |
| [23] |
Misawa T, Hayashi H, Sugiyama Y, et al. Discovery and structural development of small molecules that enhance transport activity of bile salt export pump mutant associated with progressive familial intrahepatic cholestasis type 2[J]. Bioorg Med Chem, 2012, 20(9): 2940-2949. DOI:10.1016/j.bmc.2012.03.016 (  0) 0) |
| [24] |
Wang L, Dong H, Soroka CJ, et al. Degradation of the bile salt export pump at endoplasmic reticulum in progressive familial intrahepatic cholestasis type Ⅱ[J]. Hepatology, 2008, 48(5): 1558-1569. DOI:10.1002/hep.22499 (  0) 0) |
| [25] |
Nagasaka H, Yorifuji T, Hirano K, et al. Effects of bezafibrate on dyslipidemia with cholestasis in children with familial intrahepatic cholestasis-1 deficiency manifesting progressive familial intrahepatic cholestasis[J]. Metabolism, 2009, 58(1): 48-54. DOI:10.1016/j.metabol.2008.08.005 (  0) 0) |
| [26] |
Aydogdu S, Cakir M, Arikan C, et al. Liver transplantation for progressive familial intrahepatic cholestasis:clinical and histopathological findings, outcome and impact on growth[J]. Pediatr Transplant, 2007, 11(6): 634-640. DOI:10.1111/ptr.2007.11.issue-6 (  0) 0) |
| [27] |
Kubitz R, Dröge C, Kluge S, et al. Autoimmune BSEP disease:disease recurrence after liver transplantation for progressive familial intrahepatic cholestasis[J]. Clin Rev Allergy Immunol, 2015, 48(2-3): 273-284. DOI:10.1007/s12016-014-8457-4 (  0) 0) |
| [28] |
Srivastava A. Progressive familial intrahepatic cholestasis[J]. J Clin Exp Hepatol, 2014, 4(1): 25-36. DOI:10.1016/j.jceh.2013.10.005 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


