先天性肌营养不良1C型(congenital muscular dystrophy type 1C, MDC1C)是一种由Fukutin相关蛋白(Fukutin-related protein, FKRP)基因突变导致的、罕见的常染色体隐性遗传肌病,属于先天性肌营养不良(congenital muscular dystrophy, CMD)的亚型,在中国极为罕见。患儿在出生时或生后数周即出现严重肌营养不良表现[1]。现结合文献资料,回顾分析1例MDC1C患儿的临床和遗传学特点,并总结FKRP相关MDC1C的发病机制和临床表型特征。
1 资料与方法 1.1 病例介绍患儿,男,8个月,因发育落后就诊。主要表现为运动发育落后,翻身不佳、不会独坐、不会爬,竖头尚可,双手可抓物,可逗笑。患儿系第二胎第二产,足月顺产出生,出生体重3 200 g,否认窒息复苏史。新生儿期有黄疸,听力筛查、新生儿筛查无异常。父母健康,非近亲婚配,否认相关疾病家族史。其姐姐已10岁,目前健康。
体格检查:神清,体重8 200 g,表情刻板,双眼内斜视,前囟接近闭合,出牙4颗。双肺呼吸音清,未闻及干湿性啰音;心律齐,未闻及病理性杂音。腹软,肝脾肋下触及。肌张力低下,上、下肢腱反射均未引出,病理征(-)。
辅助检查:血清肌酸激酶稍高。血、尿筛查未发现异常。头颅MRI、视频脑电图未见明显异常。儿童神经心理发育量表:发育商70.4分,大运动37分,精细动作74.1分,适应能力80.3分,语言74.1分,社交行为86.7分,提示轻度智力低下。染色体非整倍体,拷贝数变异无异常。
1.2 基因测序为进一步明确病因,取患儿及其父母的静脉血各2 mL,置于含乙二胺四乙酸抗凝管,过柱法提取DNA,对遗传性神经肌肉相关疾病的基因外显子编码区进行二代测序(金域医学检验基因公司)。经生物信息学软件分析(包括错义突变分析软件:PolyPhen2、SIFT、LRT、MutationTaster、MutationAssessor、FATHMM、GERP、PhyloP、SiPhy和剪接改变分析软件:NetGene2 Server、AUGUSTUS)查找致病突变。
本研究经医院医学伦理委员会批准,并获得患儿父母知情同意。
2 结果基因测序结果如图 1显示,患儿FKRP基因第4号外显子存在c.350C > G和c.1303C > T复合错义突变。c.350C > G导致所编码蛋白质的第117位氨基酸残基由Pro变为Arg(p.Pro117Arg),患儿母亲为该位点的杂合子,其父该位点未见异常;c.1303C > T导致所编码蛋白质的第435位氨基酸残基由His变为Tyr(p.His435Tyr),患儿父亲为该位点的杂合子,其母该位点未见异常。c.350C > G为MDC1C的已知致病突变[2]。c.1303C > T的致病性尚未见报道,SIFT评分0.05,提示有害;PolyPhen2评分0.998,提示有害;LRT分析提示有害;Mutation Assessor分析提示良性。综合上述预测结果,判断此突变有致病性可能。
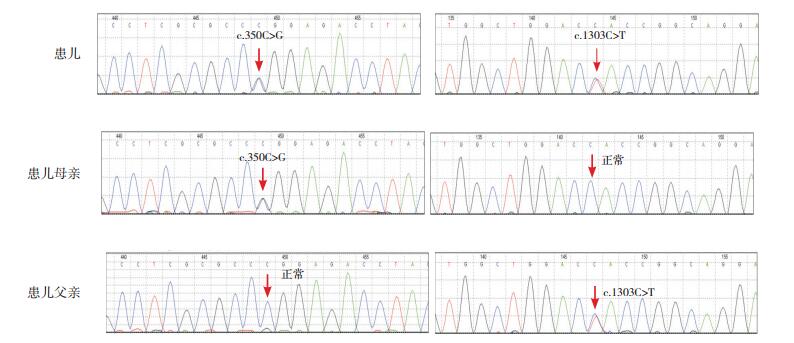
|
图 1 患儿及其父母的FKRP基因的Sanger测序图 患儿FKRP基因Exon4存在c.350C > G和c.1303C > T复合杂合子,c.350C > G来自于母亲,c.1303C > T来自于父亲。突变位点如箭头所示。 |
CMD是在出生时或生后数月内发病的一组临床异质性很强的肌肉病。基于致病基因FKRP纯合或复合杂合突变,MDClC被归属为细胞膜α-抗肌萎缩相关糖蛋白(α-dystroglycan, α-DG)缺陷型的CMD,本质在于α-DG糖基化低下[3]。
FKRP基因定位于染色体19q13.32上,由3个非编码内显子和一个包含部分5' UTR、全部的ORF和3' UTR的外显子组成,编码核糖醇5-磷酸转移酶[4]。5-磷酸转移酶是一种Ⅱ型跨膜蛋白,通过N-末端和跨膜结构域靶向锚定于高尔基体发挥作用,特异性介导α-DG翻译后修饰[5-6]。DG翻译后切割成两个紧密关联的亚基α-DG和β-DG,α-DG是细胞外高度糖基化的蛋白,与跨膜糖蛋白β-DG连接作为抗肌萎缩蛋白-糖蛋白复合体(dystrophin glycoprotein complex, DGC)的重要组成部分[7-8]。DGC为细胞骨架与细胞外基质提供一种紧密连接,其中α-DG通过O-糖链与细胞外基质蛋白层粘连蛋白α2连接,将细胞外基质连接到肌纤维内部骨架结构,维持肌细胞的完整性和肌细胞膜的稳定性[9]。因此FKRP发生突变时,所编码的5-磷酸转移酶异常,导致α-DG糖基化缺陷。本例患者检测到FKRP基因复合杂合突变,符合MDC1C的遗传学特点,但遗憾的是患者家属不同意行肌肉活检,无法证实α-DG是否减少。FKRP基因突变还可导致其他α-抗肌萎缩相关糖蛋白病:肌-眼-脑病(muscle-eye-brain disease, MEB)和肢带型肌营养不良2I型(limb girdle muscular dystrophy 2I, LGMD2I)。查阅ClinVar数据库(www.ncbi.nlm.nih.gov/clinvar),目前已发现227个FKRP基因突变位点,其中16个与MDC1C相关。在这16个致病性突变中,无义突变(c.1154C > A等)3例、移码突变(c.165-166insGGAG)1例、错义突变(c.926A > G等)12例。FKRP基因复合杂合突变患者起病更早,进展更快,肌无力程度更重,但纯合与复合杂合突变两种类型患者的心脏和呼吸肌受累无明显差别。本研究患儿FKRP基因Exon4存在c.350C > G和c.1303C > T复合杂合错义突变,c.350C > G为MDC1C已知致病突变;c.1303C > T的致病性经基因突变功能软件预测有致病性可能。
MDC1C于2001年由Brockington等[4]首次报道。MDC1C可累及全身肌肉,表现为面部肌肉无力、表情刻板,下肢肌肉肥大、丧失独立行走能力,肩胛带与前臂旋前消失,跟腱挛缩,肌酸激酶升高,肌肉活检提示α-DG严重减少、层粘连蛋白α2轻度减少[10]。MDC1C累及呼吸肌或者心肌导致的呼吸或心脏功能衰竭是这类患者死亡的直接原因,应定期予以肺功能或超声心动图监测。Topaloglu等[11]报道两例FKRP基因纯合突变导致的MDC1C儿童伴有轻度智力低下,头颅MR提示小脑囊肿。Louhichi等[12]报道MDC1C患者还具有脑桥发育不良、小脑半球和蚓部发育不良、结节性异位、脑室外间隙增宽等影像学特征。除了累及肌肉、脑部,Mercuri等[13]发现2例MDC1C患者具有MEB样的眼部症状,表现为斜视,推断此表现可能与α-DG糖基化受破坏的严重程度相关。本例患儿的肌张力低下、表情刻板和交叉性斜视等临床特点与文献相符,但头颅MR未发现异常。
FKRP基因产物是一种高尔基体驻留蛋白,定位于高尔基体是保持功能正常的先决条件[4]。细胞转染实验发现,与严重疾病表型相关的FKRP突变体位于内质网,错误折叠的蛋白质在内质网被快速降解,无法运输到高尔基体发挥作用;而与温和表型相关的FKRP突变体可以到达高尔基体,并且保留部分野生型FKRP蛋白质功能[14]。最近,Yoshioka等[15]报道一对误诊为福山型CMD的同胞兄妹,经Sanger测序发现FKRP4号外显子存在复合杂合突变,最终确诊MDC1C。由此可见CMD亚组之间临床特征极具相似性,分子遗传学可协助确诊。
MDC1C治疗仍主要为对症及康复训练。对于包括MDC1C在内的α-抗肌萎缩相关糖蛋白病,研究者们基于动物实验提出皮质类固醇治疗、基因治疗、酶替代治疗、反义治疗等新型治疗方法。如反义寡核苷酸外显子跳跃治疗福山型CMD已进入临床试验阶段,腺病毒载体介导基因用于FKRP突变模型小鼠肌营养不良,皮质类固醇缓解LGMD2I患者肌肉炎症和坏死[16]。
综上所述,MDC1C通常于婴儿早期起病,以运动系统受累为突出表现,表现为严重的肌张力低下和运动发育落后甚至停滞。MDC1C为常染色体隐性遗传,基因检测发现FKRP基因纯合子或复合杂合突变可确诊。
| [1] |
Topaloglu H., Brockington M, Yuva Y, et al. FKRP gene mutations cause congenital muscular dystrophy, mental retardation, and cerebellar cysts[J]. Neurology, 2003, 60: 988-992. DOI:10.1212/01.WNL.0000052996.14099.DC (  0) 0) |
| [2] |
Fu X, Yang H, Wei C, et al. FKRP mutations, including a founder mutation, cause phenotype variability in Chinese patients with dystroglycanopathies[J]. J Hum Genet, 2016, 61(12): 1013-1020. DOI:10.1038/jhg.2016.94 (  0) 0) |
| [3] |
Godfrey C, Foley AR, Clement E, et al. Dystroglycanopathies:coming into focus[J]. Curr Opin Genet Dev, 2011, 21(3): 278-285. DOI:10.1016/j.gde.2011.02.001 (  0) 0) |
| [4] |
Brockington M, Blake DJ, Prandini P, et al. Mutations in the fukutin-related protein gene (FKRP) cause a form of congenital muscular dystrophy with secondary laminin alpha-2 deficiency and abnormal glycosylation of alpha-dystroglycan[J]. Am J Hum Genet, 2001, 69(6): 1198-1209. DOI:10.1086/324412 (  0) 0) |
| [5] |
Esapa CT, Benson MA, Schröder JE, et al. Functional requirements for fukutin-related protein in the Golgi apparatus[J]. Hum Mol Genet, 2002, 11(26): 3319-3331. DOI:10.1093/hmg/11.26.3319 (  0) 0) |
| [6] |
Kanagawa M, Kobayashi K, Tajiri M, et al. Identification of a post-translational mod ification with ribitol-phosphate and its defect in muscular dystrophy[J]. Cell Rep, 2016, 14(9): 2209-2223. DOI:10.1016/j.celrep.2016.02.017 (  0) 0) |
| [7] |
Ibraghimov-Beskrovnaya O, Ervasti JM, Leveille CJ, et al. Primary structure of dystrophin-associated glycoproteins linking dystrophin to the extracellular matrix[J]. Nature, 1992, 355(6362): 696-702. DOI:10.1038/355696a0 (  0) 0) |
| [8] |
Sato S, Omori Y, Katoh K, et al. Pikachurin, a dystroglycan ligand, is essential for photoreceptor ribbon synapse formation[J]. Nat. Neurosci, 2008, 11(8): 923-931. DOI:10.1038/nn.2160 (  0) 0) |
| [9] |
Ervasti JM, Campbell KP. A role for the dystrophin-glycoprotein complex as a transmembrane linker between laminin and actin[J]. J Cell Biol, 1993, 122(4): 809-823. DOI:10.1083/jcb.122.4.809 (  0) 0) |
| [10] |
Mercuri E, Brockington M, Straub V, et al. Phenotypic spectrum associated with mutations in the fukutin-related protein gene[J]. Ann. Neurol, 2003, 53(4): 537-542. DOI:10.1002/(ISSN)1531-8249 (  0) 0) |
| [11] |
Topaloglu H, Brockington M, Yuva Y, et al. FKRP gene mutations cause congenital muscular dystrophy, mental retardation, and cerebellar cysts[J]. Neurology, 2003, 60(6): 988-992. DOI:10.1212/01.WNL.0000052996.14099.DC (  0) 0) |
| [12] |
Louhichi N, Triki C, Quijano-Roy S, et al. New FKRP mutations causing congenital muscular dystrophy associated with mental retardation and central nervous system abnormalities. Identification of a founder mutation in Tunisian families[J]. Neurogenetics, 2004, 5(1): 27-34. DOI:10.1007/s10048-003-0165-9 (  0) 0) |
| [13] |
Mercuri E, Topaloglu H, Brockington M, et al. Spectrum of brain changes in patients with congenital muscular dystrophy and FKRP gene mutations[J]. Arch Neurol, 2006, 63(2): 251-257. DOI:10.1001/archneur.63.2.251 (  0) 0) |
| [14] |
Esapa CT, McIlhinney RA, Blake DJ. Fukutin-related protein mutations that cause congenital muscular dystrophy result in ER-retention of the mutant protein in cultured cells[J]. Hum Mol Genet, 2005, 14(2): 295-305. DOI:10.1093/hmg/ddi026 (  0) 0) |
| [15] |
Yoshioka M, Kobayashi K, Toda T. Novel FKRP mutations in a Japanese MDC1C sibship clinically diagnosed with Fukuyama congenital muscular dystroph[J]. Brain Dev, 2017, 39(10): 869-872. DOI:10.1016/j.braindev.2017.05.013 (  0) 0) |
| [16] |
Taniguchi-Ikeda M, Morioka I, Iijim K, et al. Mechanistic aspects of the formation of α-dystroglycan and therapeutic research for the treatment of α-dystroglycanopathy:A review[J]. Mol Aspects Med, 2016, 51: 115-124. DOI:10.1016/j.mam.2016.07.003 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


