新生儿黄疸是新生儿胆红素代谢异常,引起血中胆红素升高而出现皮肤、巩膜及黏膜黄染的临床现象。严重高胆红素血症会引起胆红素脑病,造成中枢神经系统永久性损伤[1]。目前,新生儿高胆红素血症的治疗包括药物治疗、光照疗法和换血疗法。其中,药物治疗中最常用的中药制剂是茵栀黄口服液[2],该药是由茵陈、栀子、黄芩和金银花四种中药提纯制成。在中国南方地区,尤其是广东、广西等省份,民间有使用金银花水洗浴退黄的传统。临床发现个别患有葡萄糖-6-磷酸脱氢酶(G6PD)缺乏症新生儿使用金银花水洗浴后出现了严重溶血反应。有文献提出,金银花有溶血作用[3]。因此有人推测,使用金银花水洗浴和服用含金银花成分的茵栀黄口服液会造成有G6PD缺乏的新生儿发生溶血。但茵栀黄口服液和金银花成分是否会诱发有G6PD缺乏新生儿发生溶血目前仍有争议。本次实验就大剂量茵栀黄口服液及不同浓度金银花提取物是否会诱发G6PD缺乏大鼠发生溶血进行探究,以期为进一步临床实验提供一定的动物实验依据。
1 材料与方法 1.1 试剂与仪器茵栀黄口服液(北京华润高科天然药物有限公司),金银花提取物(北京华润高科天然药物有限公司,批号:T272497)。大鼠G6PD ELISA试剂盒(上海科顺生物科技有限公司),快速瑞氏染液和微量游离血红蛋白测试盒(南京建成生物工程研究所),乙酰苯肼(APH,含量98%)、伯氨喹啉(含量98%)、EDTA K2真空采血管、96孔酶标板均购于广州天骏生物科技有限公司。显微镜(日本Olympus公司),全自动血液分析仪(广东省实验动物监测所,型号为XI-2000i),全自动生化分析仪(广东省实验动物监测所,型号为日立/7020)。
1.2 G6PD缺乏大鼠模型制备选用能干扰红细胞膜上G6PD活性的强氧化剂APH进行造模[4]。以1 g APH+100 mL生理盐水配成1%浓度APH溶液,按1 mL/100 g剂量给健康雄性大鼠腹腔注射,每天中午1次,连续2 d,即成功制造G6PD缺乏大鼠模型[5]。
1.3 造模前后G6PD活性检测将10只7~8周龄Wistar远交系雄性大鼠(南方医科大学医学实验动物中心提供),体重200±30 g,分别于造模前,造模后第2天、第4天、第6天、第8天和第10天用颌下采血法采血后,用大鼠G6PD ELISA试剂盒检测大鼠红细胞G6PD活性,以探究造模前后大鼠红细胞G6PD活性变化情况。
1.4 实验动物及分组新生儿临床使用茵栀黄口服液的常规治疗剂量为每次3 mL,一日3次(其中金银花浓度为8 mg/mL),按药理实验方法学[6],换算成大鼠单倍剂量为每次6.7 mL/kg,每日1次。
将100只7~8周龄Wistar远交系雄性大鼠(南方医科大学医学实验动物中心提供),体重200±30 g,随机分为10组,每组10只。分别为正常组:大鼠红细胞G6PD活性正常,不给予任何药物;阴性对照组:APH造模成功后给予生理盐水喂养;阳性对照组:APH造模成功后给予0.06 g/kg伯氨喹啉;2倍剂量茵栀黄组:APH造模成功后给予13.4 mL/kg茵栀黄口服液;4倍剂量茵栀黄组:APH造模成功后给予26.8 mL/kg茵栀黄口服液;8倍剂量茵栀黄组:APH造模成功后给予53.6 mL/kg茵栀黄口服液;正常浓度金银花组:APH造模成功后给予6.7 mL/kg,浓度为8 mg/mL金银花提取物;中浓度金银花组:APH造模成功后给予6.7 mL/kg,浓度为40 mg/mL金银花提取物;高浓度金银花组:APH造模成功后给予6.7 mL/kg,浓度为80 mg/mL金银花提取物;极高浓度金银花组:APH造模成功后给予6.7 mL/kg,浓度为160 mg/mL金银花提取物。
1.5 瑞氏染色观察红细胞形态实验前随机抽取10只正常大鼠,每只用颌下采血法采血0.2 mL,造模后第3天随机抽取造模成功的10只大鼠,每只用颌下采血法采血0.2 mL,分别进行瑞氏染色,在显微镜下观察红细胞形态。
1.6 样本采集、检测及给药造模后第3天用颌下采血法[7]采血,采用大鼠G6PD ELISA试剂盒检测大鼠红细胞膜G6PD活性。确定大鼠G6PD缺乏模型造模成功后,按不同模型组要求分别给予相应的药物,连续给药3 d,在造模后第7天用颌下采血法采血后,用全自动血液分析仪检测大鼠全血血常规,全自动生化分析仪检测大鼠血浆中总胆红素及间接胆红素值,用微量游离血红蛋白测试盒检测大鼠血浆中游离血红蛋白值。
1.7 统计学分析采用SPSS 20.0统计软件对数据进行统计学分析,正态分布的计量资料以均数±标准差(x±s)表示;两组间比较采用t检验;多组间比较采用单因素方差分析,组间两两比较采用SNK-q法;同一对象在不同时间点测量的同一指标采用重复测量方差分析进行比较,以P < 0.05为差异有统计学意义。
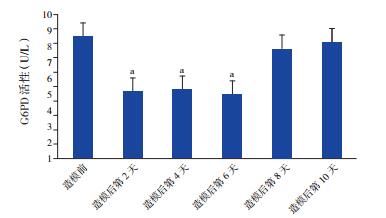
2 结果 2.1 大鼠造模前后红细胞G6PD活性变化情况造模后第2天,大鼠红细胞G6PD活性较造模前显著降低,在造模后第8天G6PD活性才恢复,保证在整个实验过程中大鼠红细胞G6PD活性一直处于缺乏状态。见表 1和图 1。
| 表 1 大鼠造模前后红细胞G6PD活性变化情况 |
|
|
|
图 1 大鼠造模前后红细胞G6PD活性变化情况(n=10) a示与造模前正常大鼠比较,P < 0.05。 |
正常大鼠红细胞为双凹圆盘状,中央区染色深,变形红细胞少;G6PD缺乏大鼠红细胞形态不规则,体积较大,中央区染色变淡,破裂和变形红细胞增多。见图 2。

|
图 2 光镜下观察正常大鼠红细胞与G6PD缺乏大鼠红细胞(瑞氏染色,×400) 正常大鼠红细胞为双凹圆盘状,中央区染色深,变形红细胞少;G6PD缺乏大鼠红细胞形态不规则,体积较大,中央区染色变淡,破裂和变形红细胞增多。 |
各组大鼠在造模前血中红细胞计数、血红蛋白水平、游离血红蛋白水平和网织红细胞百分比比较差异无统计学意义(P > 0.05)。造模后各组大鼠血中红细胞计数、血红蛋白水平、游离血红蛋白水平和网织红细胞百分比均低于造模前(P < 0.05),提示发生溶血。给予伯氨喹啉后,阳性对照组由于溶血持续发生,各指标均未恢复至造模前水平(P < 0.05);且红细胞计数和血红蛋白水平较其余给药后各组下降,游离血红蛋白水平和网织红细胞百分比均较其余给药后各组升高(P < 0.05)。除阳性对照组外,其余各组大鼠红细胞计数、血红蛋白和游离血红蛋白水平在给药后与造模前比较差异均无统计学意义(P > 0.05);仅网织红细胞百分比均未恢复至造模前水平(P < 0.05),但不同剂量茵栀黄组及金银花组与阴性对照组比较,差异均无统计学意义(P > 0.05)。见表 2~5。
| 表 2 各组大鼠给药前后血中红细胞计数比较 (x±s,104/μL) |
|
|
| 表 3 各组大鼠给药前后血中血红蛋白水平比较 (x±s,g/L) |
|
|
| 表 4 各组大鼠给药前后血中血红蛋白水平比较 (x±s,mg/L) |
|
|
| 表 5 各组大鼠给药前后血中网织红细胞百分数比较 (x±s,%) |
|
|
给予不同剂量茵栀黄口服液后,各组总胆红素和间接胆红素水平均较阳性对照组下降(P < 0.05),但给予不同浓度金银花后,各组间接胆红素水平低于阳性对照组(P < 0.05),但总胆红素水平高于各剂量茵栀黄组(P < 0.05),与阳性对照组比较差异无统计学意义(P > 0.05)。从退黄疗效比较,与4倍剂量茵栀黄组和8倍剂量茵栀黄组相比,2倍剂量茵栀黄组给药后大鼠总胆红素水平下降百分比最高(P < 0.05)。见表 6~7。
| 表 6 各组大鼠给药后总胆红素与间接胆红素水平比较 |
|
|
| 表 7 不同剂量茵栀黄组大鼠血总胆红素给药前后下降百分比比较 (x±s) |
|
|
细胞容易遭受氧自由基攻击,红细胞在遭受氧自由基攻击时,需要细胞质膜上还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)参与抗氧化反应,而NADPH的产生需要G6PD促进烟酰腺嘌呤二核苷酸磷酸(NADP)变为NADPH[8]。所以,有G6PD缺乏的红细胞中NADPH产生减少,在受到氧自由基攻击时,红细胞不能保持其完整性,容易发生变形和破裂。本实验中用1%APH成功制造出G6PD缺乏大鼠模型,从造模后第8天起,G6PD活性才恢复,保证整个实验过程中大鼠均存在G6PD缺乏。
中医学认为新生儿黄疸归属于“胎黄”范畴,因新生儿组织器官发育不完全,受湿热邪毒入侵时不能及时将其排出,以致胆汁淤积,出现皮肤黏膜黄染。因此,中医治疗新生儿黄疸多以清热解毒,利湿退黄立论[9]。茵栀黄口服液由茵陈、栀子、黄芩和金银花四种中药提纯而制成,具有清热解毒、利胆退黄之功效[10],为中药治疗新生儿黄疸的首选用药。其退黄机制可能是作为组成型雄烷受体激动剂,增加UGT1A1和MRP2表达,促进胆红素的结合和代谢[11]。在中国,许多人认为有一些中草药会引起G6PD缺乏患儿发生溶血,因为茵栀黄口服液是4种中药合剂,所以有人认为服用茵栀黄口服液有可能会发生溶血。但是,还没有有说服力的证据证明这些草药是溶血剂[12]。Chen等[13]研究表明,新生儿服用茵栀黄口服液后对血细胞的形态没有明显影响。陈锦文等[14]研究表明,服用小剂量茵栀黄口服液不会引起G6PD缺乏大鼠发生溶血,也没有证据提示茵栀黄口服液对G6PD缺乏红细胞膜有损伤作用。有关茵栀黄口服液治疗新生儿高间接胆红素的多中心随机对照研究中也未观察到新生儿服用茵栀黄口服液后出现其他严重不良反应[15]。本次动物实验也证明:大剂量茵栀黄口服液没有造成G6PD活性缺乏大鼠发生溶血。在退黄疗效方面,给予2倍剂量茵栀黄口服液退黄效果最佳,说明并不是服用越大剂量茵栀黄口服液退黄效果越好,提示对于茵栀黄口服液治疗新生儿黄疸剂量不宜过大。
从金银花化学成分分析,主要成分为三萜皂苷类、环烯醚萜类和黄酮类[16];三萜皂苷类的不同糖苷配基,以及糖链的数量、长度和位置都会对红细胞膜的孔隙形成和红细胞的渗透性造成影响,最终产生溶血毒性[17]。金银花可能会导致有G6PD缺乏红细胞破裂溶血,但具体机制及剂量仍有待研究。有研究表明,分别给予5 000 mg/kg金银花制剂行急性毒性实验和1 000 mg/kg金银花制剂行慢性毒性实验并没有使大鼠发生溶血[18]。
综上所述,茵栀黄口服液起退黄作用的同时并没有造成G6PD缺乏大鼠发生溶血,本实验为临床研究茵栀黄口服液提供一定的动物实验基础。但在临床运用中,茵栀黄口服液安全而有效的剂量仍需要进一步探索。
| [1] |
杜立中. 新生儿高胆红素血症[M]. 北京: 人民卫生出版社, 2015: 34-45.
(  0) 0) |
| [2] |
刘备, 马国. 新生儿黄疸的治疗药物研究进展[J]. 中国医院药学杂志, 2015, 35(16): 1515-1519. (  0) 0) |
| [3] |
黄喜茹, 刘伟娜, 曹冬. 金银花的化学成分药理作用研究评析[J]. 中医药学刊, 2005, 23(3): 418-419. DOI:10.3969/j.issn.1673-7717.2005.03.017 (  0) 0) |
| [4] |
钱宏梁, 潘志强. 中医血虚证及其动物模型制备方法评析[J]. 广州中医药大学学报, 2018, 35(1): 176-181. (  0) 0) |
| [5] |
王艳伟, 乔利, 刘春芳, 等. 黄连对乙酰苯肼所致小鼠红细胞氧化性溶血的影响及作用机制[J]. 中国中药杂志, 2010, 35(18): 2449-2452. (  0) 0) |
| [6] |
魏伟, 吴希美, 李元建. 药理实验方法学[M]. 第4版. 北京: 人民卫生出版社, 2017: 69-80.
(  0) 0) |
| [7] |
台雪姣, 郭兴荣, 罗超, 等. 小鼠颌下采血法改良[J]. 四川动物, 2017, 36(2): 211-214. (  0) 0) |
| [8] |
Luzzatto L, Nannelli C, Notaro R. Glucose-6-phosphate dehydrogenase deficiency[J]. Hematol Oncol Clin North Am, 2016, 30(2): 373-393. DOI:10.1016/j.hoc.2015.11.006 (  0) 0) |
| [9] |
马印图, 李莉华, 李玉秋, 等. 茵栀黄口服液临床应用研究进展[J]. 解放军医药杂志, 2014, 26(6): 88-91. DOI:10.3969/j.issn.2095-140X.2014.06.024 (  0) 0) |
| [10] |
范建伟, 李蔚群, 李艳芳, 等. 茵栀黄制剂处方渊源、剂型沿革与质量控制的研究进展[J]. 中成药, 2017, 39(11): 2365-2368. DOI:10.3969/j.issn.1001-1528.2017.11.031 (  0) 0) |
| [11] |
Cuperus FJ, Hafkamp AM, Hulzebos CV, et al. Pharmacological therapies for unconjugated hyperbilirubinemia[J]. Curr Pharm Des, 2009, 15(25): 2927-2938. DOI:10.2174/138161209789058219 (  0) 0) |
| [12] |
Fok TF. Neonatal jaundice-traditional Chinese medicine approach[J]. J Perinatol, 2001, 21 Suppl 1: S98-S100. (  0) 0) |
| [13] |
Chen SP, Tian LL, Liu FL. Clinical observation of Yinzhihuang Oral Liquid on prevention of the premature infantile jaundice[J]. Chin J Integr Med, 2009, 15(4): 299-302. DOI:10.1007/s11655-009-0299-1 (  0) 0) |
| [14] |
陈锦文, 唐丽君, 黄为民. 茵栀黄口服液对G6PD酶活性下降大鼠溶血及红细胞膜ATP酶活性的影响[J]. 世界中西医结合杂志, 2015, 10(6): 774-778. (  0) 0) |
| [15] |
茵栀黄口服液临床研究协作组. 茵栀黄口服液治疗足月新生儿高间接胆红素血症的多中心随机对照研究[J]. 中华儿科杂志, 2011, 49(9): 663-668. DOI:10.3760/cma.j.issn.0578-1310.2011.09.005 (  0) 0) |
| [16] |
杨倩茹, 赵媛媛, 郝江波, 等. 金银花与山银花化学成分及其差异的研究进展[J]. 中国中药杂志, 2016, 41(7): 1204-1211. (  0) 0) |
| [17] |
Vo NNQ, Fukushima EO, Muranaka T. Structure and hemolytic activity relationships of triterpenoid saponins and sapogenins[J]. J Nat Med, 2017, 71(1): 50-58. DOI:10.1007/s11418-016-1026-9 (  0) 0) |
| [18] |
Thanabhorn S, Jaijoy K, Thamaree S, et al. Acute and subacute toxicity study of the ethanol extract from Lonicera japonica Thunb[J]. J Ethnopharmacol, 2006, 107(3): 370-373. DOI:10.1016/j.jep.2006.03.023 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


