2. 武汉大学人民医院儿科, 湖北 武汉 430060
遗传性球形红细胞增多症(hereditary spherocytosis, HS)是一种由红细胞膜先天性缺陷而引起的溶血性贫血,典型表现为外周血球形红细胞增多、皮肤黄染、贫血、肝脾肿大等[1-2]。HS的发病机制为基因缺陷导致的红细胞膜蛋白异常,目前已经证实ANK1,SLC4A1,EPB42,SPTB以及SPTA1等基因异常与HS相关[4-5]。本文报道汉川市人民医院近两年利用高通量测序方法确诊的4例HS患者,总结其临床及遗传学特点,为进一步加深临床医生对该病的认识提供依据。
1 资料与方法 1.1 研究对象4例患儿(男性2例、女性2例)年龄3岁7个月至5岁,均以面色苍白、黄疸入院。查体均有贫血、皮肤巩膜黄染和轻度肝、脾肿大。实验室检查:红细胞计数2.4~3.3×1012,血红蛋白67~92 g/L、网织红细胞比例升高(2.9%~4.2%);总胆红素水平上升(88~207 μmol/L)、以间接胆红素为主;外周血涂片球形红细胞比例均超过16%(16%~28%);红细胞渗透脆性增高;抗人球蛋白试验均阴性。2例行腹部超声检查者未见胆囊结石。患者4的母亲外院诊断为遗传性球形红细胞增多症。4例患者均有贫血、肝脾肿大,以及间接胆红素增高为主的黄疸、网织红细胞比例增高、外周血涂片球形红细胞>10%,红细胞渗透脆性增加,均可临床诊断HS。
1.2 血液系统疾病相关基因高通量测序取4例患者及其父母(患者3的父母未行基因测序)外周静脉血2 mL,提取基因组DNA,委托康旭公司进行血液系统疾病相关基因高通量测序,并采用Sanger测序对高通量测序结果验证。
1.3 生物信息学分析对新突变利用Mutation Taster、Polyphen2及SIFT在线软件预测其致病性。利用MEGA-X软件进行不同物种间SLC4A1蛋白序列的保守性分析。以结晶的SLC4A1蛋白的三维结构(PDB数据库ID:4KY9)为模版,应用SWISS-MODEL软件预测单个氨基酸改变后SLC4A1蛋白的三维结构。
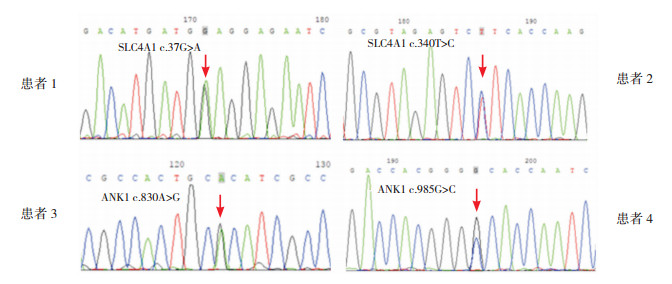
2 结果 2.1 基因检测结果患者1的SLC4A1基因检出新的突变:c.37G < A杂合突变(NM_000342),其父母该位点未见异常;患者2的SLC4A1基因发现新的突变:c.340T>C杂合突变(NM_000342),其父母该位点未见异常;患者3的ANK1基因存在c.830A>G杂合突变(NM_000037),为已报道的致病性突变,其父母未行基因检测;患者4的ANK1基因发现错义突变c.985G>C(NM_000037),为已报道的致病性突变,变异遗传自其母,其母(HS患者)也检出ANK1基因突变c.985G>C。见图 1。
|
图 1 4例患者的基因检测结果 患者1的SLC4A1基因存在c.37G>A杂合突变;患者2的SLC4A1基因存在c.340T>C杂合突变;患者3的ANK1基因存在c.830A>G杂合突变;患者4的ANK1基因发生错义突变c.985G>C。突变位点如箭头所指。 |
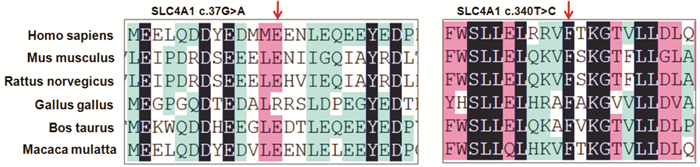
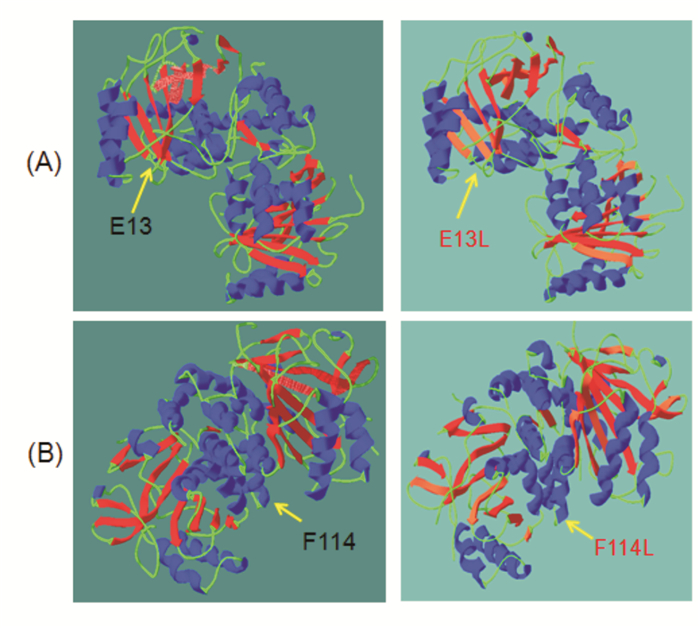
患者1和2的SLC4A1基因突变c.37G>A和c.340T>C经Mutation Taster软件预测(预测值分别为58和22),提示突变具有致病性;Polyphen2的预测值分别为0.87、0.83,提示突变有害的可能性大;SIFT预测值为0.008、0.09,提示突变有害可能性大。保守序列分析发现该位点在不同的物种之间(人、小鼠、褐家鼠、鸡、牛、猕猴)保守,见图 2。利用Swiss Model软件对SLC4A1基因突变进行蛋白质结构预测发现,c.37G>A突变(p.Gln13Lys)导致第13位谷氨酰胺转变为赖氨酸,c.340T>C突变(p.Phe114Leu)导致第114位氨基酸由苯丙氨酸突转变为亮氨酸,但与野生型SLC4A1蛋白的三维结构相比,这些氨基酸变化并没有改变蛋白的三级结构,见图 3。
|
图 2 SLC4A1基因突变c.37G>A以及c.340T>C在不同物种之间的保守性分析 红色箭头所指提示保守的氨基酸。 |
|
图 3 p.Gln 13Lys和p.Phe 114Leu突变前后的SLC4A1、蛋白三维结构预测 A图表示p.Gln13Lys突变前后SLC4A1蛋白结构,B图表示p.Phe114Leu突变前后SLC4A1蛋白结构。图A、B的左图均为野生型结构,氨基酸位点改变如箭头所示。 |
病例3因为接近重度贫血,入院后进行了红细胞输注,出院时血红蛋白104 g/L,因Hb常<80 g/L,于5岁6个月于外院行脾切除术,术后半年随访,病情较稳定,偶有感染但容易控制;定期复查Hb均>105 g/L。其余3例患者诊断时为轻度贫血,予以补充叶酸等对症治疗,但后期随访发现患者因贫血加重均进行过输血治疗。
3 讨论HS是一种由于红细胞膜蛋白异常导致的遗传性溶血性疾病,欧美地区发病率高达1/2 000~5 000,我国发病率不详[3]。约75%的HS病例为常染色体显性遗传;25%左右的患者无家族史,可能与常染色体隐性遗传或新突变有关[8]。目前已发现5种HS致病基因:ANK1、SLC4A1、SPTA1、SPTB和EPB42,分别编码锚蛋白、带3蛋白、α-收缩蛋白、β-收缩蛋白以及红细胞膜蛋白带4.2蛋白[5]。
SLC4A1基因又称为AE1或者Band3基因,位于17号染色体q21.31区域,编码的蛋白属于碳酸氢盐转运体SLC4家族成员之一,该蛋白含有两个功能域:N端位于胞浆区43KD大小的结构域和位于细胞膜内12~14个跨膜元件组成的结构域[9]。N端功能域负责蛋白质之间的相互作用来锚定细胞骨架与质膜,而跨膜结构域负责细胞转运功能。SLC4A1基因突变导致编码的蛋白功能异常,进一步致红细胞膜及其碳酸氢盐转运异常[10]。本研究的患者1和患者2均临床诊断HS,高通量测序发现两例患者均存在SLC4A1基因新突变,Mutation Taster、Polyphen2及SIFT软件预测这两个突变可能具有致病性,保守序列分析发现这两个位点在不同的物种(人、小鼠、褐家鼠、鸡、牛、猕猴)高度保守,但Swiss-Model预测这两个位点的突变未引起相应的蛋白结构变化,推测这两种突变可能是通过影响SLC4A1蛋白的稳定性或者表达进而导致红细胞膜异常,还需在细胞水平进一步验证。
ANK1基因位于8号染色体p11.2区域,由42个外显子组成,编码1 881个氨基酸组成的锚蛋白[11]。锚蛋白是红细胞膜蛋白的成分之一,对膜的稳定性起着重要作用,该蛋白异常可造成细胞膜脂质双分子层不稳定、红细胞由双凹圆盘状变为球形[13]。本研究的患者3和患者4的ANK1基因分别存在c.830A>G杂合突变和c.985G>C错义突变,均为已报道[14]的HS致病性突变,可分别导致ANK1基因编码的蛋白277位氨基酸由组氨酸突变为精氨酸(p.H277R),329位氨基酸由丙氨酸改变为脯氨酸(p.A329P)。
HS患者的红细胞呈球形,红细胞膜可塑性降低,在循环中容易被脾脏截获而遭到破坏,因此脾切除可以最大程度延长红细胞寿命、减少输血、降低胆石症的发生率和改善预后[2, 15]。HS患者Hb小于80 g/L,且网织红细胞比例>10%;或者Hb 80~120 g/L,网织红细胞6%~8%时,可行脾切除手术,除少数贫血严重或多次出现再障和溶血危象以至反复输血不能维持生命者外,手术年龄应在5岁以后[1-2]。年龄较小的儿童可选择部分脾切除,既能达到治疗效果,又可保留脾脏免疫功能。本研究中1例患者的Hb常低于80 g/L,于5岁6个月行脾切除术,术后随访Hb均大于105 g/L。
综上所述,本研究通过基因检测对临床诊断为HS的4例患者予以了确诊,发现了SLC4A1基因两个未见报道的突变,为进一步探索HS的发病机制提供了参考。
| [1] |
Manciu S, Matei E, Trandafir B. Hereditary spherocytosis -diagnosis, surgical treatment and outcomes. a literature review[J]. Chirurgia (Bucur), 2017, 112(2): 110-116. DOI:10.21614/chirurgia.112.2.110 (  0) 0) |
| [2] |
Bolton-Maggs PH, Langer JC, Iolascon A, et al. Guidelines for the diagnosis and management of hereditary spherocytosis--2011 update[J]. Br J Haematol, 2012, 156(1): 37-49. DOI:10.1111/bjh.2011.156.issue-1 (  0) 0) |
| [3] |
姜敏, 鲁洁, 钟雁, 等. 新生儿遗传性球形红细胞增多症ANK1基因新突变一例[J]. 中华医学遗传学杂志, 2016, 33(1): 44-47. DOI:10.3760/cma.j.issn.1003-9406.2016.01.011 (  0) 0) |
| [4] |
He BJ, Liao L, Deng ZF, et al. Molecular genetic mechanisms of hereditary spherocytosis:current perspectives[J]. Acta Haematol, 2018, 139(1): 60-66. DOI:10.1159/000486229 (  0) 0) |
| [5] |
Wang R, Yang S, Xu M, et al. Exome sequencing confirms molecular diagnoses in 38 Chinese families with hereditary spherocytosis[J]. Sci China Life Sci, 2018, 61(8): 947-953. DOI:10.1007/s11427-017-9232-6 (  0) 0) |
| [6] |
陆再英, 钟南山. 内科学[M]. 第7版. 北京: 人民卫生出版社, 2008: 585.
(  0) 0) |
| [7] |
Deng Z, Liao L, Yang W, et al. Misdiagnosis of two cases of hereditary spherocytosis in a family and review of published reports[J]. Clin Chim Acta, 2015, 441: 6-9. DOI:10.1016/j.cca.2014.12.002 (  0) 0) |
| [8] |
Greth A, Lampkin S, Mayura-Guru P, et al. A novel ENUmutation in Ankyrin-1 disrupts malaria parasite maturation in red blood cells of mice[J]. PLoS One, 2012, 7(6): e38999. DOI:10.1371/journal.pone.0038999 (  0) 0) |
| [9] |
Cordat E, Casey JR. Bicarbonate transport in cell physiology and disease[J]. Biochem J, 2009, 417(2): 423-439. DOI:10.1042/BJ20081634 (  0) 0) |
| [10] |
Reithmeier RA, Casey JR, Kalli AC, et al. Band 3, the human red cell chloride/bicarbonate anion exchanger (AE1, SLC4A1), in a structural context[J]. Biochim Biophys Acta, 2016, 1858(7 Pt A): 1507-1532. (  0) 0) |
| [11] |
Barcellini W, Bianchi P, Fermo E, et al. Hereditary red cell membrane defects; diagnostic and clinical aspects[J]. Blood Transfus, 2011, 9(3): 274-277. (  0) 0) |
| [12] |
Guan H, Liang X, Zhang R, et al.Identification of a de novo ANK1 mutation in a Chinese family with hereditary spherocytosis[J]. 2018, 23(6): 357-361. https://www.tandfonline.com/doi/full/10.1080/10245332.2017.1398210
(  0) 0) |
| [13] |
Park J, Jeong DC, Yoo J, et al. Mutational characteristics of ANK1 and SPTB genes in hereditary spherocytosis[J]. Clin Genet, 2016, 90(1): 69-78. (  0) 0) |
| [14] |
Leite RC, Basseres DS, Ferreira JS, et al. Low frequency of ankyrin mutations in hereditary spherocytosis:identification of three novel mutations[J]. Hum Mutat, 2000, 16(6): 529. (  0) 0) |
| [15] |
Seims AD, Breckler FD, Hardacker KD, et al. Partial versus total splenectomy in children with hereditary spherocytosis[J]. Surgery, 2013, 154(4): 849-853. DOI:10.1016/j.surg.2013.07.019 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21

