Dubin-Johnson综合征(Dubin-Johnson syndrome, DJS)是ABCC2基因变异导致的一种以结合胆红素升高为特征的常染色体隐性遗传病,由Dubin和Johnson于1954年首次报道[1]。ABCC2位于常染色体10q24,编码多药耐药相关蛋白2(multidrug resistance-associated protein 2, MRP2)[2]。MRP2主要分布于肝细胞毛细胆管膜,依靠水解ATP产生的能量,主动向细胞外转运底物[3]。该分子是多种有机阴离子(包括结合型胆红素、胆汁酸、谷胱甘肽、白三烯等)排泄的主要载体蛋白[4-6]。ABCC2基因变异导致MRP2的成熟与定位发生缺陷[7-10],从而影响胆汁的分泌及胆红素的转运。自从1997年首次发现导致DJS的ABCC2基因变异以来[11],越来越多的DJS患者通过基因诊断得到确诊,其中包括为数不少的婴儿期患者[2, 12-14]。至今已报道致病性ABCC2变异类型34种,包括外显子跳跃、错义突变、无义突变和碱基缺失等[11-12, 15-17]。ABCC2基因分析已经成为DJS确诊的可靠依据。
检索中国知网、万方、维普等中文文献数据库,发现迄今关于DJS的中文文献已达110多篇,涉及约330例患者,说明国内医学界在DJS的诊断、治疗和随访领域已经积累了宝贵经验。然而,这些患者以青少年或成人为主,主要依靠肝活检及临床表现确诊[18],仅有1例成人DJS基因诊断的报道[19]。总体上讲,当前我国DJS患者,尤其儿科患者的诊治经验有待推广普及,该病患者的基因诊断工作也有待深入开展。该文探讨1例新生儿期发病的DJS患儿的临床特征及其ABCC2基因突变特点,并复习相关文献,为本病的诊治提供参考。
1 资料与方法 1.1 研究对象患儿,男,9.5个月,因发现肝功能异常9个月入院。因早产生后在当地人民医院住院治疗,入院第5天出现皮肤巩膜黄染,经蓝光照射等治疗后黄疸减轻,住院10 d好转出院。生后25 d时因黄疸加重入当地儿童医院就诊,肝功能检查提示总胆红素(Tbil)、结合胆红素(Dbil)、非结合胆红素(Ibil)、总胆汁酸(TBA)均显著升高(表 1)。肝炎病毒及TORCH检查均阴性,葡萄糖-6-磷酸脱氢酶(G6PD)活性正常,溶血筛查阴性,甲状腺功能检测未见异常,血尿遗传代谢病筛查未发现特定遗传代谢病依据。患儿诊断为婴儿胆汁淤积性肝病,予光疗退黄、护肝、利胆等处理9 d,皮肤、巩膜黄染减轻出院,但之后门诊随访直接胆红素、胆汁酸增高一直未恢复正常。患儿3.7月龄时转入某大学附属儿童医院进行诊治,当时体格检查发现面色暗黄,心前区可闻及2/6级收缩期杂音。肝右肋下3 cm可触及,剑突下1 cm可触及,质软,脾左肋下1.5 cm可触及,质软。生化检查发现Tbil、Dbil和TBA升高,丙氨酸氨基转移酶(ALT)和门冬氨酸氨基转移酶(AST)正常,γ-谷氨酰转肽酶(GGT)略高(表 1)。诊断为黄疸原因待查:(1)感染因素?(2)遗传代谢病?(3)胆道畸形?予保肝、利胆、支持治疗11 d,患儿好转出院。出院后继续金双岐、熊去氧胆酸、阿托莫兰等口服治疗,但肝功能持续异常,为明确诊断来我院就诊。患儿自起病以来,精神、食纳一般,睡眠可,混合喂养,大小便正常。
| 表 1 患儿历次生化检查结果 |
|
|
患儿系第1胎第1产,出生胎龄35+4周,因“胎膜早破、脐带扭转、胎盘早剥”剖宫产出生,Apgar评分1 min 9分、5 min 10分、10 min 10分,出生体重2 200 g(< -3 SD),身长49 cm(正常)。父母体健,非近亲结婚。否认家族史及传染病史。
入院体格检查:体重8 000 g, 身长57.0 cm,头围45.0 cm。神志清楚,反应可。皮肤、巩膜轻度黄染。头颅无畸形,萌牙2颗。双肺呼吸音清,律齐,心音有力,各瓣膜听诊区未闻及病理性杂音。腹不胀,肝右肋下3 cm可及,质中,脾不大,肠鸣音正常。四肢肌张力正常,活动自如,神经系统体查无异常。
辅助检查:血常规检查正常,但生化检查示Tbil和Dbil升高(表 1)。
1.2 代谢性肝病组套二代测序检测从患儿静脉血中提取基因组DNA,经打断、末端修复、扩增、纯化后,建立含有与代谢性肝病相关基因(AARS2、ABCA1、ABCB11、ABCB4、ABCC2等249个基因)的全基因组文库。用液相捕获试剂盒捕获上述目标基因文库,基因的总体覆盖度是99.95%,然后由北京迈基诺基因科技股份有限公司利用二代测序测序仪进行高通量测序,获取原始序列,再进行基因序列的生物信息学分析,找出致病基因并判断其突变性质,具体流程参照文献[20]。
1.3 Sanger测序验证根据二代测序检测结果,对患儿及其父母DNA标本进行Sanger测序,验证ABCC2基因变异。根据ABCC2基因的DNA序列使用Primer Premier 5.0软件设计出测序用引物(表 2),由北京迈基诺基因科技股份有限公司合成。PCR具体反应体系、温度条件及流程参照文献[21]。
| 表 2 ABCC2基因突变位点的Sanger测序引物 |
|
|
采用在线预测软件Human Splicing Finder(HSF;http://www.umd.be/HSF3/)预测基因变异是否影响剪接,推测基因变异是否影响蛋白质功能。
1.5 文献复习首先以“Dubin-Johnson”为关键词检索中国知网、万方、维普等中文文献数据库,然后以“Dubin-Johnson”和“ABCC2”为关键词,检索PubMed和人类基因突变数据库(HGMD)专业版数据库。根据检索结果收集整理涉及婴儿期及新生儿期DJS患者的文献,对该病变异类型、临床表现、实验室检查、肝活检等资料进行分析总结。
本研究遗传学检测经暨南大学附属第一医院医学伦理委员会批准,并请父母签署知情同意书。
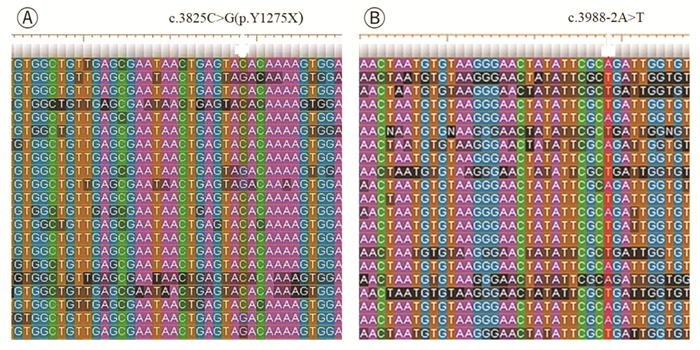
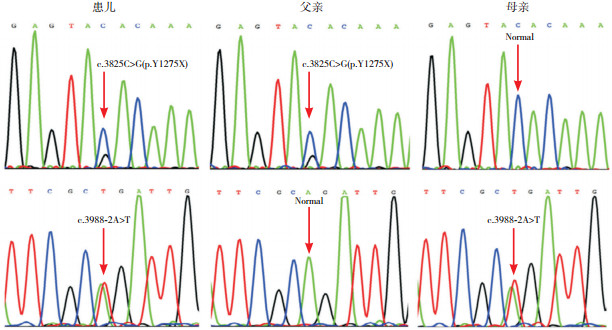
2 结果 2.1 遗传学分析结果代谢性肝病组套二代测序检测结果显示:患儿ABCC2基因存在2个变异,其中c.3988-2A>T为第28内含子的5' 端经典剪接位点变异,c.3825C>G(p.Y1275X)为外显子27的无义变异(图 1)。经过Sanger测序验证证实,患儿为上述变异的复合杂合子,而其母亲和父亲分别为相应变异携带者(图 2)。
|
图 1 ABCC2基因代谢性肝病组套二代测序分析结果 A:箭头表示变异c.3825C>G(p.Y1275X),可见ABCC2基因编码区第3 825位胞嘧啶C部分突变为鸟嘌呤G;B:箭头表示变异c.3988-2A>T,可见ABCC2基因的编码区3 988位碱基上游第2位腺嘌呤A部分突变为胸腺嘧啶T。 |
|
图 2 患儿及其父母ABCC2基因Sanger测序验证结果 患儿为c.3825C>G(p.Y1275X)和c.3988-2A>T变异的复合杂合子,父亲和母亲分别为c.3825C>G(p.Y1275X)和c.3988-2A>T变异的携带者。 |
变异c.3825C>G(p.Y1275X)在HGMD(http://www.hgmd.cf.ac.uk/ac/index.php)专业版数据库已报道与DJS相关[2]。在千人基因组计划(http://browser.1000genomes.org)、EAC数据库(Exome Aggregation Consortium, http://exac.broadinstitute.org/)中均未检索到变异c.3988-2A>T的记录,查阅中国知网、万方、维普、美国PubMed等国内外文献数据库,均未见该变异的正式文献报道。HSF预测结果提示,c.3988-2A>T变异影响受体剪接位点,可能通过影响mRNA剪接阻碍MRP2蛋白的正常合成。
2.2 治疗与结局根据患儿的临床特点和实验室检查,诊断考虑遗传性胆汁淤积症,经二代测序及Sanger测序验证,最终确诊为ABCC2基因变异导致的DJS。给予患儿熊去氧胆酸和苯巴比妥口服治疗,10月龄门诊随访时黄疸消退,生化复查Tbil和Dbil改善,TBA正常(表 1)。目前临床随访中,远期预后有待观察。
2.3 文献复习结果检索中国知网、万方、维普等中文文献数据库,尚未发现婴儿期及新生儿期DJS基因诊断的报道。通过检索美国PubMed文献数据库及HGMD数据库专业版,共纳入文献6篇,涉及婴儿期及新生儿期DJS患者17位。这些DJS患儿共检出ABCC2基因变异类型16种,呈现明显的异质性,其中错义变异最常见,占31%(5/16),其次为剪接位点变异,占25%(4/16),无义变异、缺失变异和重复变异分别占19%(3/16)、19%(3/16)和6%(1/16)。17例患儿临床上均表现为长期或间歇性黄疸,但预后较好,不影响生长发育;有9例患儿有一过性白陶土样大便,4名患儿有肝肿大。实验室检查方面,11名患儿可见TBA升高;7名患儿AST稍高而ALT正常;6名患儿存在GGT升高;4名患儿肝活检病理检查发现肝细胞内黑色素沉积(表 3)。
| 表 3 既往报道的新生儿/婴儿DJS患儿变异类型及临床表型 |
|
|
本研究患儿为早产儿,生后5 d起Dbil及TBA渐升高,分别在生后25 d及生后40 d时达到最高,此后呈降低趋势,但病程迁延,至9.5月龄就诊时仍未恢复正常。体查发现皮肤巩膜轻度黄染,肝稍大,脾不大。实验室检查排除了巨细胞病毒感染、G6PD缺陷病、新生儿溶血症、甲状腺功能异常、病毒性肝炎及其他遗传代谢病等。这些临床表现及生化指标符合胆汁淤积症的临床特点,但仅根据以上发现,具体病因无法确定。
在基因检测技术出现之前,学界主要根据患者长期或间断性黄疸的临床表现,Dbil升高的生化特点、溶酶体黑色素沉积的肝组织病理改变,以及MRP2蛋白表达显著减少和尿粪卟啉I型升高等实验室特征诊断DJS [2, 12, 23-25]。本研究通过二代测序及Sanger测序验证,确认该患儿为ABCC2基因c.3988-2A>T和c.3825C>G(p.Y1275X)变异的复合杂合子,前者来自母亲,是未曾报道过的新变异。ABCC2基因编码的MRP2蛋白属于ATP结合盒式结构超家族(adenosine triphosphate binding cassette, ABC)转运体C亚家族中的一员,其ABC结合域作为结合ATP的功能域,在进化上高度保守。ABCC2基因29号外显子编码的氨基酸序列位于MRP2蛋白第2个ABC结构域中[2],该外显子的致病变异将影响MRP2蛋白结合ATP,继而造成MRP2蛋白的Dbil转运功能障碍。本文患儿来自母亲的新变异c.3988-2A>T紧邻29号外显子5' 端,属于经典的剪接位点变异,属于极强致病性依据[26],而且根据HSF预测结果,该变异影响受体剪接位点,通过影响mRNA剪接阻碍MRP2蛋白的正常合成,从而影响29号外显子功能。患儿父源性变异c.3825C>G(p.Y1275X)导致截断MRP2蛋白形成[2]。该患儿同时具备两个ABCC2基因致病性变异,导致最终形成以上DJS临床表现。
DJS患者大多预后良好,对胆红素水平较高且反复发作者可考虑给予苯巴比妥治疗[27]。1991年日本学者首次报道用苯巴比妥治疗1例新生儿期起病的DJS,可使Tbil、Dbil及TBA下降[25]。2002年Regev等[28]报道1例新生儿期起病的DJS患者先用苯巴比妥治疗,Tbil继续升高,Dbil轻微下降,后加用熊去氧胆酸可使Tbil及Dbil均明显下降。此后有文献陆续报道苯巴比妥联合熊去氧胆酸治疗新生儿期起病的DJS安全有效,可使Tbil、Dbil及TBA显著降低,预后良好[2, 23]。苯巴比妥可以提高胆红素葡萄糖醛酸转移酶的活性[25],增强胆红素的摄取与结合[28],还可通过微粒体细胞色素P450依赖酶的作用刺激羟基化胆汁酸的形成[29],羟基化胆汁酸再通过肾脏从尿中排泄,从而降低血清中的胆汁酸水平[30]。熊去氧胆酸是一种亲水性的胆汁酸,具有显著的利胆作用,通过抑制胆汁酸诱导的肝细胞损伤、抑制胆汁分泌过多以及内源性胆汁酸的肠肝循环起到直接保护肝细胞的作用[31]。熊去氧胆酸治疗胆汁淤积的分子机制包括在转录及转录后水平刺激毛细胆管膜MRP2、BSEP以及基底侧膜MRP3、MRP4输出泵功能[32],还可以刺激人肝细胞上的CYP3A4/CYP3A11的表达,下调胆汁酸合成的关键酶CYP7A1的表达[33],从而可以降低Dbil及胆汁酸。该患儿门诊给予苯巴比妥和熊去氧胆酸治疗,半月后临床和生化指标好转,其远期预后有待随访观察。
复习文献发现,新生儿/婴儿DJS患者多在生后不久即出现黄疸,部分患者可有暂时性白陶土样粪便,个别患儿出现肝肿大;实验室检查以Dbil升高为主,部分患儿TBA升高,符合胆汁淤积症特点,而患者ABCC2基因变异存在明显异质性。以上临床表现可迁延至幼儿期,但预后良好,也不影响生长发育。对于符合以上特点的患儿,应高度警惕该病的可能,若进一步通过遗传学分析发现ABCC2双等位基因突变,即可确诊为该病。
本研究通过临床和遗传学分析,确诊了1例新生儿期起病的DJS患者。患儿主要临床表现为苯巴比妥及熊去氧胆酸治疗有效的高结合胆红素血症,ABCC2基因分析证实其为c.3825C>G(p.Y1275X)和c.3988-2A>T变异的复合杂合子。新突变c.3988-2A>T的识别扩展了ABCC2基因变异谱,为患儿DJS确诊和遗传咨询提供了依据。
| [1] |
Dubin IN, Johnson FB. Chronic idiopathic jaundice with unidentified pigment in liver cells; a new clinicopathologic entity with a report of 12 cases[J]. Medicine (Baltimore), 1954, 33(3): 155-197. DOI:10.1097/00005792-195409000-00001 (  0) 0) |
| [2] |
Lee JH, Chen HL, Chen HL, et al. Neonatal Dubin-Johnson syndrome:long-term follow-up and MRP2 mutations study[J]. Pediatr Res, 2006, 59(4 Part 1): 584-589. DOI:10.1203/01.pdr.0000203093.10908.bb (  0) 0) |
| [3] |
Kartenbeck J, Leuschner U, Mayer R, et al. Absence of the canalicular isoform of the MRP gene-encoded conjugate export pump from the hepatocytes in Dubin-Johnson syndrome[J]. Hepatology, 1996, 23(5): 1061-1066. (  0) 0) |
| [4] |
König J, Nies AT, Cui Y, et al. Conjugate export pumps of the multidrug resistance protein (MRP) family:localization, substrate specificity, and MRP2-mediated drug resistance[J]. Biochim Biophys Acta, 1999, 1461(2): 377-394. DOI:10.1016/S0005-2736(99)00169-8 (  0) 0) |
| [5] |
Trauner M, Boyer JL. Bile salt transporters:molecular characterization, function, and regulation[J]. Physiol Rev, 2003, 83(2): 633-671. DOI:10.1152/physrev.00027.2002 (  0) 0) |
| [6] |
Mottino AD, Cao J, Veggi LM, et al. Altered localization and activity of canalicular Mrp2 in estradiol-17beta-D-glucuronideinduced cholestasis[J]. Hepatology, 2002, 35(6): 1409-1419. DOI:10.1053/jhep.2002.33327 (  0) 0) |
| [7] |
Keitel V, Kartenbeck J, Nies AT, et al. Impaired protein maturation of the conjugate export pump multidrug resistance protein 2 as a consequence of a deletion mutation in DubinJohnson syndrome[J]. Hepatology, 2000, 32(6): 1317-1328. DOI:10.1053/jhep.2000.19791 (  0) 0) |
| [8] |
Mor-Cohen R, Zivelin A, Rosenberg N, et al. Identification and functional analysis of two novel mutations in the multidrug resistance protein 2 gene in Israeli patients with Dubin-Johnson syndrome[J]. J Biol Chem, 2001, 276(40): 36923-36930. DOI:10.1074/jbc.M105047200 (  0) 0) |
| [9] |
Hashimoto K, Uchiumi T, Konno T, et al. Trafficking and functional defects by mutations of the ATP-binding domains in MRP2 in patients with Dubin-Johnson syndrome[J]. Hepatology, 2002, 36(5): 1236-1245. DOI:10.1053/jhep.2002.36368 (  0) 0) |
| [10] |
Keitel V, Nies AT, Brom M, et al. A common Dubin-Johnson syndrome mutation impairs protein maturation and transport activity of MRP2(ABCC2)[J]. Am J Physiol Gastrointest Liver Physiol, 2003, 284(1): G165-G174. DOI:10.1152/ajpgi.00362.2002 (  0) 0) |
| [11] |
Paulusma CC, Kool M, Bosma PJ, et al. A mutation in the human canalicular multispecific organic anion transporter gene causes the Dubin-Johnson syndrome[J]. Hepatology, 1997, 25(6): 1539-1542. DOI:10.1002/(ISSN)1527-3350 (  0) 0) |
| [12] |
Togawa T, Mizuochi T, Sugiura T, et al. Clinical, pathologic, and genetic features of neonatal Dubin-Johnson syndrome:a multicenter study in Japan[J]. J Pediatr, 2018, 196: 161-167. DOI:10.1016/j.jpeds.2017.12.058 (  0) 0) |
| [13] |
Pacifico L, Carducci C, Poggiogalle E, et al. Mutational analysis of ABCC2 gene in two siblings with neonatal-onset Dubin Johnson syndrome[J]. Clin Genet, 2010, 78(6): 598-600. DOI:10.1111/cge.2010.78.issue-6 (  0) 0) |
| [14] |
Okada H, Kusaka T, Fuke N, et al. Neonatal Dubin-Johnson syndrome:novel compound heterozygous mutation in the ABCC2 gene[J]. Pediatr Int, 2014, 56(5): e62-e64. DOI:10.1111/ped.2014.56.issue-5 (  0) 0) |
| [15] |
Wada M, Toh S, Taniguchi K, et al. Mutations in the canilicular multispecific organic anion transporter (cMOAT) gene, a novel ABC transporter, in patients with hyperbilirubinemia Ⅱ/DubinJohnson syndrome[J]. Hum Mol Genet, 1998, 7(2): 203-207. DOI:10.1093/hmg/7.2.203 (  0) 0) |
| [16] |
Tsujii H, König J, Rost D, et al. Exon-intron organization of the human multidrug-resistance protein 2(MRP2) gene mutated in Dubin-Johnson syndrome[J]. Gastroenterology, 1999, 117(3): 653-660. DOI:10.1016/S0016-5085(99)70459-2 (  0) 0) |
| [17] |
Toh S, Wada M, Uchiumi T, et al. Genomic structure of the canalicular multispecific organic anion-transporter gene (MRP2/cMOAT) and mutations in the ATP-binding-cassette region in Dubin-Johnson syndrome[J]. Am J Hum Genet, 1999, 64(3): 739-746. DOI:10.1086/302292 (  0) 0) |
| [18] |
郭长吉, 林三仁, 李益农, 等. 腹腔镜和肝活检对DubinJohnson综合征诊断的价值[J]. 北京大学学报(医学版), 2000, 32(2): 128-130. DOI:10.3321/j.issn:1671-167X.2000.02.009 (  0) 0) |
| [19] |
张义红, 刘俊英, 曾广仙, 等. Dubin-Johnson综合征一例[J]. 中华医学遗传学杂志, 2003, 20(5): 446. DOI:10.3760/j.issn:1003-9406.2003.05.042 (  0) 0) |
| [20] |
林伟霞, 郑琪琪, 郭丽, 等. 首例非白人婴儿肝衰竭综合征1型患儿临床特点和分子诊断研究[J]. 中国当代儿科杂志, 2017, 19(8): 913-920. (  0) 0) |
| [21] |
程映, 梁红, 蔡娜莉, 等. 微绒毛包涵体病一家系临床特点和MYO5B基因突变分析[J]. 中国当代儿科杂志, 2017, 19(9): 968-974. (  0) 0) |
| [22] |
Kimura A, Yuge K, Kosai KI, et al. Neonatal cholestasis in two siblings:a variant of Dubin-Johnson syndrome?[J]. J Paediatr Child Health, 1995, 31(6): 557-560. DOI:10.1111/j.1440-1754.1995.tb00884.x (  0) 0) |
| [23] |
Memon N, Weinberger BI, Hegyi T, et al. Inherited disorders of bilirubin clearance[J]. Pediatr Res, 2016, 79(3): 378-386. DOI:10.1038/pr.2015.247 (  0) 0) |
| [24] |
Tsai WH, Teng RJ, Chu JS, et al. Neonatal Dubin-Johnson syndrome[J]. J Pediatr Gastroenterol Nutr, 1994, 18(2): 253-254. DOI:10.1097/00005176-199402000-00023 (  0) 0) |
| [25] |
Kimura A, Ushijima K, Kage M, et al. Neonatal Dubin-Johnson syndrome with severe cholestasis:effective phenobarbital therapy[J]. Acta Paediatr Scand, 1991, 80(3): 381-385. DOI:10.1111/apa.1991.80.issue-3 (  0) 0) |
| [26] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. DOI:10.1038/gim.2015.30 (  0) 0) |
| [27] |
余思邈, 朱云, 高含佳, 等. Dubin-Johnson综合征临床及病理特征[J]. 肝脏, 2017, 22(5): 404-405. DOI:10.3969/j.issn.1008-1704.2017.05.010 (  0) 0) |
| [28] |
Regev RH, Stolar O, Raz A, et al. Treatment of severe cholestasis in neonatal Dubin-Johnson syndrome with ursodeoxycholic acid[J]. J Perinat Med, 2002, 30(2): 185-187. (  0) 0) |
| [29] |
Bremmelgaard A, Sjövall J. Hydroxylation of cholic, chenodeoxycholic, and deoxycholic acids in patients with intrahepatic cholestasis[J]. J Lipid Res, 1980, 21(8): 1072-1081. (  0) 0) |
| [30] |
Back P. Phenobarbital-induced alterations of bile acid metabolism in cases of intrahepatic cholestasis[J]. Klin Wochenschr, 1982, 60(11): 541-549. DOI:10.1007/BF01724209 (  0) 0) |
| [31] |
Balistreri WF. Bile acid therapy in pediatric hepatobiliary disease:the role of ursodeoxycholic acid[J]. J Pediatr Gastroenterol Nutr, 1997, 24(5): 573-589. DOI:10.1097/00005176-199705000-00016 (  0) 0) |
| [32] |
Wagner M, Zollner G, Trauner M. New molecular insights into the mechanisms of cholestasis[J]. J Hepatol, 2009, 51(3): 565-580. DOI:10.1016/j.jhep.2009.05.012 (  0) 0) |
| [33] |
Fickert P, Zollner G, Fuchsbichler A, et al. Effects of ursodeoxycholic and cholic acid feeding on hepatocellular transporter expression in mouse liver[J]. Gastroenterology, 2001, 121(1): 170-183. DOI:10.1053/gast.2001.25542 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


