2. 暨南大学附属第一医院医学影像中心, 广东 广州 510630
单唾液酸四己糖神经节苷脂(monosialotetra-hexosyl ganglioside, GM1)神经节苷脂沉积病是一种由于半乳糖苷酶beta-1(galactosidase beta-1, GLB1)基因变异影响β-半乳糖苷酶(beta-galactosidase, GLB)活性的常染色体隐性遗传病[1]。GLBl基因编码两个不同的剪接产物,分别为含有667个氨基酸残基的细胞溶酶体β-半乳糖苷酶(GLB)及含有546个氨基酸残基的弹性蛋白结合蛋白(EBP)[1-4]。GLB负责降解神经节苷脂、糖蛋白、鞘脂或硫酸角蛋白等底物中的β-半乳糖苷键,其功能缺陷将造成GM1降解障碍而在溶酶体中逐渐贮积,最终引起一系列GMl神经节苷脂沉积病的临床表现[1, 3]。国外报道[1, 5-10]其发病率为1 : 200 000~1 : 100 000,大多为欧洲裔白人,日本患者也不少见。
GLB1基因检测被认为是确诊GMl神经节苷脂沉积病的重要手段[1, 11]。目前已发现超过200种GLB1基因致病性突变,包括错义突变、无义突变和插入或缺失突变,多集中于第2、6和15外显子[1, 12-13]。中文文献中GM1神经节苷脂沉积病多经β-半乳糖苷酶学分析确诊,经GLB1基因诊断的罕见[4],说明本病诊治经验需要进一步积累和总结。本文报道1例GM1神经节苷脂沉积病患儿的临床及遗传学特征,为提高对该病的认识提供参考。
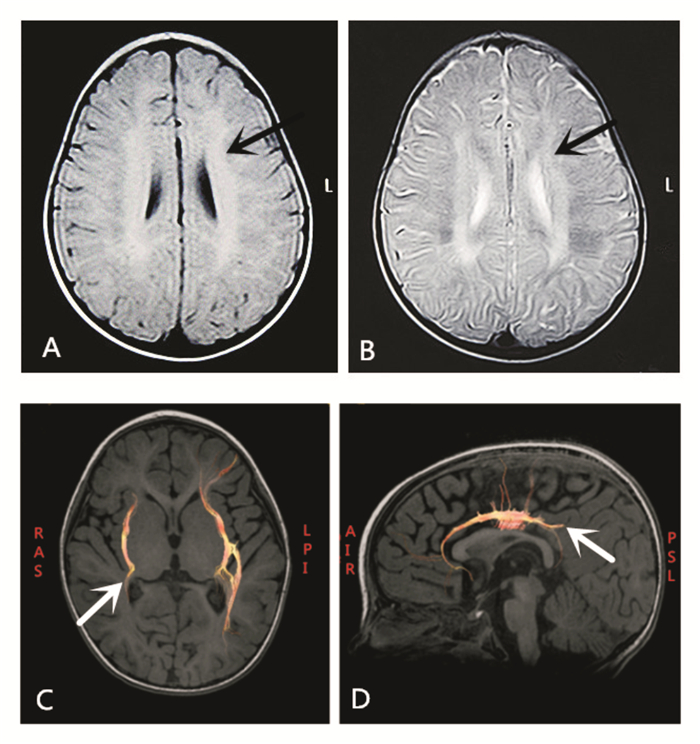
1 资料与方法 1.1 研究对象患儿,女,2岁5个月,因运动发育倒退19个月就诊。患儿在10月龄前,体格和运动发育正常,已经会坐、立及扶行,自13月龄起以上运动能力逐渐倒退。目前患儿竖头不稳,双手抓握能力差,不能独坐、爬行、站立及行走,伴有咀嚼困难和饮水呛咳。至今不会有意识地说“爸爸”、“妈妈”等。曾先后就诊于多家医院,2岁1个月时行24小时视频脑电图监测,发现频繁癫痫发作,弥漫性θ活动增多,右半球为著;头颅MRI(图 1A、B)显示双侧脑室周围白质变薄并见弥漫性T2WI高信号影,边界不清;白质纤维束三维重建(DTI)提示双侧大脑半球白质纤维束均细小、稀疏,以右侧为著(图 1C、D)。因诊断不明,病情无好转至我院儿科就诊。发病以来,反应较差,入睡困难,大小便无特殊。
|
图 1 患儿头颅MRI和DTI检查结果 头颅MRI的T1WI(A图)、T2WI相(B图)可见双侧脑室周围白质变薄、边界不清(箭头所示),T2WI相呈弥漫性高信号影;头颅DTI显示右侧大脑半球外囊区白质纤维束(C图箭头)和扣带束(D图箭头)发育细小、稀疏。 |
患儿系第一胎第一产,足月顺产出生,出生体重2 960 g、身长50 cm,出生时无窒息史。父母体健,非近亲结婚。否认遗传病家族史。
体格检查:体重12.5 kg,身长85 cm,头围48 cm。竖头不稳,表情呆板,对外界反应差。皮肤无黄染,浅表淋巴结无肿大,头颅五官无畸形,前囟已闭,巩膜无黄染,双侧瞳孔等大等圆、对光反射灵敏,双眼球右侧偏斜伴水平震颤,眼底镜未发现异常。双肺呼吸音清,未闻及干湿啰音,心音有力、律齐,各瓣膜听诊区未闻及杂音,腹软,肝脾不大。四肢肌张力高、以双下肢明显,肘、膝及踝关节活动受限,腹壁反射可引出,膝腱反射亢进,克氏、布氏和巴氏征均阴性。
辅助检查:血常规未见异常;生化检查示AST波动在100~165 U/L(参考值:5~40 U/L),余无明显异常;血气分析、电解质、乙肝抗体、甲状腺功能及全血微量元素检测未见异常;血氨基和脂酰基肉碱串联质谱分析示精氨酸、谷氨酰胺、组氨酸、鸟氨酸和丝氨酸升高,丁二酰基肉碱升高;尿有机酸谱分析未见异常有机酸代谢产物。
1.2 高通量外显子组捕获测序根据患儿婴儿期发病,具有运动发育倒退、频繁惊厥发作,不能排除遗传性脑病。采集患儿外周血2 mL,提取基因组DNA,通过高通量靶向测序技术检测(北京迈基诺基因科技有限公司)癫痫相关的ADSL、CACNA1A、CACNA1H、DHB、CLN3及GLB1等152个基因。测序平均深度不小于200×。根据原始序列数据,进行基因序列生物信息学分析,找出可能的致病基因突变。
1.3 Sanger测序验证提取患儿及其父母的外周血DNA,根据二代测序检测结果,对患儿及其父母的DNA标本进行GLB1基因突变的Sanger测序验证。根据GLB1基因的DNA序列,使用Primer Premier 5.0软件设计聚合酶链反应引物(表 1,北京迈基诺基因科技股份有限公司合成)。聚合酶链反应体系为:2×Goldstar Buffer Mix 10 μL,上下游引物各1 μL,DNA 1 μL(10 μmol/L),最后加灭菌双蒸水7 μL,共20 μL。95℃预变性10 min;随后分为4步,第1步:94℃变性30 s,62℃退火30 s,72℃延伸45 s,共3个循环;第2步:94℃变性30 s,60℃退火30 s,72℃延伸45 s,共5个循环;第3步:94℃变性30 s,58℃退火30 s,72℃延伸45 s,共10个循环;第4步:94℃变性30 s,56℃退火30 s,72℃延伸45 s,共17个循环;最后72℃延伸5 min。聚合酶链反应产物经琼脂糖凝胶电泳切胶纯化,送北京迈基诺基因科技股份有限公司进行测序。测序结果用Chromas软件进行分析,并应用DNAMAN软件与基因组GLB1-201参考序列进行比对(Ensemble Genome Browser: http://asia.ensembl.org/Homo sapiens/Transcript/Exons?db=core;g=ENSG0000017026;r=3:32996608-33097230;t=ENST00000307363)。
| 表 1 GLB1基因突变位点的Sanger测序引物 |
|
|
采用Mutation Taster(http://www.mutationtaster.org/)、PROVEAN(http://provean.jcvi.org/ seq_submit.php)、PolyPhen 2(http://genetics.bwh.harvard.edu/pph2/)、SIFT(http://sift.jcvi.org/www/SIFT_chr_coords_submit.html)等在线软件,预测突变基因的致病性。
为评估GLB1基因新变异c.101T > C(p.Ile34Thr)引起的蛋白质结构变化,使用SWISS-MODEL蛋白质建模服务器(https://swissmodel.expasy.org/)构建蛋白分子,将p.Ile34Thr野生型模型的第34位氨基酸由异亮氨酸(Ile)变成苏氨酸(Thr),并进行模型能量最小化,比对两者的构象差异。
本研究获得患儿父母知情同意。
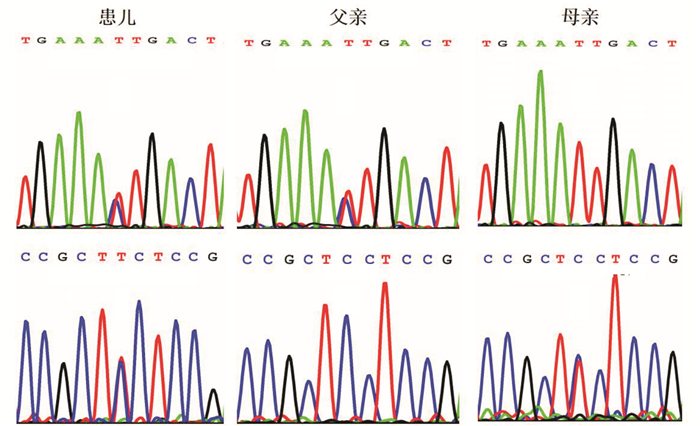
2 结果 2.1 遗传学分析结果高通量靶向测序及Sanger测序验证发现患儿GLB1基因存在两个错义变异,一个是位于外显子4的c.446C > T(p.Ser149Phe),另一个是位于外显子2的c.101T > C(p.Ile34Thr),其父母分别为相应变异的携带者。见图 2。
|
图 2 患儿及其父母GLB1基因突变的Sanger测序图 患儿GLB1基因存在c.446C > T和c.101T > C的复合杂合突变,其父母分别为c.101T > C和c.446C > T变异的携带者。突变位点如箭头所示。 |
经检索,中国知网、万方、维普以及Pubmed等数据库、人类基因突变数据库(human gene mutation database, HGMD,http://www.hgmd.cf.ac.uk/ac/index.php)和千人基因组计划人群数据库均未收录GLB1变异c.101T > C(p.Ile34Thr);c.446C > T(p.Ser149Phe)为已报道[6]的致病性变异。
MutationTaster软件预测GLB1基因变异c.101T > C可能影响GLB蛋白功能;PROVEAN软件预测得分-4.127,提示突变有害;PolyPhen 2预测得分0.989,提示变异可能有害;SIFT软件预测得分为0,提示变异对蛋白质的功能有影响。
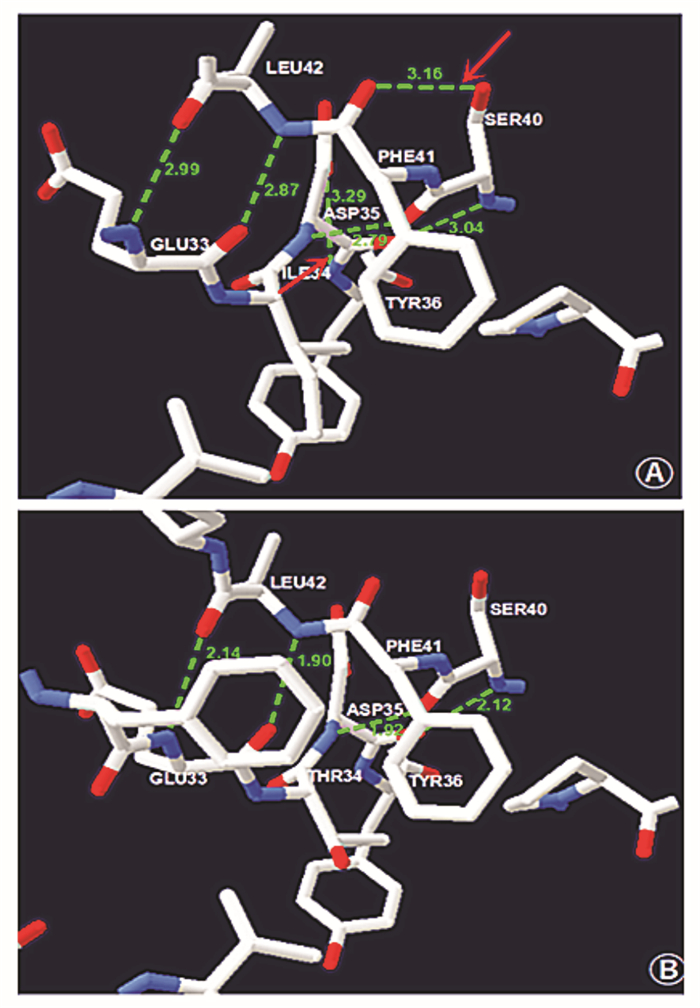
用SWISS-MODEL分别构建野生型和突变型GLB蛋白的3D模型(图 3),分析突变c.101T > C(p.Ile34Thr)对GLB结构造成的影响,显示第34位氨基酸由异亮氨酸变成苏氨酸后其附近氨基酸之间出现了氢键消失和距离改变,从而扭曲了GLB的分子构象。
|
图 3 SWISS-MODEL构建的野生型和突变型GLB蛋白3D模型 图A为野生型GLB蛋白结构模型,图B为突变后蛋白结构模型。图中绿色虚线表示氢键,相应数字表示氢键长度。图A红色箭头所指为存在于野生型GLB结构而在突变型结构中消失的氢键。 |
患儿婴儿期起病,表现为运动发育倒退、癫痫发作、眼球偏斜伴震颤、肌张力高,头颅MRI提示脑白质异常,结合NGS测序发现的GLB1基因复合杂合突变,最终确诊为GM1神经节苷脂沉积病。确诊后予丙戊酸钠、水合氯醛抗癫痫以及营养神经、促进大脑发育等治疗,并配合康复训练等治疗。2个月后竖头不稳有所减轻,但仍不能独坐、爬行、站立及行走,双手抓握能力未见好转。
3 讨论GM1神经节苷脂沉积病的特征为神经退行性病变,主要特点为精神运动发育倒退,但特异性不强;此外,该病累积的代谢物GM1神经节苷脂无法通过常规代谢检查手段识别,使得临床医生很难作出正确的诊断[11, 14]。近年来,高通量测序技术对神经遗传性疾病的病因诊断发挥了重要作用,尤其是靶向高通量测序技术能针对性地检测出来源于同一通路结构的多种遗传性疾病[14-16]。本研究患儿二代测序分析发现GLB1基因存在两个错义突变c.446C > T(p.Ser149Phe)和c.101T > C(p.Ile34Thr),为GM1神经节苷脂沉积病的确诊提供了可靠依据。
GM1型神经节苷脂沉积病可分为三种临床类型:Ⅰ型(婴儿型),生后6个月内发病,表现为精神运动发育迟缓伴倒退、肌张力低下、喂养困难、肝脾肿大、面部畸形如前额突出、鼻根宽、巨颅等,可见眼底黄斑和樱桃红斑、骨骼发育不良(如脊柱曲度异常、骨质密度改变),常常早期死亡;Ⅱ型(幼年型/青少年型),生后7个月至3岁发病,进展缓慢,症状主要包括运动和认知发育倒退、癫痫发作、斜视或骨骼变化如成骨发育不良,通常没有肝脾肿大和眼底樱桃红斑;Ⅲ型(成人/慢性型),3~30岁均可见发病,表现为锥体外系症状如肌张力障碍、步态异常或言语障碍,以上各型的表现存在部分重叠,以Ⅰ型的症状最为严重[1, 4, 13, 17-18]。GM1神经节苷脂沉积病常见的致死原因是吸入性肺炎和心肌病[19]。本例患儿13月龄起病,表现为运动发育倒退、癫痫发作、双眼偏斜伴眼球震颤、肌张力高,符合GM1神经节苷脂沉积病Ⅱ型的特点。
GM1型神经节苷脂病的头部MRI具有特征性表现[4, 14, 18-21]:(1)弥漫性脑萎缩和脑白质异常,白质T2加权相高信号;(2)丘脑T1高信号和T2低信号;(3)基底核及苍白球T2加权相低信号,壳核的T2加权相高信号。本研究患儿的MRI及DTI均提示脑白质异常,符合GM1神经节苷脂沉积病的影像学特点。此外,本文患儿血清AST升高而ALT正常。GM1神经节苷脂沉积病患者由于GLB酶活性不足,使得底物大量积累在重要器官如肝脏、心脏、骨骼和脑,造成细胞损伤和凋亡,AST在肝脏、心脏、肌肉等多种器官均有广泛分布,因此有研究[18, 22]认为,AST升高可作为GM1神经节苷脂沉积病诊断的早期生物标志物。
GLB1基因位于染色体3p21.33,全长62.5 kb,包含16个外显子[3]。人类GLB蛋白包含3个核心结构域:TIM桶状结构域(残基1-359)、β-结构域1(残基397-514)和β-结构域2(残基545-647)[23-24]。研究[24]发现,位于GLB基因晶体结构核心区域的大多数突变,尤其是负责催化作用的TIM桶状结构域的突变都可能对该基因所编码蛋白的结构和稳定性产生重大影响。迄今已报道了200多种GLB1基因致病性突变[12-13]。本文患儿GLB1基因的错义突变c.446C > T(p.Ser149Phe)为已报道致病性变异,与Morquio B综合征和GM1神经节苷脂沉积病发生有关[4, 6, 25]。c.101T > C(p.Ile34Thr)为新突变,经过多种生物学分析工具预测为有害变异。c.446C > T和c.101T > C两个错义变异导致的第149位氨基酸残基和第34位氨基酸残基改变均位于GLB蛋白的TIM桶状结构域[23-24],因此影响GLB蛋白活性,导致GM1神经节苷脂沉积病发生。
GM1神经节苷脂沉积病尚无根治方法,目前探讨较多的治疗有骨髓移植、基因治疗和酶替代疗法[1, 19, 26]。骨髓移植虽然能够使患者GLB水平回复到正常,但神经系统表现仍可继续恶化[26];而基因治疗和酶替代疗法(ERT)可能是较有前景的治疗方法[27-28],但ERT治疗的最大问题是无法透过血脑屏障。动物实验[26, 28-29]表明,静脉或者脑室内注射GLB1基因cDNA的重组体能够使得中枢神经系统中堆积的神经节苷脂明显减少。有研究[30]报道,将GLB与蓖麻毒素B链(RTB)融合蛋白导入体外培养的GM1神经节苷脂沉积病患者的成纤维细胞中,可有效清除细胞内堆积的神经节苷脂。RTB具有凝集素活性,而凝集素已被证明可以透过血脑屏障促进药物传递。本研究患儿经过抗癫痫、营养脑神经并配合康复训练等对症支持治疗,病情未见好转,远期预后有待跟踪。
综上所述,本文报道1例GM1神经节苷脂沉积病的临床及遗传学特征,发现GLB1基因的一个新突变c.101T > C(p.Ile34Thr),扩展了GM1神经节苷脂沉积病的GLB1基因突变谱,为确诊和家系遗传咨询提供了实验依据。
| [1] |
Brunetti-Pierri N, Scaglia F. GM 1 gangliosidosis:Review of clinical, molecular, and therapeutic aspects[J]. Mol Gene Metab, 2008, 94(4): 391-396. DOI:10.1016/j.ymgme.2008.04.012 (  0) 0) |
| [2] |
O'Brien JS, Stern MB, Landing BH, et al. Generalized gangliosidosis:Another inborn error of ganglioside metabolism?[J]. Am J Dis Child, 1965, 109: 338-346. DOI:10.1001/archpedi.1965.02090020340014 (  0) 0) |
| [3] |
Okada S, O'Brien JS. Generalized gangliosidosis:betagalactosidase deficiency[J]. Science, 1968, 160(3831): 1002-1004. DOI:10.1126/science.160.3831.1002 (  0) 0) |
| [4] |
冀浩然, 肖江喜, 李东晓, 等. GM1神经节苷脂累积病6例患儿临床及遗传学研究[J]. 中华实用儿科临床杂志, 2016, 31(20): 1536-1540. DOI:10.3760/cma.j.issn.2095-428X.2016.20.004 (  0) 0) |
| [5] |
Sinigerska I, Chandler D, Vaghjiani V, et al. Founder mutation causing infantile GM1-gangliosidosis in the Gypsy population[J]. Mol Genet Metab, 2006, 88(1): 93-95. DOI:10.1016/j.ymgme.2005.12.009 (  0) 0) |
| [6] |
Hofer D, Paul K, Fantur K, et al. GM1 gangliosidosis and Morquio B disease:expression analysis of missense mutations affecting the catalytic site of acid β-galactosidase[J]. Hum Mutat, 2009, 30(8): 1214-1221. DOI:10.1002/humu.v30:8 (  0) 0) |
| [7] |
Baiotto C, Sperb F, Matte U, et al. Population analysis of the GLB1 gene in south Brazil[J]. Genet Mol Biol, 2011, 34(1): 45-48. DOI:10.1590/S1415-47572011000100009 (  0) 0) |
| [8] |
Sperb F, Vairo F, Burin M, et al. Genotypic and phenotypic characterization of Brazilian patientswith GM1 gangliosidosis[J]. Gene, 2013, 512(1): 113-116. DOI:10.1016/j.gene.2012.09.106 (  0) 0) |
| [9] |
Santamaria R, Chabás A, Coll MJ, et al. Twenty-one novel mutations in the GLB1 gene identified in a large group of GM1-gangliosidosis and Morquio B patients:possible common origin for the prevalent p. R59H mutation among gypsies[J]. Hum Mutat, 2006, 27(10): 1060. (  0) 0) |
| [10] |
Muthane U, Chickabasaviah Y, Kaneski C, et al. Clinical features of adult GM1 gangliosidosis:report of three Indian patients and review of 40 cases[J]. Move Disord, 2004, 19(11): 1334-1341. DOI:10.1002/mds.v19:11 (  0) 0) |
| [11] |
Pierson TM, Adams DA, Markello T, et al. Exome sequencing as a diagnostic tool in a case of undiagnosed juvenile-onset GM1-gangliosidosis[J]. Neurology, 2012, 79(2): 123-126. DOI:10.1212/WNL.0b013e31825f047a (  0) 0) |
| [12] |
Nestrasil I, Ahmed A, Utz JM, et al. Distinct progression patterns of brain disease in infantile and juvenile gangliosidoses:Volumetric quantitative MRI study[J]. Mol Gene Metab, 2018, 123(2): 97-104. DOI:10.1016/j.ymgme.2017.12.432 (  0) 0) |
| [13] |
Deodato F, Procopio E, Rampazzo A, et al. The treatment of juvenile/adult GM1-gangliosidosis with Miglustat may reverse disease progression[J]. Metab Brain Dis, 2017, 32(5): 1529-1536. DOI:10.1007/s11011-017-0044-y (  0) 0) |
| [14] |
Takenouchi T, Kosaki R, Nakabayashi K, et a1. Paramagnetie signals in the globus pallidus as late radiographic sign of juvenile-onset GMl gangliosidosis[J]. Pediatr Neurol, 2015, 52(2): 226-229. DOI:10.1016/j.pediatrneurol.2014.09.022 (  0) 0) |
| [15] |
Samorodnitsky E, Datta J, Jewell BM, et al. Comparison of custom capture for targeted next-generation DNA sequencing[J]. J Mol Diagn, 2015, 17(1): 64-75. DOI:10.1016/j.jmoldx.2014.09.009 (  0) 0) |
| [16] |
Xue Y, Ankala A, Wilcox WR, et al. Solving the molecular diagnostic testing conundrum for Mendelian disorders in the era of next-generation sequencing:single-gene, gene panel, or exome/genome sequencing[J]. Genet Med, 2015, 17(6): 444-451. DOI:10.1038/gim.2014.122 (  0) 0) |
| [17] |
齐朝月, 张尧, 宋金青, 等. 婴儿型GM1神经节苷脂沉积病5例临床及影像学分析[J]. 临床儿科杂志, 2006, 24(12): 966-969. DOI:10.3969/j.issn.1000-3606.2006.12.009 (  0) 0) |
| [18] |
Lee JS, Choi JM, Lee M, et al. Diagnostic challenge for the rare lysosomal storage disease:Late infantile GM1 gangliosidosis[J]. Brain Dev, 2018, 40(5): 383-390. DOI:10.1016/j.braindev.2018.01.009 (  0) 0) |
| [19] |
Jarnes Utz JR, Kim S, King K, et al. Infantile gangliosidoses:Mapping a timeline of clinical changes[J]. Mol Gene Metab, 2017, 121(2): 170-179. DOI:10.1016/j.ymgme.2017.04.011 (  0) 0) |
| [20] |
Tuteja M, Bidchol AM, Girisha KM, et al. White matter changes in GM1 gangliosidosis[J]. Indian Pediatr, 2015, 52(2): 155-156. DOI:10.1007/s13312-015-0593-2 (  0) 0) |
| [21] |
Vieira JP, Conceição C, Scortenschi E. GM1 gangliosidosis, late infantile onset dystonia, and T2 hypointensity in the globuspallidus and substantia Nigra[J]. Pediatr Neurol, 2013, 49(3): 195-197. DOI:10.1016/j.pediatrneurol.2013.02.003 (  0) 0) |
| [22] |
Gray-Edwards HL, Reqier DS, Shirley JL, et al. Novel biomarkers of human GM1 gangliosidosis reflect the clinical efficacy of gene therapy in a feline model[J]. Mol Ther, 2017, 25(4): 892-903. DOI:10.1016/j.ymthe.2017.01.009 (  0) 0) |
| [23] |
Ohto U, Usui K, Ochi T, et al. Crystal structure of human β-galactosidase:structural basis of GM1 gangliosidosis and morquio B diseases[J]. J Biol Chem, 2012, 287(3): 1801-1812. DOI:10.1074/jbc.M111.293795 (  0) 0) |
| [24] |
Reardon D, Farber GK. The structure and evolution of alpha/beta barrel proteins[J]. FASEB J, 1995, 9(7): 497-503. DOI:10.1096/fasebj.9.7.7737457 (  0) 0) |
| [25] |
Fantur KM, Wrodnigg TM, Stütz AE, et al. Fluorous iminoalditols act as effective pharmacological chaperones against gene products from GLB1 alleles causing GM1-gangliosidosis and Morquio B disease[J]. J Inherit Metab Dis, 2012, 35(3): 495-503. DOI:10.1007/s10545-011-9409-2 (  0) 0) |
| [26] |
Hayward C, Patel HC, Manohar SG, et al. Gene therapy for GM1 gangliosidosis:challenges of translational medicine[J]. Ann Transl Med, 2015, 3(Suppl 1): S28. (  0) 0) |
| [27] |
Regier DS, Proia RL, D'Azzo A, et al. The GM1 and GM2 gangliosidoses:natural history and progress toward therapy[J]. Pediatr Endocrinol Rev, 2016, 13(Suppl 1): 663-673. (  0) 0) |
| [28] |
Takaura N, Yagi T, Maeda M, et al. Attenuation of ganglioside GM1 accumulation in the brain of GM1gangliosidosis mice by neonatal intravenous gene transfer[J]. Gene Ther, 2003, 10(17): 1487-1493. DOI:10.1038/sj.gt.3302033 (  0) 0) |
| [29] |
Broekman ML, Baek RC, Comer LA, et al. Complete correction of enzymatic deficiency and neurochemistry in the GM1-gangliosidosis mouse brain by neonatal adeno-associated virusmediated gene delivery[J]. Mol Ther, 2007, 15(1): 30-37. DOI:10.1038/sj.mt.6300004 (  0) 0) |
| [30] |
Condori J, Acosta W, Ayala J, et al. Enzyme replacement for GM1 gangliosidosis:uptake, lysosomal activation, and cellular disease correction using a novel β-galactosidase:RTB lectin fusion[J]. Mol Genet Metab, 2016, 117(2): 199-209. DOI:10.1016/j.ymgme.2015.12.002 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


