先天性巨结肠(Hirschsprung′s disease, HSCR)是最常见的先天性消化道发育畸形之一。其主要特征是肠神经嵴细胞(enteric neural crest cell, ENCCs)在胚胎发育过程中未能侵入、增殖和向下迁移到后肠,导致结肠黏膜下层和肌肉层中神经节细胞缺乏,肠管持续痉挛,粪便淤滞于近端结肠,继而引起近端结肠肥厚、扩张[1-3]。
近年来有研究发现,HSCR患儿病变结肠组织中胶质细胞源性神经营养因子受体α1(glial cell line-derived neurotrophic factor family receptor α1, GFRα1)表达水平显著低于正常结肠组织[4]。小鼠模型中敲除GFRα1基因后,新生小鼠出现巨结肠类似症状,如腹部肿胀、恶病质及呆滞等;尸体解剖发现,从回肠远端到中结肠之间有明显的肠扩张[5]。可见,GFRα1表达缺陷是HSCR发生的重要原因,但其分子机制不明。
果蝇Zeste基因增强子人类同源物2(enhancer of zeste homolog 2, EZH2),是组蛋白H3第27位赖氨酸(H3K27)的特异性甲基化转移酶,通过催化靶基因组蛋白H3K27三甲基化(H3K27me3)修饰介导其表达沉默[6-8]。EZH2敲除小鼠出现颅颌面软骨形成缺陷、神经嵴发育及迁移障碍,其肠神经系统中神经节细胞数量也显著减少[9-12]。但HSCR患儿是否存在EZH2表达缺陷目前未见报道。EZH2与GFRα1表达缺陷都会导致巨结肠类似症状的出现,那么EZH2与GFRα1之间是否存在调控关系,HSCR患儿GFRα1表达不足是否与EZH2低表达有关?本研究拟通过比较HSCR患儿病变结肠组织与新生儿坏死性小肠结肠炎(neonatal necrotizing enterocolitis, NEC)患儿结肠组织中EZH2、GFRα1表达水平,及在SH-SY5Y神经细胞中过表达EZH2后检测GFRα1表达变化,初步证实EZH2对GFRα1表达的调控作用,为HSCR患儿无神经节结肠组织中GFRα1的表达异常提供新的分子机制。
1 资料与方法 1.1 研究对象选择2016年3月至2018年6月我院新生儿外科确诊的24例HSCR患儿为研究对象,所有患儿均行巨结肠根治术,取痉挛段结肠组织为试验组。选择同期18例确诊为NEC而接受手术治疗的患儿,术中切除坏死结肠组织为对照组。两组一般情况差异无统计学意义(P > 0.05),见表 1。
| 表 1 两组患儿的一般情况比较 |
|
|
所有采集的新鲜样本在手术处理后立即冷冻,然后在-80℃保存备用。本研究经湖南省儿童医院伦理委员会审查并批准(HCHLL-2016-22),患儿家属均知情同意并签字。
1.2 实时荧光定量PCR检测mRNA表达将组织块直接放入研钵中,加入少量液氮并迅速研磨,待组织变软,再次加入液氮后研磨,重复3次。然后将粉碎后组织按每100 mg加入1 mL Trizol(Invitrogen, CA, USA),转移入离心管并置于冰上,用电动匀浆器充分匀浆1~2 min。以4℃、12 000 rpm离心5 min,弃沉淀后按每毫升Trizol加入200 μL氯仿,振荡15 s混匀后室温放置10 min。后续按常规Trizol法抽提取RNA。使用SuperScriptⅡreverse transcriptase试剂盒(Invitrogen)将RNA逆转录成cDNA。采用SYBR Green荧光染料法进行实时荧光定量PCR(ABI Prism 7500, CA, USA),引物序列见表 2。以人3-磷酸甘油醛脱氢酶(GAPDH)基因为内参照,比较CT值法(2-ΔΔCt法)测定目的基因的相对表达量。
| 表 2 实时荧光定量PCR的引物序列 |
|
|
将100 mg组织块用干净剪刀尽量剪碎,剪碎后组织置于2 mL玻璃匀浆器中,并加入含1% PMSF的RIPA裂解液(强)(碧云天)300 μL,置于冰上进行匀浆。裂解30 min后,将裂解液移至1.5 mL离心管中,4℃、12 000 rpm离心5 min,上清分装后置于-20℃保存备用。每个样本取30 μg进行SDS-PAGE凝胶电泳,电转印法将蛋白从凝胶上转移到PVDF膜上,5%脱脂牛奶作为封闭液室温封闭转印膜1 h,加入一抗anti-GFRα1、anti-EZH2及anti-GAPDH抗体(Cell Signaling Technology, MA, USA),4℃孵育过夜,1×TBST洗膜后加入二抗,室温孵育1 h后显影。用ImageJ分析软件分析显影结果。每组至少包含3个平行样本。
1.4 人神经母细胞瘤细胞SH-SY5Y培养、分组及处理SH-SY5Y细胞置于高糖DMEM培养基中(含青霉素100 U/mL、链霉素100 μg/mL、10% FBS),在37℃、5% CO2的细胞培养箱中培养。收获对数生长期细胞,并调整细胞密度为1×105/mL,细胞悬液接种于6孔细胞培养板中继续培养。接种细胞分成2组,即EZH2过表达组和阴性对照组,每组包含3个平行孔。细胞生长达50%~60%融合度时,使用TransFastTM Transfection Reagent(Promega, MI, USA)进行质粒转染。EZH2过表达组转染pCMV6-EZH2质粒,阴性对照组转染pCMV6质粒。转染72 h后收集细胞,分别抽提总RNA及总蛋白并检测。
1.5 统计学分析采用SPSS 22.0软件进行数据处理。正态分布计量资料以均数±标准差(x±s)表示,组间比较采用独立样本t检验;二变量相关分析采用Pearson法。P < 0.05表示差异有统计学意义。
2 结果 2.1 两组结肠组织样本中GFRα1的表达水平差异试验组GFRα1 mRNA表达水平较对照组降低(0.38±0.17 vs 0.97±0.36,t=-6.397,P=0.005);试验组GFRα1蛋白表达水平较对照组降低(0.55±0.14 vs 0.99±0.16,t=-9.505,P=0.003)。见图 1。
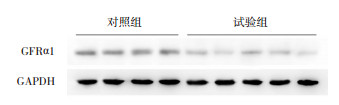
|
图 1 两组结肠组织样本中GFRα1蛋白表达的Western blot条带图 试验组GFRα1蛋白表达水平低于对照组。 |
试验组EZH2 mRNA表达水平较对照组降低(0.22±0.08 vs 1.29±0.38,t=-11.293,P < 0.001)。试验组EZH2蛋白表达水平较对照组降低(0.28±0.13 vs 0.76±0.09,t=-12.968,P < 0.001),见图 2。且EZH2蛋白与GFRα1蛋白表达水平呈正相关(r=0.606,P=0.002),见图 3。
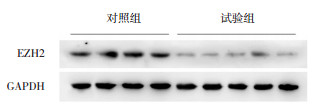
|
图 2 两组结肠组织样本中EZH2蛋白表达的Western blot条带图 试验组EZH2蛋白表达水平低于对照组。 |
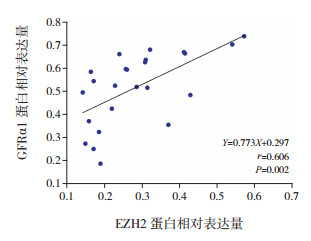
|
图 3 HSCR患儿病变结肠组织中EZH2蛋白与GFRα1蛋白表达水平相关性分析 |
EZH2过表达组EZH2、GFRα1 mRNA和蛋白水平较阴性对照组上调(P < 0.05),见表 3、图 4。
| 表 3 EZH2过表达组和阴性对照组EZH2及GFRα1 mRNA和蛋白表达水平比较 (x±s) |
|
|

|
图 4 转染SH-SY5Y细胞后EZH2及GFRα1蛋白表达的Western blot条带图 EZH2过表达组EZH2、GFRα1蛋白水平高于阴性对照组。 |
胶质细胞源性神经营养因子(glial cell-derived neurotrophic factor, GDNF)及其受体GFRα1和酪氨酸蛋白激酶受体RET信号通路是调节ENCCs在肠道内发育形成肠神经系统过程中最为关键的因子,与HSCR的发生发展密切相关[13-15]。GDNF能特异性地与GFRα1结合,然后与RET结合形成复合物,介导RET磷酸化,进而激活RET信号通路,导致一系列胞内途径的激活,从而发挥GDNF神经营养因子的生理功能[16-19]。GDNF/GFRα1/RET信号通路缺失是HSCR发生的重要原因,其中HSCR患儿GDNF及RET的表达缺失与其基因突变密切相关[1]。约50%的家族性HSCR及15%~20%的散发性HSCR发生RET基因突变。HSCR患儿中已检测到约90种RET基因突变,包括错义突变、同义突变、小片段插入和缺失。这些突变散在分布于整个基因编码区域,大部分均影响RET蛋白功能[20-22]。HSCR患儿中GDNF基因突变率为0.9%~5.5%,可单独出现也可与RET基因突变并存。目前已检测到的GDNF基因突变有P21S、R93W、D150N、T154S、I211M,其中P21S位于信号肽水解部位,其余均位于蛋白功能域。但尚无确切证据证实单纯GDNF基因突变会导致HSCR发生[23]。通过对HSCR患儿GFRα1基因进行检测,并未发现该基因存在突变[4, 24]。因此,HSCR患儿GFRα1表达缺失的原因一直未明。本研究发现,HSCR患儿病变结肠组织中EZH2和GFRα1的mRNA和蛋白表达水平显著低于对照组,且二者蛋白表达水平呈正相关,即EZH2表达越低,GFRα1表达缺失越严重。在人神经母细胞瘤细胞SH-SY5Y中过表达EZH2后能显著上调GFRα1表达。以上结果说明在神经细胞中,EZH2可能是调节GFRα1表达的重要因子,HSCR患儿病变结肠组织中GFRα1表达不足,可能与EZH2低表达有关。本研究为HSCR患儿GFRα1表达不足提供了一定的解释。
近年来,越来越多的研究关注到EZH2是神经嵴细胞的发育及迁移过程中重要的调节因子[9]。EZH2敲除小鼠出现肠神经系统中神经节细胞的缺乏[12],但无直接证据显示HSCR患儿病变结肠组织中存在EZH2表达不足,而本研究有力的证实了这点。虽然明确了HSCR患儿存在EZH2表达不足,但其参与HSCR发病的分子机制目前不明。转录因子Pax3、Zic1、Sox10是神经嵴细胞生长必不可少的编码转录因子[25-27]。在神经系统的发育中,Pax3和Zic1确定神经板的边界,而Sox10能维持神经嵴细胞的多功能性。此外,Sox10与Pax3能相互协作,激活RET转录。但Pax3、Zic1、Sox10的异常表达也会引起神经系统的发育异常。有报道发现,在神经嵴细胞发育后期Pax3的异常表达会导致小鼠出现腭裂和成骨异常,在神经嵴细胞迁移过程中Zic1的表达受到抑制。在人类患者和小鼠模型中均发现Sox10的异常表达与肠神经节细胞减少有关[12, 27]。小鼠胚胎发育过程中EZH2能上调Pax3、Zic1、Sox10基因的启动子区组蛋白H3K27me3,抑制其表达。EZH2敲除小鼠肠道Pax3、Zic1、Sox10基因表达显著升高,神经节细胞数量明显减少[12]。以上研究为EZH2低表达参与HSCR发病的分子机制提供了一定解释。本研究通过证实EZH2是GFRα1表达的重要调节因子,为HSCR患儿GFRα1表达不足提供了解释,也进一步完善了EZH2低表达参与HSCR发病的分子机制。
鉴于EZH2的直接效应是催化组蛋白H3K27甲基化,进而抑制基因转录,因此,我们推测EZH2是通过下调GFRα1表达相关抑制因子的表达,进而间接上调GFRα1表达。但EZH2直接靶向的GFRα1表达相关抑制因子是什么目前未知,这也是本研究目前的不足之处。后续我们会通过生物信息学软件对GFRα1启动子进行转录因子结合位点分析,并与EZH2靶基因结果进行交叉分析,以期找出EZH2靶向的GFRα1表达抑制因子,进一步完善本文提出的HSCR新的发病分子机制。
综上所述,结肠组织中低表达EZH2可能是引起GFRα1表达不足,诱发HSCR的重要原因。本研究丰富了HSCR的病因学,为HSCR治疗提供了新的功能位点。
| [1] |
Amiel J, Sproat-Emison E, Garcia-Barcelo M, et al. Hirschsprung disease, associated syndromes and genetics:a review[J]. J Med Genet, 2008, 45(1): 1-14. (  0) 0) |
| [2] |
Alves MM, Sribudiani Y, Brouwer RW, et al. Contribution of rare and common variants determine complex diseases-Hirschsprung disease as a model[J]. Dev Biol, 2013, 382(1): 320-329. DOI:10.1016/j.ydbio.2013.05.019 (  0) 0) |
| [3] |
甄亚琴, 徐纪荣. 先天性巨结肠的研究进展[J]. 中国当代医药, 2015, 22(34): 21-24. (  0) 0) |
| [4] |
Lui VC, Samy ET, Sham MH, et al. Glial cell line-derived neurotrophic factor family receptors are abnormally expressed in aganglionic bowel of a subpopulation of patients with Hirschsprung's disease[J]. Lab Invest, 2002, 82(6): 703-712. DOI:10.1097/01.LAB.0000017364.13014.AE (  0) 0) |
| [5] |
Porokuokka LL, Virtanen HT, Lindén J, et al. Gfra1 underexpression causes Hirschsprung's disease and associated enterocolitis in mice[J]. Cell Mol Gastroenterol Hepatol, 2019, 7(3): 655-678. DOI:10.1016/j.jcmgh.2018.12.007 (  0) 0) |
| [6] |
Chen J, Zhang YC, Huang C, et al. m 6A regulates neurogenesis and neuronal development by modulating histone methyltransferase Ezh2[J]. Genomics Proteomics Bioinformatics, 2019, 17(2): 154-168. (  0) 0) |
| [7] |
Wever I, Wagemans CMRJ, Smidt MP. EZH2 is essential for fate determination in the mammalian isthmic area[J]. Front Mol Neurosci, 2019, 12: 76. DOI:10.3389/fnmol.2019.00076 (  0) 0) |
| [8] |
Zhou J, Huang S, Wang Z, et al. Targeting EZH2 histone methyltransferase activity alleviates experimental intestinal inflammation[J]. Nat Commun, 2019, 10(1): 2427. DOI:10.1038/s41467-019-10176-2 (  0) 0) |
| [9] |
Schwarz D, Varum S, Zemke M, et al. Ezh2 is required for neural crest-derived cartilage and bone formation[J]. Development, 2014, 141(4): 867-877. DOI:10.1242/dev.094342 (  0) 0) |
| [10] |
Tien CL, Jones A, Wang H, et al. Snail2/Slug cooperates with Polycomb repressive complex 2(PRC2) to regulate neural crest development[J]. Development, 2015, 142(4): 722-731. (  0) 0) |
| [11] |
Minoux M, Holwerda S, Vitobello A, et al. Gene bivalency at Polycomb domains regulates cranial neural crest positional identity[J]. Science, 2017, 355(6332). pii: eaal2913. https://www.ncbi.nlm.nih.gov/pubmed/28360266
(  0) 0) |
| [12] |
Kim H, Langohr IM, Faisal M, et al. Ablation of Ezh2 in neural crest cells leads to aberrant enteric nervous system development in mice[J]. PLoS One, 2018, 13(8): e0203391. DOI:10.1371/journal.pone.0203391 (  0) 0) |
| [13] |
Mwizerwa O, Das P, Nagy N, et al. Gdnf is mitogenic, neurotrophic, and chemoattractive to enteric neural crest cells in the embryonic colon[J]. Dev Dyn, 2011, 240(6): 1402-1411. DOI:10.1002/dvdy.22630 (  0) 0) |
| [14] |
Schriemer D, Sribudiani Y, IJpma A, et al. Regulators of gene expression in Enteric Neural Crest Cells are putative Hirschsprung disease genes[J]. Dev Biol, 2016, 416(1): 255-265. DOI:10.1016/j.ydbio.2016.06.004 (  0) 0) |
| [15] |
Lai FP, Lau ST, Wong JK, et al. Correction of Hirschsprungassociated mutations in human induced pluripotent stem cells via clustered regularly interspaced short palindromic repeats/Cas9, restores neural crest cell function[J]. Gastroenterology, 2017, 153(1): 139-153. e8. DOI:10.1053/j.gastro.2017.03.014 (  0) 0) |
| [16] |
Goodman KM, Kjær S, Beuron F, et al. RET recognition of GDNF-GFRα1 ligand by a composite binding site promotes membrane-proximal self-association[J]. Cell Rep, 2014, 8(6): 1894-1904. DOI:10.1016/j.celrep.2014.08.040 (  0) 0) |
| [17] |
Meka DP, Müller-Rischart AK, Nidadavolu P, et al. Parkin cooperates with GDNF/RET signaling to prevent dopaminergic neuron degeneration[J]. J Clin Invest, 2015, 125(5): 1873-1885. DOI:10.1172/JCI79300 (  0) 0) |
| [18] |
Wei R, Qiu X, Wang S, et al. NEDL2 is an essential regulator of enteric neural development and GDNF/Ret signaling[J]. Cell Signal, 2015, 27(3): 578-586. DOI:10.1016/j.cellsig.2014.12.013 (  0) 0) |
| [19] |
邢晓滨, 张卓伯, 潘春联, 等. GDNF对神经干细胞增殖、分化的影响[J]. 现代生物医学进展, 2015, 15(33): 6583-6586. (  0) 0) |
| [20] |
Wu W, Lu L, Xu W, et al. Whole exome sequencing identifies a novel pathogenic RET variant in Hirschsprung disease[J]. Front Genet, 2019, 9: 752. DOI:10.3389/fgene.2018.00752 (  0) 0) |
| [21] |
Yang D, Yang J, Li S, et al. Effects of RET, NRG1 and NRG3 polymorphisms in a Chinese population with Hirschsprung disease[J]. Sci Rep, 2017, 7: 43222. DOI:10.1038/srep43222 (  0) 0) |
| [22] |
Kawano T, Hosomichi K, Inoue I, et al. Identification of a novel variant of the RET proto-oncogene in a novel family with Hirschsprung's disease[J]. Pediatr Surg Int, 2017, 33(10): 1041-1046. DOI:10.1007/s00383-017-4134-z (  0) 0) |
| [23] |
Borghini S, Bocciardi R, Bonardi G, et al. Hirschsprung associated GDNF mutations do not prevent RET activation[J]. Eur J Hum Genet, 2002, 10(3): 183-187. DOI:10.1038/sj.ejhg.5200785 (  0) 0) |
| [24] |
Angrist M, Jing S, Bolk S, et al. Human GFRA1:cloning, mapping, genomic structure, and evaluation as a candidate gene for Hirschsprung disease susceptibility[J]. Genomics, 1998, 48(3): 354-362. DOI:10.1006/geno.1997.5191 (  0) 0) |
| [25] |
Xu M, Li Y, Du J, et al. PAX3 promotes cell migration and CXCR4 gene expression in neural crest cells[J]. J Mol Neurosci, 2018, 64(1): 1-8. DOI:10.1007/s12031-017-0995-9 (  0) 0) |
| [26] |
Sun Rhodes LS, Merzdorf CS. The zic1 gene is expressed in chick somites but not in migratory neural crest[J]. Gene Expr Patterns, 2006, 6(5): 539-545. DOI:10.1016/j.modgep.2005.10.006 (  0) 0) |
| [27] |
Sham MH, Lui VC, Fu M, et al. SOX10 is abnormally expressed in aganglionic bowel of Hirschsprung's disease infants[J]. Gut, 2001, 49(2): 220-226. DOI:10.1136/gut.49.2.220 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


