2. 湖南省人民医院/湖南师范大学附属第一医院超声医学科, 湖南 长沙 410005
凋亡信号调节激酶1(apoptosis signal-regulating kinase 1, ASK1)是细胞丝裂原活化蛋白激酶家族成员之一。ASK1在细胞凋亡信号传导过程中具有重要作用,ASK1被激活后可促使细胞凋亡,导致组织损伤[1]。近年来,ASK1在心血管疾病的发病机制和防治研究中受到重视[2-3]。本课题组前期研究也发现ASK1在扩张型心肌病大鼠模型中有明显增高[4],最近Budas等[5]研究发现ASK1抑制剂能阻止动物模型肺动脉高压的进展,能显著抑制右心室的病理性重塑,结果提示ASK1可能是心脏重塑过程中的关键酶。
临床上心力衰竭、高血压、心肌病、心肌梗塞等心血管疾病影响患者预后和生活质量的病理生理因素主要为左心室重塑。有研究表明儿茶酚胺类激素水平增加可直接导致左心室重塑[6]。目前ASK1在左心室重塑中的研究鲜见报道,有待进一步研究。因此,本研究通过异丙肾上腺素(isoprenaline, ISO)模拟内源性儿茶酚胺,通过腹腔注射ISO建立FVB/N小鼠心脏重塑模型,探索ASK1在左心室心肌肥厚和心室纤维化过程中的变化及其意义,为探索心脏重塑机制及临床治疗靶点提供实验依据。
1 材料与方法 1.1 实验动物及分组12周龄雄性FVB/N小鼠(广州赛业生物科技有限公司)54只,平均体重24.7±2.1 g,前期研究表明随着ISO应用的累积剂量的增加小鼠死亡率明显增加[7],因此,经验性增加相应组别入组小鼠数量。将54只FVB/N小鼠编号后利用随机化数字表进行完全随机分组,随机将FVB/N小鼠分为0 d组(n=8)、7 d组(n=10)、14 d组(n=16)和21 d组(n=20)。饲养环境温度为25±2℃,12 h明/暗交替,所有动物实验遵守生物医学研究伦理要求。
1.2 心脏重塑模型建立参照前期实验[7]建立模型,给予7 d组、14 d组和21 d组FVB/N小鼠腹腔注射ISO(#15627,美国Sigma公司),分别连续注射7、14和21 d。ISO剂量为每日30 mg/kg,分2次注射,每次间隔12 h;0 d组作为对照,腹腔注射等量生理盐水。根据小鼠心脏超声、心脏病理切片结果验证模型是否构建成功。
1.3 心脏超声检测实验结束后次日进行小鼠心脏超声检测。10%水合氯醛麻醉小鼠,采用ALOKA Qrosound a10 Premier超声仪,以14 MHz高频心脏探头选择胸骨旁左心室长轴切面测量舒张末期左心室后壁厚度(left ventricular posterior wall thickness at end diastole, dLVPW)。连续测量3个心动周期的参数,计算均值。
1.4 心脏肥厚和心脏胶原分布检测实验结束后次日将小鼠颈椎脱臼,处死后立即取出心脏,冷PBS缓冲液冲洗去血液,滤纸吸干游离水分,称重;测量胫骨长度,计算心胫比(heart weight/tibia length, HW/TL)。经乳头肌水平横切心脏,将左心室心尖置于4%多聚甲醛溶液中,经脱水、石蜡包埋后制成组织腊块,与心脏长轴垂直包埋心尖组织并进行切片,石蜡切片厚度5 μm,随后分别进行苏木精-伊红(HE)染色和天狼猩红染色;每只小鼠组织样本随机选取5张切片,每张切片随机选择10个视野,应用Image Pro Plus 6.0软件(Media Cybernetics,美国)观察心肌胶原分布,测量和计算胶原面积占心脏面积百分比及小鼠心肌纤维直径。
1.5 荧光定量PCR检测mRNA水平取左心室心尖部分提取总RNA。采用First Strand cDNA Synthesis Kit试剂盒(日本TOYOBO公司)合成cDNA。引物由美国Invitrogen公司设计并合成;ASK1序列:上游引物5′-AAAAGGACGGGAAAGGGATAC-3′,下游引物5′-CGAGATGAGGGTTGTGATGTG-3′,片段长度257 bp;B型脑钠肽(BNP)序列:上游引物5′-TAGCCAGTCTCCAGAGCAATTC-3′,下游引物5′-GGTCTATCTTGTGCCCAAAGC-3′,片段长度218 bp;Ⅰ型胶原蛋白(CollagenⅠ)序列:上游引物5′-CTGACTGGAAGAGCGGAGAG-3′,下游引物5′-CGGCTGAGTAGGGAACACAC-3′,片段长度116 bp;GAPDH序列:上游引物5′-TGAAGGGTGGAGCCAAAAG-3′,下游引物5′-AGTCTTCTGGGTGGCAGTGAT-3′,片段长度227 bp。每个样本均作3个平行样本,使用SYBR® Premix Ex TaqTM试剂盒(日本TaKaRa公司)配制反应体系(10 μL)为:2×qPCR Mix 5.0 μL,上下游引物(2.5 μmol/L)各0.5 μL,模板1.0 μL,ddH2O 2.8 μL,Rox 0.2 μL。StepOneTM Real-Time PCR仪(美国Life Technologies公司)上完成实时荧光定量PCR实验,反应条件为:95℃预变性1 min;95℃变性15 s,58℃退火20 s,72℃延伸20 s,循环40次;72℃终延伸5 min。以GAPDH为内参照,记录每次测定的Ct值,目的基因的相对表达量以2-△△ Ct法计算并表示。
1.6 统计学分析采用SPSS 17.0统计软件对数据进行统计学分析。计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。计数资料采用百分率(%)表示,组间率的比较采用卡方检验。相关分析采用Pearson相关分析。P < 0.05为差异有统计学意义。
2 结果 2.1 各组小鼠死亡情况随着ISO注射时间的延长,各组小鼠的死亡率明显增加,0、7、14、21 d 4个时间点死亡率分别为0(0/8)、20%(2/10)、44%(7/16)、60%(12/20),4个组比较差异有统计学意义(χ2=82.8,P < 0.001)。剔除死亡小鼠,0 d、7 d、14 d、21 d 4个时间组最终纳入实验动物数分别为8、8、9、8。
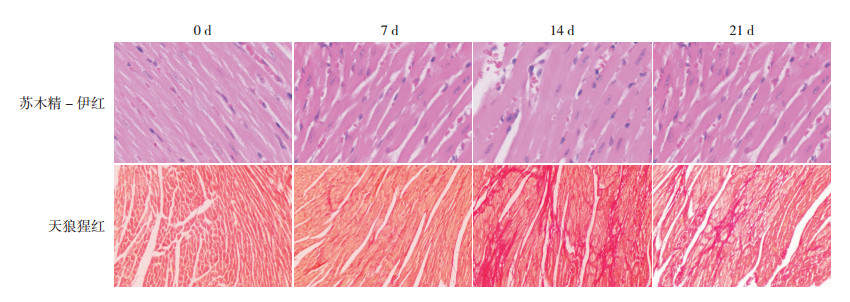
2.2 心肌肥厚指标变化左心室心肌HE染色显示,与0 d组比较,7、14、21 d组心肌纤维明显增粗,以14 d组最明显。在注射ISO 0、7、14 d后,小鼠左心室肥厚指标(HW/TL、心肌纤维直径、dLVPW)逐渐增高(P < 0.05)。与14 d时比较,注射ISO 21 d时,HW/TL及dLVPW差异无统计学意义(P > 0.05),心肌纤维直径减小(P < 0.05)至7 d时水平(P > 0.05)。见表 1,图 1。
| 表 1 各组小鼠心肌肥厚指标比较 (x±s) |
|
|
|
图 1 各组小鼠心脏病理改变 苏木精-伊红染色(×400)显示:与0 d组比较,7、14、21 d组心肌纤维明显增粗,以14 d组最明显;天狼猩红染色(×100)显示:0 d组和7 d组未见明显胶原沉积,14 d组和21 d组心肌间质胶原沉积显著,胶原沉积阳性表达呈猩红色。 |
左心室心肌天狼猩红染色显示:14 d组和21 d组心肌间质胶原沉积显著,0 d组和7 d组未见明显胶原沉积。注射ISO 0、7、14、21 d后,小鼠心脏胶原面积和CollagenⅠ mRNA、ASK1 mRNA、BNP mRNA表达量逐渐增高,21 d时达高峰(P < 0.01),见表 2,图 1。
| 表 2 各组小鼠心室纤维化及相关指标比较 (x±s) |
|
|
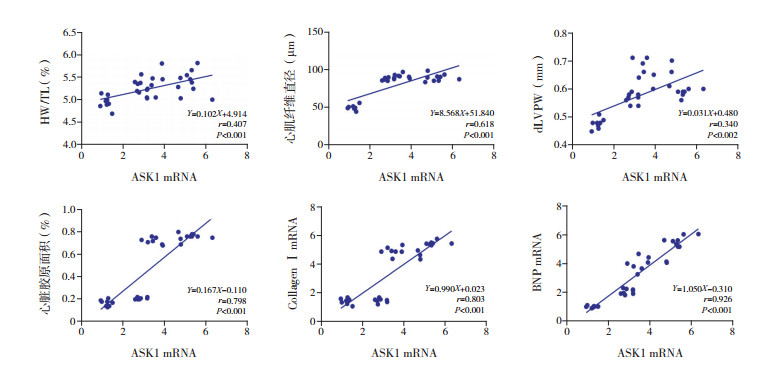
相关性分析显示:ASK1 mRNA表达量与HW/TL、心肌纤维直径、dLVPW相关性弱(分别r=0.407、0.618、0.340,P < 0.001)。ASK1 mRNA表达量与心脏胶原面积、CollagenⅠ mRNA、BNP mRNA表达量均呈正相关(分别r=0.798、0.803、0.926,P < 0.001),见图 2。
|
图 2 ASK1 mRNA与各指标的相关分析图 |
心室重塑是指心室几何、质量、体积和功能的变化,以适应心肌损伤或负荷的变化,病理性心室重塑程度是预测心脏病预后的有力证据[8]。改善各种原因导致的左心室病理性重构是防治该类患者预后的关键所在。因此,阐明导致左心室重构的细胞和分子机制具有重要意义。研究表明心室重塑的机制与心肌凋亡密切相关[9-10],但是在调节心室重塑过程中心肌凋亡的分子机制仍然有待进一步探索。
儿茶酚胺长期刺激可导致左心室肥厚和心肌胶原沉积等典型的左心室重塑改变[11],本研究利用ISO模拟内源性儿茶酚胺建立了FVB/N小鼠心脏重塑模型,结果显示FVB/N小鼠腹腔注射ISO后第7天即出现心肌肥厚,14 d心肌肥厚指标达到高峰,21 d心肌肥厚并没有进一步加重,反而程度有所减轻;同时对小鼠心室纤维化指标进行检测,结果显示左心室胶原面积和CollagenⅠ mRNA在4个时间点逐渐上升,且其上升趋势不同于心肌肥厚指标,心室纤维化指标在ISO注射后7 d增高不明显,14 d时开始明显增高,21 d时达到高峰;小鼠在死亡率方面亦有显著变化,7 d时即出现小鼠死亡,死亡率为20%(2/10),14 d时死亡率为44%(7/16),21 d时死亡率最高(60%,12/20)。本研究结果提示FVB/N小鼠在注射ISO后逐渐出现了心肌肥厚和心室纤维化,随着心脏重塑的进展,小鼠的死亡率明显增加。Mohamed等[12]通过小鼠动物模型研究了长期容量负荷后心室从适应逐渐过渡到心力衰竭,在此过程中心室重塑逐渐加重,与心肌细胞凋亡的程度相平行,由于心肌细胞丢失和心肌细胞功能障碍导致肌节僵硬度增加。Patel等[13]发现压力超负荷引起的心脏重塑,出现心脏肥大、功能障碍和纤维化的程度加剧,而过表达具有心脏特异性基因后,转基因小鼠的心脏重塑明显缓解。以上两项研究在压力负荷和容量负荷条件下均出现了本研究类似的心脏重塑表现,本研究显示在ISO注射21 d时心肌肥厚程度较前1周有缓解,而心室纤维化又明显进展,因此推测在心肌肥厚到一定程度后出现了心肌细胞的凋亡增加和心肌间质纤维化逐渐加重,这种推理能较好的解析心肌纤维直径在心脏重塑加重后反而出现缩小这一矛盾的现象,小鼠的死亡率增高也证明了这一点,同时也与心脏重塑相关研究吻合[10, 13-15]。
本实验在ISO注射0、7、14、21 d 4个时间点检测BNP mRNA、ASK1 mRNA,结果显示两个指标均逐渐增高,21 d时表达量最高,相关性分析显示ASK1 mRNA与BNP mRNA、心脏胶原面积和心肌CollagenⅠ mRNA表达水平均呈正相关,而与HW/TL、心肌纤维直径、dLVPW相关性弱。本实验结果表明ASK1参与心室重塑过程,ASK1表达水平在心室纤维化阶段明显高于心肌肥厚阶段,随着心室重塑的进展BNP也逐渐上升,这与临床上高血压、心衰、心瓣膜病、心肌梗塞导致的心肌重塑的特点相吻合。有研究认为ASK1为参与心力衰竭发病机制的一种激酶,并证明利尿钠肽前体是ASK1的底物,ASK1和利尿钠肽前体都与病理性心脏肥大相关[16]。本研究中ASK1和BNP在左心室重塑过程中均明显增高与上述研究观点吻合。Huang等[2]研究发现扩张型心肌病患者心脏中ASK1磷酸酶活性增加,并在扩张型心肌病小鼠模型中证实ASK1表达水平增加和心肌细胞凋亡增加有关,长期使用高选择性ASK1抑制剂改善了心脏表型,显著减少氧化应激、凋亡、纤维化和心力衰竭,改善左心室重构,提出抑制ASK1是治疗扩张型心肌病和心力衰竭的一种有希望的治疗策略。最近,Budas等[5]研究也发现口服ASK1抑制剂能有效降低肺动脉压,减少肺动脉高压小鼠模型的右心室肥大,并证实ASK1抑制剂的治疗效果与ASK1磷酸化、肺动脉肌肉组织和纤维化基因表达减少有关,由于此抑制剂能直接减少心肌纤维化和改善心功能,结果令人振奋,目前已进入Ⅱ期临床研究。有研究表明抑制ASK1还可以减少大鼠和小鼠缺血再灌注模型的心肌梗死面积[17-19]。ASK1抑制剂改善心血管重构的细胞机制可能与其能降低成纤维细胞活性,抑制成纤维细胞增殖分化和成纤维肌细胞的活化有关,研究还证实ASK1通过调控p38-MAP3K信号通路改善重塑[5]。也有研究表明ASK1通过调控JNK/p38信号通路[20]、NADPH氧化酶介导的氧化应激和心肌肾素-血管紧张素系统[21]改善心室重塑。
综上所述,与国内外研究不同,本实验利用ISO模拟内源性儿茶酚胺诱导FVB/N小鼠左心室重塑,结果显示ASK1在小鼠心室纤维化阶段较心肌肥厚阶段增高更显著,其表达水平在某种程度上反映了心肌凋亡的程度,表明心肌ASK1与左心室重塑程度密切相关,ASK1可能是调控心脏重塑的关键激酶之一,为进一步探索心脏重塑的分子机制及治疗靶点提供了依据。
| [1] |
Ichijo H, Nishida E, Irie K, et al. Induction of apoptosis by ASK1, a mammalian MAPKKK that activates SAPK/JNK and p38 signaling pathways[J]. Science, 1997, 275(5296): 90-94. DOI:10.1126/science.275.5296.90 (  0) 0) |
| [2] |
Huang Q, Zhou HJ, Zhang H, et al. Thioredoxin-2 inhibits mitochondrial reactive oxygen species generation and apoptosis stress kinase-1 activity to maintain cardiac function[J]. Circulation, 2015, 131(12): 1082-1097. DOI:10.1161/CIRCULATIONAHA.114.012725 (  0) 0) |
| [3] |
Boucherat O, Provencher S, Bonnet S. Therapeutic value of ASK1 inhibition in pulmonary arterial hypertension[J]. Am J Respir Crit Care Med, 2018, 197(3): 284-286. DOI:10.1164/rccm.201708-1767ED (  0) 0) |
| [4] |
刘丽萍, 何学华, 袁勇华, 等. 凋亡信号调节激酶1在扩张型心肌病大鼠中的表达及其与左心室射血分数的相关性[J]. 中华实用儿科临床杂志, 2013, 28(1): 15-18. DOI:10.3760/cma.j.issn.2095-428X.2013.01.006 (  0) 0) |
| [5] |
Budas GR, Boehm M, Kojonazarov B, et al. ASK1 inhibition halts disease progression in preclinical models of pulmonary arterial hypertension[J]. Am J Respir Crit Care Med, 2018, 197(3): 373-385. DOI:10.1164/rccm.201703-0502OC (  0) 0) |
| [6] |
Hartupee J, Mann DL. Neurohormonal activation in heart failure with reduced ejection fraction[J]. Nat Rev Cardiol, 2017, 14(1): 30-38. DOI:10.1038/nrcardio.2016.163 (  0) 0) |
| [7] |
袁勇华, 郑雪明, 何学华, 等. 腹腔注射异丙肾上腺素诱导FVB/N小鼠心脏重塑模型[J]. 中国当代儿科杂志, 2018, 20(6): 508-513. (  0) 0) |
| [8] |
Yamaguchi O, Higuchi Y, Hirotani S, et al. Targeted deletion of apoptosis signal-regulating kinase 1 attenuates left ventricular remodeling[J]. Proc Natl Acad Sci U S A, 2003, 100(26): 15883-15888. DOI:10.1073/pnas.2136717100 (  0) 0) |
| [9] |
Li L, Chen Y, Doan J, et al. Transforming growth factor β-activated kinase 1 signaling pathway critically regulates myocardial survival and remodeling[J]. Circulation, 2014, 130(24): 2162-2172. DOI:10.1161/CIRCULATIONAHA.114.011195 (  0) 0) |
| [10] |
Guo X, Yin H, Li L, et al. Cardioprotective role of tumor necrosis factor receptor-associated factor 2 by suppressing apoptosis and necroptosis[J]. Circulation, 2017, 136(8): 729-742. DOI:10.1161/CIRCULATIONAHA.116.026240 (  0) 0) |
| [11] |
Teerlink JR, Pfeffer JM, Pfeffer MA. Progressive ventricular remodeling in response to diffuse isoproterenol-induced myocardial necrosis in rats[J]. Circ Res, 1994, 75(1): 105-113. DOI:10.1161/01.RES.75.1.105 (  0) 0) |
| [12] |
Mohamed BA, Schnelle M, Khadjeh S, et al. Molecular and structural transition mechanisms in long-term volume overload[J]. Eur J Heart Fail, 2016, 18(4): 362-371. DOI:10.1002/ejhf.465 (  0) 0) |
| [13] |
Patel VB, McLean BA, Chen X, et al. Regulators of G-protein signaling 10 and heart failure:the importance of negative regulators of heart disease[J]. Hypertension, 2016, 67(1): 38-40. DOI:10.1161/HYPERTENSIONAHA.115.06109 (  0) 0) |
| [14] |
Sharp TE, Schena GJ, Hobby AR, et al. Cortical bone stem cell therapy preserves cardiac structure and function after myocardial infarction[J]. Circ Res, 2017, 121(11): 1263-1278. DOI:10.1161/CIRCRESAHA.117.311174 (  0) 0) |
| [15] |
Hou L, Guo J, Xu F, et al. Cardiomyocyte dimethylarginine dimethylaminohydrolase1 attenuates left-ventricular remodeling after acute myocardial infarction:involvement in oxidative stress and apoptosis[J]. Basic Res Cardiol, 2018, 113(4): 28. DOI:10.1007/s00395-018-0685-y (  0) 0) |
| [16] |
Shan X, Wang H, Margulies KB. Apoptosis signal-regulating kinase 1 attenuates atrial natriuretic peptide secretion[J]. Biochemistry, 2008, 47(38): 10041-10048. DOI:10.1021/bi800972z (  0) 0) |
| [17] |
Toldo S, Breckenridge DG, Mezzaroma E, et al. Inhibition of apoptosis signal-regulating kinase 1 reduces myocardial ischemia-reperfusion injury in the mouse[J]. J Am Heart Assoc, 2012, 1(5): e002360. (  0) 0) |
| [18] |
Gerczuk PZ, Breckenridge DG, Liles JT, et al. An apoptosis signal-regulating kinase 1 inhibitor reduces cardiomyocyte apoptosis and infarct size in a rat ischemia-reperfusion model[J]. J Cardiovasc Pharmacol, 2012, 60(3): 276-282. DOI:10.1097/FJC.0b013e31825ea0fa (  0) 0) |
| [19] |
Lanier M, Pickens J, Bigi SV, et al. Structure-based design of ASK1 inhibitors as potential agents for heart failure[J]. ACS Med Chem Lett, 2017, 8(3): 316-320. DOI:10.1021/acsmedchemlett.6b00481 (  0) 0) |
| [20] |
Wu Y, Qian Z, Fu S, et al. Icarisidell improves left ventricular remodeling in spontaneously hypertensive rats by inhibiting the ASK1-JNK/p38 signaling pathway[J]. Eur J Pharmacol, 2018, 819: 68-79. DOI:10.1016/j.ejphar.2017.11.035 (  0) 0) |
| [21] |
Nakamura T, Kataoka K, Fukuda M, et al. Critical role of apoptosis signal-regulating kinase 1 in aldosterone/salt-induced cardiac inflammation and fibrosis[J]. Hypertension, 2009, 54(3): 544-551. DOI:10.1161/HYPERTENSIONAHA.109.135392 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


