2. 沧州市中心医院儿内科, 河北 沧州 061000
全身型幼年特发性关节炎(systemic juvenile idiopathic arthritis, sJIA)是幼年特发性关节炎(JIA)中发病率较高的类型,约占JIA发病率的10%,其致死率及致残率很高[1]。根据国际风湿病学会联盟(ILAR)划分的7种JIA,sJIA是最特殊的一组罕见[2]、多基因、异质性疾病[3]。sJIA的发病机制目前不明确,近年来,一些学者认为sJIA更倾向于自身炎症性疾病[4],而非自身免疫性疾病。自身炎症性疾病是针对自身组织、器官的免疫性炎性疾病,固有免疫细胞异常反应是自身组织损伤的直接原因;自身免疫性疾病以识别自身或非己的适应性免疫耐受机制破坏为特征,适应性免疫细胞异常反应导致自身组织炎性损害。细胞自噬在参与自身炎症性疾病中的作用已成为近年研究的热点。自噬是一把双刃剑,它依赖于细胞环境和功能状态决定增加细胞活力或诱导细胞凋亡[5]。当细胞自噬异常时,可导致自身炎症性疾病、自身免疫性疾病的发生发展。并且某些自噬相关基因与机体免疫功能紊乱亦存在相关性。有研究表明TNF-α介导了类风湿关节炎患者破骨细胞自噬相关基因的表达并活化细胞自噬,自噬的增加导致了类风湿关节炎患者成纤维细胞样滑膜细胞中瓜氨酸化蛋白的产生,滑膜细胞中微管相关蛋白轻链3-Ⅱ(microtubule-associated protein 1 light chain 3-Ⅱ, LC3-Ⅱ)与抗环瓜氨酸蛋白抗体水平呈正相关[6]。但尚无细胞自噬参与sJIA的直接证据。LC3是与自噬相关基因8(Atg8)同源,在细胞内有LC3-Ⅰ和LC3-Ⅱ两种存在形式。LC3-Ⅱ被作为检测自噬的标记物,而LC3-Ⅱ和LC3-Ⅰ的水平可以反映自噬体的数量。髓样细胞分化因子88(myeloid differentiation factor 88, MyD88)是Toll样受体信号通路中重要的衔接分子,是信号向下游转导的关键蛋白, MyD88依赖的Toll样受体信号通路参与自噬的发生[7]。T细胞受体信号抑制因子1(suppressor of T-cell receptor signaling 1, STS-1)是通过基因芯片技术在SLE患者外周血CD19+ B细胞中筛选出的一个显著高表达的基因,并且参与自噬的发生。由于一个基因突变或异常可能导致多种免疫系统疾病的发生,在sJIA患儿机体中STS-1可能亦表达异常,进而诱导自噬的过度表达。本研究通过探讨LC3-Ⅱ、MyD88及STS-1在sJIA患儿外周血淋巴细胞中的表达及对三者进行相关性分析,进一步探讨自噬在sJIA发生发展中的作用,为预防sJIA的发病提供新策略和新靶点,进而为未来临床靶向治疗提供依据及新思路。
1 资料与方法 1.1 研究对象前瞻性收集自2015年5月至2017年1月在河北医科大学第二医院就诊的26例sJIA儿童作为研究对象,其中男孩12例,女孩14例;平均年龄7±3岁(范围:2~13岁)。
纳入标准:(1)符合sJIA的诊断标准[8]:发病年龄在16岁前,关节炎≥1个关节,发热至少2周(弛张高热),至少持续3 d,伴有以下≥1项症状:①间断出现的(非固定性的)红斑样皮疹;②全身淋巴结肿大;③肝和/或脾增大;④浆膜炎。(2)初治病例,未接受激素、免疫抑制剂等治疗。
排除标准[8]:除外银屑病或患儿/一级亲属有银屑病史;大于6岁、HLA-B27阳性的男性关节炎患儿;患强直性脊柱炎、附着点炎症相关的关节炎、伴炎症性肠病的骶髂关节炎、瑞特综合征或急性前葡萄膜炎,或一级亲属中有上述疾病之一;至少两次类风湿因子IgM阳性,两次间隔至少3个月。并除外感染、血液/恶性肿瘤、外科等疾病。
另外纳入26例该院儿科门诊进行健康体检的儿童作为对照组。其中男孩15例,女孩11例;平均年龄8±4岁(范围:2~14岁)。
本研究获得了河北医科大学第二医院伦理委员会的批准(批准号:2015221),并获研究对象监护人知情同意。
1.2 研究方法收集sJIA患儿与健康儿童抗凝静脉血5 mL。采用人外周血淋巴细胞分离液分离提取淋巴细胞;采用Western blot检测淋巴细胞MyD88及STS-1、LC3-Ⅱ的表达;免疫荧光法检测LC3-Ⅱ的表达。
标本收集及处理方法:晨起空腹采血时,抽取5 mL静脉血置于抗凝管中,3 h内采用人外周血淋巴细胞分离法分离淋巴细胞, 按照人外周血淋巴细胞分离液说明书(天津市灏洋生物制品科技有限责任公司)进行操作。将获得的淋巴细胞培养在含有10%胎牛血清(FBS)的RPMI 1640培养基中,在恒温37℃的CO2培养箱中过夜。次日将培养基吸入15 mL离心管中离心(1 200 r/min,5 min),弃上清液后加入300 μL细胞裂解液,于4℃冰箱或者冰上放置30 min,然后吸入EP管内离心(4℃,12 000 r/min,20 min)提取上清液即为细胞蛋白,放置于-80℃冰箱保存备用。或按100 μL裂解液加20 μL的6X的loading buffer的比例,向蛋白样品液中添加loading buffer,对蛋白样品进行高温变性(95℃,5 min)后放置于-20℃保存备用。
1.3 统计学分析应用SPSS 21.0统计软件进行统计学处理与分析。计量资料采用均数±标准差表示,两样本间的比较应用成组t检验;相关性分析采用Pearson相关分析。P < 0.05为差异有统计学意义。
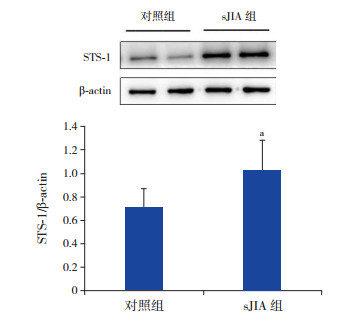
2 结果 2.1 sJIA组与对照组外周血淋巴细胞STS-1蛋白表达水平的比较与对照组比较,sJIA组外周血淋巴细胞STS-1表达增高(1.03±0.28 vs 0.71±0.17),差异有统计学意义(t=-5.166,P < 0.05),见图 1。
|
图 1 sJIA组与对照组外周血淋巴细胞STS-1蛋白表达水平 上图为电泳条带图;下图为统计图(n=26)。a示与对照组比较,P < 0.05。 |
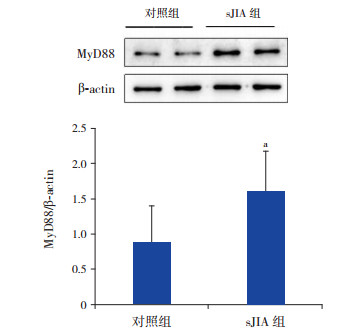
与对照组比较,sJIA组外周血淋巴细胞MyD88表达增高(1.61±0.62 vs 0.88±0.51),差异有统计学意义(t=-4.623,P < 0.05),见图 2。
|
图 2 sJIA组与对照组外周血淋巴细胞MyD88蛋白表达水平 上图为电泳条带图;下图为统计图(n=26)。a示与对照组比较,P < 0.05。 |
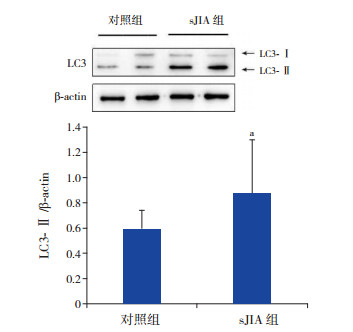
与对照组比较,sJIA组外周血淋巴细胞LC3-Ⅱ的表达增高(0.88±0.44 vs 0.60±0.18),差异有统计学意义(t=-3.067,P=0.004),见图 3。
|
图 3 sJIA组与对照组外周血淋巴细胞LC3-Ⅱ的蛋白表达 上图为电泳条带图;下图为统计图(n=26)。a示与对照组比较,P < 0.05。 |
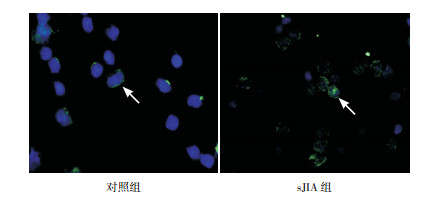
与对照组比较,LC3-Ⅱ在sJIA组淋巴细胞胞浆中的表达水平增高,与Western blot检测结果一致,见图 4。
|
图 4 免疫荧光染色观察LC3-Ⅱ在sJIA组与对照组外周血淋巴细胞胞浆中的表达(×400) LC3-Ⅱ在sJIA组淋巴细胞胞浆中的表达水平高于对照组。图中呈现绿色亮点的为LC3-Ⅱ表达(箭头所示)。 |
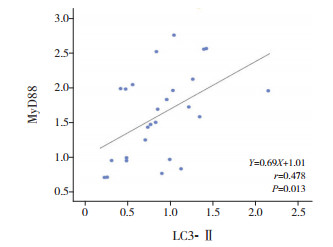
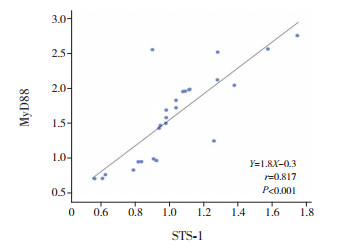
Pearson相关分析显示,sJIA患儿外周血淋巴细胞中LC3-Ⅱ表达与MyD88表达呈正相关(r=0.478,P=0.013),见图 5;sJIA患儿外周血淋巴细胞中STS-1表达与MyD88表达亦呈正相关(r=0.817,P < 0.001),见图 6;sJIA患儿外周血淋巴细胞中LC3-Ⅱ表达与STS-1表达无统计学意义(r=0.336,P=0.093)。
|
图 5 LC3-Ⅱ与MyD88相关分析图 |
|
图 6 STS-1与MyD88相关分析图 |
在传统观念中,sJIA归于自身免疫性疾病,但近年来研究发现sJIA为自身炎症性疾病范畴,因sJIA病理环节中炎性细胞因子IL-6、IL-18、IL-1、TNF-α等在sJIA发病中具有明显作用,而无自身抗体参与及组织相容性抗原相关性。因此重新认识sJIA作为自身炎症性疾病特征,可以更好地帮助临床制定靶向性更明确的治疗方案。而越来越多的实验证据表明,很多自身免疫疾病及自身炎症性疾病的发生发展与自噬关系密切[9-10]。
LC3与哺乳动物细胞中酵母Atg8基因同源,可以靶向定位在自噬体膜上,参与自噬的形成,LC3是自噬的标记物,通过检测LC3的表达反映自噬的发生情况。LC3-Ⅱ被作为检测自噬的标记物,而LC3-Ⅱ和LC3-Ⅰ水平可以反映自噬体的数量。LC3-Ⅱ蛋白结合并始终位于胞内自噬体膜上,其含量与自噬泡数量成正比[11],所以检测LC3-Ⅱ的表达可以得知细胞自噬水平的高低。有研究表明,自噬参与成人风湿性关节炎的发病[6]。在TNF-α的作用下患者关节处的破骨细胞内Atg7和Beclin 1的表达升高,自噬的活性随之增强。自噬活动增强会促进患者关节处的单核细胞转变为破骨细胞,从而造成关节处骨质被吸收。另有研究认为LC3在成人类风湿关节炎中的表达降低[12]。本研究通过检测sJIA患儿外周血淋巴细胞自噬标记物LC3的表达反映sJIA自噬的表达水平。结果表明,与健康儿童比较,sJIA患儿外周血淋巴细胞LC3表达显著增高,这与成人类风湿关节炎中LC3表达降低的结论不符。分析可能原因为:与成人相比,儿童发病过程有其特殊的发病机制,sJIA为自身炎症性疾病,而成人类风湿关节炎为自身免疫性疾病。自身炎症性疾病是针对自身组织、器官的免疫性炎性疾病,固有免疫细胞异常反应是自身组织损伤的直接原因;自身免疫性疾病以识别自身/非己的适应性免疫耐受机制破坏为特征,适应性免疫细胞异常反应导致自身组织炎性损害。病变基因仅涉及固有免疫细胞异常反应,其所致疾病称为纯粹自身炎症性疾病;如病变基因仅涉及适应性免疫细胞异常反应,其所致疾病称为纯粹自身免疫性疾病;如果兼具自身炎症性疾病-自身免疫性疾病双重病理特性,即为自身免疫性中间型疾病。有目的地寻找患者自身炎症性和自身免疫性疾病特征,将有助于更准确地把握患者病情,合理、精细地制定靶向性明确的治疗方案[13]。自噬在sJIA发生发展中的意义及作用有待进一步研究。本研究希望以LC3为突破口,深入揭示sJIA的发病机制,为临床提供有效治疗方案。
sJIA是在感染、易感基因等的相互作用下,引起固有免疫系统异常,并使包括中性粒细胞、单核细胞、巨噬细胞在内的吞噬细胞活化失控,其分泌大量的炎性因子(IL-1、IL-6、IL-18等)[14]。MyD88分子是Toll样受体信号通路中重要的衔接分子,是信号向下游转导的关键蛋白,其作为重要的转导蛋白[15],在信号通路和调控细胞因子分泌从而影响免疫应答中都发挥着关键作用。近年来,很多学者通过对MyD88及其依赖的信号通路的研究,加深了人们对免疫应答的认识。MyD88信号可以刺激产生IL-6,IL-6再通过JNK-STAT途径激活转录活化因子3(signal transducer and activator of transcription 3, STAT3)引发免疫抑制。IL-6作为促炎症细胞因子,通过激活淋巴细胞而加速炎症反应蛋白的合成。Loiarro等[16]证实MyD88信号途径可以调控IL-6的分泌。此外MyD88基因敲除可以促进小鼠肾脏移植术后肾功能恢复和诱导免疫耐受,也证实MyD88在免疫应答中的作用。MyD88是Toll样受体信号通路中与自噬相关的关键蛋白,生理性自噬可通过降解MyD88调节炎症反应过度,从而抑制炎性因子如IL-6的产生。当自噬表达异常时,MyD88能及时被降解,最终使炎症因子产生增多。S100蛋白为小分子量的钙结合蛋白,是JIA预后不良的生物学标志物[17],其受体主要为Toll样受体等,可诱导产生IL-1、IL-6及粘附因子等,具有参与炎症反应、调控细胞凋亡、促进中性粒细胞脱颗粒及招募巨噬细胞等作用[18]。目前关于MyD88在sJIA疾病自噬发生中的作用的研究较少。本研究中MyD88在sJIA患儿外周血的表达水平升高,与健康儿童比较差异具有统计学意义,提示sJIA患儿体内Toll样受体信号通路可能被激活。此外,自噬标志性蛋白LC3在sJIA中异常表达,其在sJIA发生发展中的意义及作用亦有待进一步研究。本研究显示,sJIA患儿外周血淋巴细胞中LC3-Ⅱ与MyD88积分光密度值呈正相关(r=0.478,P=0.013),提示Toll样受体信号通路参与自噬的发生。
有研究表明,系统性红斑狼疮患者中B细胞的增殖及分布存在异常,这种异常是一种复杂且严密的过程[19]。STS-1是通过基因芯片技术在系统性红斑狼疮患者外周血CD19+ B细胞中筛选出的一个显著高表达的基因,能够抑制Casitas B淋巴瘤细胞系原癌基因(c-cbl)的活性,对酪氨酸蛋白磷酸酶活性的调节有重要作用,并且c-cbl在许多信号通路转导中发挥负调控作用[20]。STS-1也可以使一些酪氨酸磷酸化蛋白去磷酸化。有研究报道,STS-1能够通过结合c-cbl促进Tyk2的磷酸化,进而促进IFN-α诱导的JAK1-STAT1的活化及B细胞的自噬;而且STS-1能够通过去磷酸化Syk抑制IFN-α诱导的PI3K-mTOR通路活化[21]。本研究显示,sJIA患儿外周血淋巴细胞STS-1的表达显著高于对照组, 证实STS-1在sJIA中高表达,并且自噬的标志性蛋白LC3亦高表达。但LC3-Ⅱ与STS-1的相关性分析无统计学意义,推测STS-1可能亦为sJIA的致病基因,并通过激活或抑制某些信号通路诱导自噬的发生。相关性分析示STS-1与MyD88相关,提示STS-1可能通过Toll样受体信号通路诱导自噬。
自噬在炎症反应中具有双向调节作用,一方面自噬可以通过降解相关炎性蛋白,降低炎性因子水平,发挥抑制炎性反应作用;另一方面,自噬可以激活炎症体,分泌大量炎性因子,加快炎症反应作用。因此适度的自噬可以维持细胞内环境稳态,而过高或过低均会危害机体。本研究结果表明,sJIA患儿机体自噬过度表达,但异常的自噬表达参与sJIA发病的具体机制目前尚不明确,有待进一步探索。本研究显示,sJIA患儿外周血淋巴细胞中STS-1表达与MyD88表达呈正相关(r=0.817,P < 0.001),LC3-Ⅱ表达与MyD88表达亦有一定相关性,且有文献报道Toll样受体信号通路刺激STS-1后激活或者抑制某些信号通路从而诱导自噬的过表达[21],提示sJIA自噬过度表达可能亦与STS-1激活或抑制某些信号通路有关,亦有待进一步研究。阐明这些机制有助于在细胞和基因水平上深入认识自身炎症性疾病的发病机制,为sJIA的预防及治疗提供依据。
综上,本研究初步证明,sJIA患儿外周血淋巴细胞中存在病理性自噬的发生,MyD88表达与LC3-Ⅱ表达呈正相关,提示在sJIA中Toll样受体信号通路可能参与了自噬的发生。但二者关联系数较低,考虑可能与样本量小有关。另外,本研究表明,STS-1在sJIA患儿与正常儿童间存在差异性表达,推测STS-1通过激活某些信号通路诱导sJIA自噬的发生。后续我们将扩大样本量,并通过透射电子显微镜观察自噬现象,进一步研究sJIA与非sJIA以及sJIA疾病不同时期自噬的表达情况,以期为临床治疗sJIA提供新的思路。
| [1] |
Kahn PJ. Juvenile idiopathic arthritis-what the clinician needs to know[J]. Bull Hosp Jt Dis, 2013, 71(3): 194-199. (  0) 0) |
| [2] |
Dewoolkar M, Cimaz R, Chickermane PR, et al. Course, outcome and complications in children with systemic onset juvenile idiopathic arthritis[J]. Indian J Pediatr, 2017, 84(4): 294-298. DOI:10.1007/s12098-017-2293-5 (  0) 0) |
| [3] |
杨圣海. 细胞免疫在幼年特发性关节炎致病机制中的研究进展[J]. 中国社区医师, 2013, 15(2): 7-8. DOI:10.3969/j.issn.1007-614x.2013.02.003 (  0) 0) |
| [4] |
Aksentijevich I, McDermott MF. Lessons from characterization and treatment of the auto-inflammatory syndromes[J]. Curr Opin Rheumatol, 2017, 29(2): 187-194. DOI:10.1097/BOR.0000000000000362 (  0) 0) |
| [5] |
Zhou XT, Pu ZJ, Liu LX, et al. Inhibition of autophagy enhances adenosine-induced apoptosis in human hepatoblastoma HepG2 cells[J]. Oncol Rep, 2019, 41(2): 829-838. (  0) 0) |
| [6] |
韩旭, 汪威言, 张跃, 等. 自噬在风湿病中的研究进展[J]. 中华医学杂志, 2018, 98(13): 1030-1032. DOI:10.3760/cma.j.issn.0376-2491.2018.13.016 (  0) 0) |
| [7] |
杨其彬, 周京国. 自噬与Toll样受体NOD样受体信号通路相互调控在痛风炎症反应中的作用[J]. 中华风湿病学杂志, 2015, 19(5): 349-351. DOI:10.3760/cma.j.issn.1007-7480.2015.05.017 (  0) 0) |
| [8] |
全国儿童风湿病协作组. 儿童风湿病诊断及治疗专家共识(一)[J]. 临床儿科杂志, 2010, 28(10): 984-991. DOI:10.3969/j.issn.1000-3606.2010.10.023 (  0) 0) |
| [9] |
Weindel CG, Richey LJ, Bolland S, et al. B cell autophagy mediates TLR7-dependent autoimmunity and inflammation[J]. Autophagy, 2015, 11(7): 1010-1024. DOI:10.1080/15548627.2015.1052206 (  0) 0) |
| [10] |
Aoyagi T, Kusakari Y, Xiao CY, et al. Cardiac mTOR protects the heart against ischemia-reperfusion injury[J]. Am J Physiol Am J Physiol Heart Circ Physiol, 2012, 303(1): H75-H85. DOI:10.1152/ajpheart.00241.2012 (  0) 0) |
| [11] |
杨淑丽, 陈卫昌, 孙楹, 等. 自噬相关基因LC3和Beclin1在大鼠急性坏死性胰腺炎中的表达和意义[J]. 世界华人消化杂志, 2011, 19(12): 1231-1236. (  0) 0) |
| [12] |
许珂, 蔡永松, 鲁超, 等. 甲氨蝶呤通过诱导自噬促进类风湿关节炎滑膜成纤维细胞凋亡机制的研究[J]. 中华风湿病学杂志, 2019, 23(2): 106-109. DOI:10.3760/cma.j.issn.1007-7480.2019.02.007 (  0) 0) |
| [13] |
李永柏, 梁芳芳. 自身炎症性疾病与自身免疫性疾病[J]. 中华实用儿科临床杂志, 2013, 28(9): 641-643. DOI:10.3760/cma.j.issn.2095-428X.2013.09.001 (  0) 0) |
| [14] |
Yokota S, Kikuchi M, Nozawa T, et al. Pathogenesis of systemic inflammatory diseases in childhood:"Lessons from clinical trials of anti-cytokine monoclonal antibodies for Kawasaki disease, systemic onset juvenile idiopathic arthritis, and cryopyrinassociated periodic fever syndrome"[J]. Mod Rheumatol, 2015, 25(1): 1-10. DOI:10.3109/14397595.2014.902747 (  0) 0) |
| [15] |
Avbelj M, Horvat S, Jerala R. The role of intermediary domain of MyD88 in cell activation and therapeutic inhibition of TLRs[J]. J Immunol, 2011, 187(5): 2394-2404. DOI:10.4049/jimmunol.1100515 (  0) 0) |
| [16] |
Loiarro M, Capolunghi F, Fantò N, et al. Pivotal advance:inhibition of MyD88 dimerization and recruitment of IRAK1 and IRAK4 by a novel peptidomimetic compound[J]. J Leukoc Biol, 2007, 82(4): 801-810. DOI:10.1189/jlb.1206746 (  0) 0) |
| [17] |
陈姣姣, 唐雪梅. 预测幼年特发性关节炎预后不良的生物学标志物研究进展[J]. 国际免疫学杂志, 2019, 42(2): 224-228. (  0) 0) |
| [18] |
Holzinger D, Foell D, Kessel C. The role of S100 proteins in the pathogenesis and monitoring of autoinflammatory diseases[J]. Mol Cell Pediatr, 2018, 5(1): 7. (  0) 0) |
| [19] |
Liu M, Guo Q, Wu C, et al. Type I interferons promote the survival and proinflammatory properties of transitional B cells in systemic lupus erythematosus patients[J]. Cell Mol Immunol, 2019, 16(4): 367-379. DOI:10.1038/s41423-018-0010-6 (  0) 0) |
| [20] |
Lee ST, Feng M, Wei Y, et al. Protein tyrosine phosphatase UBASH3B is overexpressed in triple-negative breast cancer and promotes invasion and metastasis[J]. Proc Natl Acad Sci U S A, 2013, 110(27): 11121-11126. DOI:10.1073/pnas.1300873110 (  0) 0) |
| [21] |
Dong G, You M, Fan H, et al. STS-1 promotes IFN-α induced autophagy by activating the JAK1-STAT1 signaling pathway in B cells[J]. Eur J Immunol, 2015, 45(8): 2377-2388. DOI:10.1002/eji.201445349 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


