2. 青岛大学附属医院医学遗传科和产前诊断中心, 山东 青岛 266003;
3. 济南市妇幼保健医院新生儿疾病筛查中心, 山东 济南 250001
先天性甲状腺功能减低症(congenital hypothyroidism, CH)是全球最常见的可预防的呆小症原因之一,由甲状腺激素分泌不足所致,发病率为1 : 4 000~1 : 3 000 [1-2]。近年我国CH发病率呈升高趋势,随着新生儿疾病筛查技术的开展与普及,检出率达1 : 1 400~1 : 1 700 [3-5],男女比例约为1 : 2。CH的病因主要包括甲状腺发育不全(thyroid dysgenesis, TD)以及甲状腺激素合成不足。TD是原发性永久性CH最常见的病因,约占85%,包括甲状腺缺如(35%~45%)、异位(30%~45%)和发育不良(5%)[6]。近年有学者报道TD占CH比例达65%[7]。CH患儿若早期得不到及时的甲状腺激素治疗,会造成永久性的身材矮小和智力障碍,即呆小症。患儿如在出生后3个月内及时发现并治疗,身体发育和智力可以基本接近正常人。我国广泛开展的新生儿疾病筛查项目使CH患儿尽可能在出生后1~3周内确诊,早期诊断早治疗,减轻国家和家庭负担[8]。
TD可能与遗传有关,近亲婚配人群中TD发病率升高,TD患者一级亲属发生轻度甲状腺异常的概率明显高于正常人[9-10]。目前已发现6个TD相关致病基因:PAX8、NKX2-1、FOXE1、NKX2-5、TSHR、GLIS3基因[11-16]。2018年国外学者首次发现并报道了与TD相关的TUBB1(tubulin-β1)基因突变[17]。TUBB1基因位于20q13.32,包含5个外显子,编码451个氨基酸。微管蛋白(tubulin)包括α-微管蛋白(α-tubulin)和β-微管蛋白(β-tubulin),α-和β-微管蛋白各有一个GTP结合位点,通过异二聚作用形成微管蛋白原纤维的基本结构单元α/β-tubulin二聚体[18],13个原纤维装配成一个微管[19],形成细胞主要骨架结构之一,对维持细胞形态、胞内运输、信号转导、细胞运动和有丝分裂起重要作用[20]。Stoupa等[17]已证实TUBB1基因突变与TD有关,通过干扰微管组装,影响甲状腺细胞增殖、迁移和分化。本研究对山东289例确诊CH伴TD患儿进行TUBB1基因变异筛查,探讨山东地区CH伴TD患儿与TUBB1基因突变的关系。
1 资料与方法 1.1 研究对象选取2007年2月至2016年10月来自山东各地(包括济南、青岛、潍坊、淄博、临沂、聊城)289例确诊CH伴TD患儿为研究对象,包括甲状腺缺如121例(41.9%),甲状腺异位93例(32.2%),甲状腺发育不良75例(26.0%)。男130例(45.0%),女159例(55.0%),平均年龄3.1±1.9岁。
纳入标准:(1)新生儿筛查促甲状腺激素(thyroid-stimulating hormone, TSH) > 9 μIU/mL[21];(2)患儿行甲状腺B超或甲状腺核素扫描检查确诊为TD;(3)已排除CH外的其他先天性疾病。
本研究已告知患儿家属并取得知情同意,且获青岛大学附属医院医学伦理委员会批准(2016-024)。
1.2 基因提取采集患儿外周静脉血2 mL肝素抗凝,使用TIANGEN试剂盒,按照说明书步骤提取基因组DNA,所提取DNA使用Thermo Scientific Multiskan Go核酸蛋白分析仪测定,需在OD260 nm处有唯一吸收峰,且OD260 nm/OD280 nm需在1.8~2.0之间,并于-20℃中保存,备扩增使用。
1.3 PCR扩增使用Primer 5.0软件对TUBB1基因全编码区(1~4号外显子,因第4号外显子较长,分2段设计引物,第5号外显子不编码蛋白)设计引物,由美国Invitrogen公司合成,引物序列及扩增长度见表 1。使用20 μL PCR反应体系为:上、下游引物各0.5 μL,双蒸水7 μL,2×Master Mix 10 μL,DNA模板2 μL(60~80 ng/μL)。PCR反应条件:94℃预变性5 min;94℃变性30 s,56℃退火30 s,72℃延伸40 s,共35个循环;72℃再延伸10 min;最后4℃保存。
| 表 1 TUBB1基因第1~4号外显子引物扩增信息 |
|
|
取10 μL PCR产物加入2%琼脂糖凝胶进行电泳(130 V,25 min),以100 bp DNA Ladder为相对分子质量标准,使用Bio-Rad Gel Doc TM XR+凝胶成像系统进行分析。PCR纯化产物由上海桑尼派森诺生物公司进行Sanger测序。
1.5 测序结果及生物信息学处理Sanger测序结果采用BioEdit、DNAMAN软件和美国国立生物技术信息中心(NCBI, https://www.ncbi.nlm.nih.gov/)中TUBB1基因序列(NM_030773.3)进行比对。依据美国医学遗传学和基因组学学会(American College of Medical Genetics and Genomics, ACMG)遗传变异分类标准和指南[22],对变异致病性进行分析。
2 结果 2.1 TUBB1基因检测结果289例CH伴TD患儿中,共发现4例(1.4%)TUBB1基因存在c.952C > T(p.R318W)杂合变异(图 1)。该变异位点在哺乳动物中高度保守(图 2)。依据ACMG遗传变异分类标准和指南,TUBB1基因c.952C > T(p.R318W)杂合变异在300例正常对照儿童中未发现此变异,符合PS4;ESP数据库(http://evs.gs.washington.edu/EVS)、ExAC数据库(http://exac.broadinstitute.org)及千人基因组数据库(http://browser.1000genomes.org)中次要等位基因频率(MAF) < 0.01,符合PM2;该变异为未经父母样本验证的新发变异,Pubmed数据库(https://www.ncbi.nlm.nih.gov)中尚无CH患者携带此变异的报道,符合PM6;MutationTaster(http://www.mutationtaster.org)、PolyPhen-2(http://genetics.bwh.harvard.edu/pph2)、SIFT(https://sift.bii.a-star.edu.sg)和PROVEAN(http://provean.jcvi.org/index.php)软件生物信息预测分析显示该变异对基因或基因产物造成有害影响,符合PP3。因此该变异被判定为“可能致病的”。见表 2。
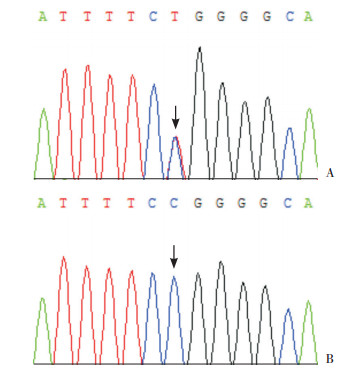
|
图 1 TUBB1基因Sanger测序 图A示CH伴TD患儿所携带的c.952C > T杂合变异;图B示正常对照未发现c.952C > T杂合变异。变异位点如箭头所示。 |

|
图 2 TUBB1蛋白多物种同源性比较 绿色代表同源序列,黑色方框内为TUBB1蛋白第318号氨基酸位点在哺乳动物中高度保守,自上到下分别为:人类、猎豹、猫头鹰、河狐、斑马鱼、海豚、雀类。 |
| 表 2 TUBB1基因c.952C > T变异的ACMG致病性分级 |
|
|
4例携带TUBB1基因变异的CH伴TD患儿,分别于生后21、48、45、30 d确诊,并给予左甲状腺素钠片治疗至今(分别为10、6、8、4岁),身体和智力发育均基本正常,见表 3。
| 表 3 TUBB1基因c.952C > T(p.R318W)变异CH伴TD患儿信息 |
|
|
TUBB1基因为编码β-微管蛋白家族的成员,广泛存在于巨核细胞、甲状腺等组织中。其蛋白分子量为50.3 KDa,包含451个氨基酸,分为3个结构域:氨基末端区域(残基1~206)形成核苷酸结合域,介导微管组装所必须的GTP结合和水解;中间区域(残基207~384)通过与相同或相邻原纤维内的其他微管蛋白分子相互作用参与微管组装;羧基末端区域(残基385~451)与微管结合蛋白结合,调节微管特异性[23]。
甲状腺是胚胎发育的第一个内分泌腺,在人类受孕22 d后开始发育,包括2个阶段:甲状腺胚胎形成、甲状腺终末分化及激素合成。首先正中原基起源于前肠内胚层,2个侧基起源于第4咽囊的神经外胚层。人胚胎22 d时,正中原基开始在咽底和盲孔顶端形成增厚的内胚层上皮,26 d从内胚层板分离,32 d开始沿颈部主动脉弓外侧移动,37 d迁移至尾部,通过甲状舌管与咽上皮和盲孔断开连接。侧基向尾侧迁移,44 d与中位原基融合,48 d最终迁移至气管前位置[24-25]。目前调控甲状腺迁移的分子机制尚不清楚。
甲状腺发育发生在人类胚胎终末分化阶段和孕12周末。孕10~11周,极化甲状腺细胞形成小滤泡,孕12周滤泡体积逐渐增大,储碘增多,甲状腺激素进一步合成[26]。PAX8、NKX2-1、FOXE1基因相互作用,激活甲状腺球蛋白和甲状腺过氧化物酶的转录[27]。
TD具有家族性,提示TD与遗传因素有关。50%~60% TD患者有异位甲状腺,通常异位于舌下腺[24]。目前已明确的CH伴TD致病基因仅发生在小于5%的TD患者中[28]。因此,进一步研究CH伴TD致病基因突变是一项艰巨的任务。
与CH相关的TUBB1基因突变目前国内尚无报道。2018年Stoupa等[17]首次在血亲家族中通过全外显子组测序发现了1例TUBB1基因突变c.479C > T,然后对270例CH伴TD患者应用靶向二代测序技术发现并报道了2个与CH相关的TUBB1基因突变c.318C > G和c.35delG。前2个TUBB1基因突变为错义突变,后一个为移码突变。3例患者甲状腺B超均提示甲状腺异位。Stoupa等验证了TUBB1基因在人和小鼠发育的甲状腺中表达。在TUBB1-/-小鼠模型中,早期祖细胞异常增殖、甲状腺迁移延迟、甲状腺分化缺陷、甲状腺激素释放受损和甲状腺组织结构紊乱,证实了TUBB1基因突变可导致TD。
本研究对山东地区289例确诊CH伴TD患儿进行TUBB1基因变异筛查,发现4例患儿TUBB1基因存在c.952C > T变异,依据ACMG遗传变异分类标准与指南,该变异评级为“可能致病的”。说明TUBB1基因可能为CH伴TD的候选致病基因,但山东地区TUBB1基因变异率较低,仅为1.4%,仍需扩大样本量研究。
TUBB1基因c.952C > T(p.R318W)变异引起CH伴TD的机制尚不清楚。TUBB1基因参与微管二聚体的形成,该变异位于TUBB1蛋白中间结构域,可能通过影响微管蛋白与邻近原纤维内其他微管蛋白分子的相互作用破坏微管组装[23],干扰甲状腺前体细胞增殖,使甲状腺迁移受阻、分化受损,导致甲状腺异位、缺如或发育不良[17]。本研究中TUBB1基因c.952C > T变异患儿的甲状腺检查均为甲状腺缺如,该变异能否通过干扰微管组装影响甲状腺迁移分化或者通过其他途径导致TD需要进一步研究。目前我们正扩大样本量通过高通量二代测序进一步筛选TUBB1基因变异,并通过后续功能实验对TUBB1基因变异的致病性进行验证。
| [1] |
Deladoëy J, Bélanger N, Van Vliet G. Random variability in congenital hypothyroidism from thyroid dysgenesis over 16 years in Québec[J]. J Clin Endocrinol Metab, 2007, 92(8): 3158-3161. DOI:10.1210/jc.2007-0527 (  0) 0) |
| [2] |
Fan X, Fu C, Shen Y, et al. Next-generation sequencing analysis of twelve known causative genes in congenital hypothyroidism[J]. Clin Chim Acta, 2017, 468: 76-80. DOI:10.1016/j.cca.2017.02.009 (  0) 0) |
| [3] |
Mitchell ML, Hsu HW, Sahai I, et al. The increased incidence of congenital hypothyroidism:fact or fancy?[J]. Clin Endocrinol (Oxf), 2011, 75(6): 806-810. DOI:10.1111/j.1365-2265.2011.04128.x (  0) 0) |
| [4] |
Leunbach TL, Christensen PS, Kristensen K. The incidence of congenital hypothyroidism is increasing[J]. Ugeskr Laeger, 2017, 179(26): pii:V11160859. (  0) 0) |
| [5] |
Fu C, Luo S, Li Y, et al. The incidence of congenital hypothyroidism (CH) in Guangxi, China and the predictors of permanent and transient CH[J]. Endocr Connect, 2017, 6(8): 926-934. DOI:10.1530/EC-17-0289 (  0) 0) |
| [6] |
Kollati Y, Ambati RR, Reddy PN, et al. Congenital hypothyroidism:facts, facets&therapy[J]. Curr Pharm Des, 2017, 23(16): 2308-2313. (  0) 0) |
| [7] |
Wassner AJ, Brown RS. Congenital hypothyroidism:recent advances[J]. Curr Opin Endocrinol Diabetes Obes, 2015, 22(5): 407-412. DOI:10.1097/MED.0000000000000181 (  0) 0) |
| [8] |
汪德秀. 新生儿先天性甲状腺功能低下筛查结果分析[J]. 中国社区医师, 2018, 34(34): 174. DOI:10.3969/j.issn.1007-614x.2018.34.102 (  0) 0) |
| [9] |
Kumorowicz-Czoch M, Tylek-Lemanskaz D, Wyrobek L, et al. Thyroid developmental anomalies among first-degree relatives of children with thyroid dysgenesis and congenital hypothyroidism[J]. J Pediatr Endocrinol Metab, 2012, 25(5-6): 413-418. (  0) 0) |
| [10] |
Adibi A, Haghighi M, Hosseini SR, et al. Thyroid abnormalities among first-degree relatives of children with congenital hypothyroidism:an ultrasound survey[J]. Horm Res, 2008, 70(2): 100-104. DOI:10.1159/000139152 (  0) 0) |
| [11] |
Qian F, Li GY, Wu XJ, et al. Novel non-synonymous mutations of PAX8 in a cohort of Chinese with congenital hypothyroidism[J]. Chin Med J (Engl), 2019, 132(11): 1322-1327. DOI:10.1097/CM9.0000000000000213 (  0) 0) |
| [12] |
Kumorowicz-Czoch M, Madetko-Talowska A, Dudek A, et al. Genetic analysis of the paired box transcription factor (PAX8) gene in a cohort of Polish patients with primary congenital hypothyroidism and dysgenetic thyroid glands[J]. J Pediatr Endocrinol Metab, 2015, 28(7-8): 735-743. (  0) 0) |
| [13] |
Hermanns P, Kumorowicz-Czoch M, Grasberger H, et al. Novel mutations in the NKX2.1 gene and the PAX8 gene in a boy with brain-lung-thyroid syndrome[J]. Exp Clin Endocrinol Diabetes, 2018, 126(2): 85-90. DOI:10.1055/s-0043-119875 (  0) 0) |
| [14] |
Wang F, Liu C, Jia X, et al. Next-generation sequencing of NKX2.1, FOXE1, PAX8, NKX2.5, and TSHR in 100 Chinese patients with congenital hypothyroidism and athyreosis[J]. Clin Chim Acta, 2017, 470: 36-41. DOI:10.1016/j.cca.2017.04.020 (  0) 0) |
| [15] |
Peters C, van Trotsenburg ASP, Schoenmakers N. Diagnosis of endocrine disease:congenital hypothyroidism:update and perspectives[J]. Eur J Endocrinol, 2018, 179(6): R297-R317. (  0) 0) |
| [16] |
Jeon K, Kumar D, Conway AE, et al. GLIS3 transcriptionally activates WNT genes to promote differentiation of human embryonic stem cells into posterior neural progenitors[J]. Stem Cells, 2019, 37(2): 202-215. DOI:10.1002/stem.2941 (  0) 0) |
| [17] |
Stoupa A, Adam F, Kariyawasam D, et al. TUBB1 mutations cause thyroid dysgenesis associated with abnormal platelet physiology[J]. EMBO Mol Med, 2018, 10(12): pii:e9569. DOI:10.15252/emmm.201809569 (  0) 0) |
| [18] |
Gardner JF, Cushion TD, Niotakis G, et al. Clinical and functional characterization of the recurrent TUBA1A p.(Arg2His) mutation[J]. Brain Sci, 2018, 8(8): pii:E145. DOI:10.3390/brainsci8080145 (  0) 0) |
| [19] |
Gadadhar S, Bodakuntla S, Natarajan K, et al. The tubulin code at a glance[J]. J Cell Sci, 2017, 130(8): 1347-1353. DOI:10.1242/jcs.199471 (  0) 0) |
| [20] |
Prosser SL, Pelletier L. Mitotic spindle assembly in animal cells:a fine balancing act[J]. Nat Rev Mol Cell Biol, 2017, 18(3): 187-201. (  0) 0) |
| [21] |
杨茹莱, 童凡, 徐艳华, 等. 先天性甲状腺功能低下症2789例诊断标准与治疗探讨及预后研究[J]. 中国儿童保健杂志, 2017, 25(11): 1094-1097. (  0) 0) |
| [22] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. DOI:10.1038/gim.2015.30 (  0) 0) |
| [23] |
Downing KH. Structural basis for the interaction of tubulin with proteins and drugs that affect microtubule dynamics[J]. Annu Rev Cell Dev Biol, 2000, 16: 89-111. DOI:10.1146/annurev.cellbio.16.1.89 (  0) 0) |
| [24] |
Stoupa A, Kariyawasam D, Carré A, et al. Update of thyroid developmental genes[J]. Endocrinol Metab Clin North Am, 2016, 45(2): 243-254. DOI:10.1016/j.ecl.2016.01.007 (  0) 0) |
| [25] |
Nilsson M, Fagman H. Development of the thyroid gland[J]. Development, 2017, 144(12): 2123-2140. DOI:10.1242/dev.145615 (  0) 0) |
| [26] |
Szinnai G, Lacroix L, Carré A, et al. Sodium/iodide symporter (NIS) gene expression is the limiting step for the onset of thyroid function in the human fetus[J]. J Clin Endocrinol Metab, 2007, 92(1): 70-76. DOI:10.1210/jc.2006-1450 (  0) 0) |
| [27] |
Fernández LP, López-Márquez A, Santisteban P. Thyroid transcription factors in development, differentiation and disease[J]. Nat Rev Endocrinol, 2015, 11(1): 29-42. DOI:10.1038/nrendo.2014.186 (  0) 0) |
| [28] |
Carré A, Stoupa A, Kariyawasam D, et al. Mutations in BOREALIN cause thyroid dysgenesis[J]. Hum Mol Genet, 2017, 26(3): 599-610. (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


