新生儿胎粪吸入综合征(meconium aspiration syndrome, MAS)是指胎儿在宫内或产时吸入胎粪污染的羊水,引起的呼吸道机械性阻塞、肺组织化学性炎症及一系列全身症状的临床综合征,是导致新生儿呼吸衰竭和死亡的主要原因之一,病死率达7.0%~15.8%[1]。既往研究显示MAS在住院病人中的发生率约1.2%~2.2%[2]。其发病机制复杂,可引起全身炎症反应综合征,甚至可引发多器官功能衰竭、新生儿持续性肺动脉高压(persistent pulmonary hypertension of the newborn, PPHN)和急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS),使得患儿病情更加凶险。新生儿肺出血(neonatal pulmonary hemorrhage, NPH)是指新生儿期肺大量出血,至少累及2个肺叶,病死率约39%~57%[3]。重症MAS患儿吸入大量胎粪导致不均匀的气道阻塞,引起肺部通气换气功能障碍,同时损伤肺毛细血管壁,引起肺血管通透性增加,容易导致NPH。MAS若并发NPH,将加重呼吸衰竭,而目前治疗措施有限。有报道显示,MAS合并NPH患者预后较差[4]。本研究通过对发生NPH的MAS患儿的临床资料进行分析,探讨合并NPH的MAS患儿的临床特点及转归,寻找MAS患儿合并NPH的早期诊断线索,以期早期干预,降低患儿病死率。
1 资料与方法 1.1 研究对象选取2015年12月至2018年12月在我院新生儿科确诊为MAS并发NPH的患儿45例作为观察组。MAS诊断标准依据《实用新生儿学》[1]。NPH诊断标准符合2001年中华医学会儿科学分会新生儿学组制定的《新生儿肺出血诊断与治疗方案》[5]。NPH患儿均于气管内吸出大量(1 mL以上)鲜红色血性液体。本组病例的气管插管均由总住院医师以上职称人员操作,具备规范和熟练的气管插管技术,未出现气管插管损伤引起的出血现象,且患儿的临床表现和胸片结果均支持肺出血诊断。同时按照1 : 2比例选取同期住院未发生NPH的MAS患儿90例作为对照组。两组患儿入院后均使用高频通气。参数调节为:吸入氧浓度0.4~1.0,平均气道压8~12 cm H2O,吸气时间百分比33%,频率9~11 Hz,振荡压20~50 cm H2O。观察组呼吸机参数系肺出血前设置的呼吸机参数。两组的排除标准:(1)入院不足24 h死亡或放弃治疗;(2)先天性遗传代谢性疾病或染色体病;(3)先天畸形。
1.2 观察指标本研究采用回顾性分析方法,记录每例患儿的住院病历资料,包括母孕期情况:是否合并妊娠期高血压综合征、妊娠期糖尿病、产前感染等;出生情况:分娩方式、出生体重、出生胎龄、性别、胎儿宫内窘迫、小于胎龄儿、胎盘早剥及脐带异常(脐带绕颈、脐带扭转或脐带脱垂)、胎膜早破、生后1 min及5 min Apgar评分等;住院期间情况:是否发生早发型败血症、C反应蛋白(CRP)水平、是否应用肺表面活性物质(pulmonary surfactant, PS)、最高氧合指数(oxygenation index,OI=FiO2×MAP×100/PaO2)、血气分析结果(最低pH和负值最低的BE)、超声心动图检查是否存在动脉导管未闭(patent ductus arteriosus, PDA)[6]、是否发生PPHN[7]。观察组上述临床指标记录时间截至到临床诊断肺出血之前。
并发症及预后情况:死亡情况;气漏综合征、缺氧缺血性脑病(hypoxic-ischemic encephalopathy, HIE)、颅内出血(intracranial hemorrhage, ICH)、呼吸机相关性肺炎(ventilator-associated pneumonia, VAP)、休克、弥漫性血管内凝血(disseminated intravascular coagulation, DIC)的发生情况;呼吸机时间、吸氧时间和住院时间。并发症的诊断符合《实用新生儿学》(第4版)中的诊断标准[1]。
1.3 统计学分析采用SPSS 19.0统计软件进行数据处理。正态分布的计量资料以均值±标准差(x±s)表示,两组间比较采用独立样本均数的t检验;偏态分布的定量资料以中位数(四分位数间距)[M(IQR)]表示,组间比较采用独立样本非参数检验的Mann-Whitney U法;计数资料用例数和百分率(%)表示,组间比较采用χ2检验;采用受试者工作特征曲线(ROC曲线)分析OI在早期诊断NPH中的价值。P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况入组患儿均为羊水Ⅲ°污染的足月儿。观察组45例患儿中,本院分娩13例,外院转运32例;男22例,女23例;入院日龄0.7~24 h(中位数4 h);平均胎龄39.8 ±1.1周,平均出生体重3 295±478 g;NPH发生时间为生后7.9±6.2 h。对照组90例患儿中,本院分娩46例,外院转运44例;男54例,女36例;入院日龄0.7~23 h(中位数3 h);平均胎龄39.7±1.3周,平均出生体重3 233±503 g。
2.2 两组患儿临床资料的比较观察组45例患儿中,22例最高OI≥16(重度ARDS[8]),23例最高OI介于8.0~15.9之间(中度ARDS[8]),45例(100%)患儿存在中重度ARDS;对照组90例患儿中,1例患儿最高OI≥16,31例OI介于8.0~15.9之间,即32例(36%)存在中重度ARDS。观察组患儿生后1 min Apgar评分显著低于对照组(P < 0.05);观察组患儿PPHN的发生率和PS的使用率显著高于对照组(P < 0.05),CRP显著高于对照组(P < 0.01);观察组患儿OI值显著高于对照组(P < 0.01)。见表 1。
| 表 1 两组患儿临床资料的比较 |
|
|
OI值早期诊断MAS并发NPH的ROC曲线下面积为0.959(95%CI:0.929~0.988,P < 0.001),OI值取10.05为最佳截断值,此时OI值用于早期诊断MAS并发NPH的敏感性和特异性分别为80.0%和96.7%(图 1)。
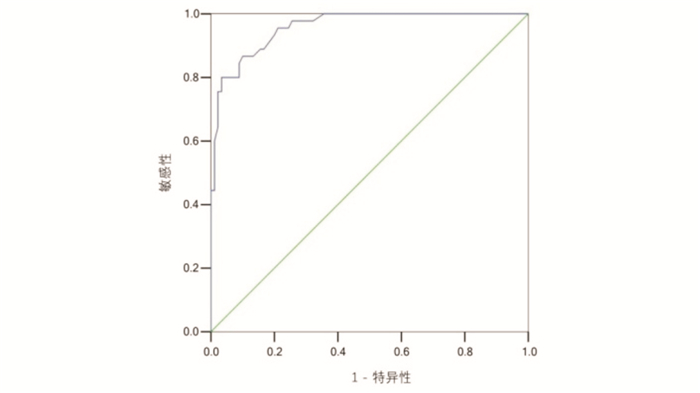
|
图 1 OI值早期诊断MAS并发NPH的ROC曲线 |
观察组治愈出院36例;死亡5例,其中3例死于感染性休克,2例死于重度HIE;4例病情好转后自动出院。对照组治愈出院85例;死亡2例,均死于感染性休克;3例病情好转后自动出院。感染性休克死亡病例入院血培养均为阴性,母亲病史和胎盘拭子未提示感染因素,排除院内感染所致。观察组患儿气漏综合征、休克的发生率高于对照组(P < 0.05);而死亡、HIE、ICH、VAP及DIC的发生率在两组间比较差异均无统计学意义(P > 0.05),见表 2。
| 表 2 两组并发症及预后的比较 [n(%)] |
|
|
在治愈出院的121例患儿中,观察组患儿呼吸机使用时间、吸氧时间及住院时间均较对照组明显延长(P < 0.05),见表 3。
| 表 3 两组治愈出院患儿临床资料的比较 (x±s,d) |
|
|
MAS是新生儿监护病房的常见危急重症,多见于足月儿和过期产儿,以气道的不完全性或完全性阻塞、肺部炎症反应及肺表面活性物质受抑制为特征。MAS发生后引起肺部化学性炎症,氧自由基破坏肺部血管内皮细胞及毛细血管,且重症MAS患儿常常伴有凝血功能异常,均可引起肺出血,影响患儿的肺部通换气功能[9]。重症MAS合并NPH时情况复杂,治疗难度大大增加。NPH发病率仅占活产婴儿的0.1%~0.5%,然而尸检发病率高达40%~84%[10],常常是许多原发疾病的晚期表现,病死率极高。严重MAS极易引起NPH,如果不能及时识别及诊治,具有相当高的病残率和病死率。
关于MAS继发NPH的病因,目前并不十分清楚。文献报道NPH高危因素包括围生期窒息、感染、动脉导管未闭、产房复苏、胎龄小、低出生体重、肺表面活性物质的使用、缺乏产前激素、输血等[3]。Chen等[11]研究结果表明,NPH与低Apgar评分有关,NPH组生后1 min、5 min Apgar评分均低于对照组。本研究中观察组患儿生后1 min Apgar评分低于对照组,与Chen等[11]的研究结果相符。重症MAS患儿吸入大量胎粪物质,胎粪中的胆盐和蛋白酶对PS活性有抑制作用,炎症因子损伤肺泡Ⅱ型上皮细胞也使PS产生减少[12]。本研究中观察组患儿PS的使用率高于对照组,与既往研究[12]相符。外源性PS治疗MAS、NPH均显示有效[12],然而有研究认为PS可使肺血管阻力下降,肺血流迅速增多,有引起NPH的风险[13]。也有研究发现PS有稳定血小板的作用[14],目前PS与肺出血的联系尚无定论。Hofer等[15]研究发现高CRP与MAS疾病早期的严重程度密切相关,本研究也发现观察组患儿CRP高于对照组,均提示炎症反应在MAS发病中有重要作用。胎粪通过趋化中性粒细胞和巨噬细胞释放氧自由基,促炎因子(白介素1、6、8和肿瘤坏死因子)释放诱发化学性炎症反应,使得肺泡上皮细胞和肺血管内皮细胞受损伤,肺泡-毛细血管屏障被破坏,肺组织发生广泛的间质和肺泡水肿,最终引起肺出血[16]。李娟等[17]研究发现肺出血新生儿伴有肺动脉压力增高,即呼吸系统疾病及由此引起的肺血管系统病变,是促进肺动脉高压形成并诱发肺出血的重要因素。本研究发现观察组患儿PPHN的发生率高于对照组,与李娟等[17]的研究结果一致。
呼吸困难是MAS合并NPH的常见临床表现,而OI值可以直观反映患儿肺部的通气换气功能。本研究显示观察组患儿OI值显著高于对照组。“蒙特勒标准”[8]提出,新生儿ARDS最重要的病因是脓毒血症,其次是吸入相关肺损伤,以胎粪吸入最多。OI为诊断ARDS及判断其严重程度的重要诊断标准,轻度ARDS的OI为4.0~7.9,中度ARDS的OI为8.0~15.9,重度ARDS的OI≥16.0[8]。本研究观察组中45例(100%)患儿均存在中重度ARDS,其ARDS发生率明显高于对照组(36%)。NPH与ARDS的病理生理改变相似,均可发现肺泡上皮细胞及肺毛细血管内皮细胞的弥漫性损伤[13]。早产儿肺出血与ARDS关系密切,存活的早产儿后期还可能发生慢性肺间质疾病[18]。本研究ROC曲线分析显示,OI值10.05为早期诊断MAS并发NPH的最佳界值点,其敏感性和特异性分别为80.0%和96.7%。这提示监测MAS患儿病程中的OI值可为诊断NPH提供早期诊断信息。
本研究发现观察组气漏综合征发生率显著高于对照组,这可能与NPH患者需较高的平均气道压迫止血有关。本研究还发现观察组休克的发生率也较高,休克原因考虑主要由感染引起,然而肺出血引起的血容量下降也不容忽视。感染及失血可致缺血缺氧,引起血流缓慢及肺循环淤血,缺氧缺血使氧自由基产生增加,血管内皮细胞结构和功能受损而致肺出血。大量肺出血又可导致低血容量性休克、重度贫血,形成恶性循环[19]。本研究还发现,观察组患儿呼吸机使用时间、吸氧时间及住院时间较对照组明显延长,提示NPH患儿肺损伤严重,可能需要较长的恢复时间。
综上所述,OI值可作为MAS并发NPH的早期诊断指标。1 min Apgar评分和CRP作为非特异性指标,在MAS合并NPH的早期诊断也有一定的辅助作用。除此之外,发生NPH的MAS患儿机械通气时间更长,发生气漏综合征和休克的风险也更高。因此,密切监测OI水平,并采取有效措施可提高MAS并发NPH的抢救成功率。由于本研究样本量少,纳入样本均为足月儿,研究结果可能存在偏倚,将有待于大样本、多中心研究进一步证实。
| [1] |
邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学[M]. 第4版. 北京: 人民卫生出版社, 2011: 412-416, 699-714, 405, 568-573, 642-646.
(  0) 0) |
| [2] |
杨迪元, 沈莉荣, 于爱真, 等. 糖皮质激素治疗胎粪吸入综合征疗效和安全性的Meta分析[J]. 中国循证儿科杂志, 2011, 6(2): 126-134. DOI:10.3969/j.issn.1673-5501.2011.02.010 (  0) 0) |
| [3] |
Ferreira CH, Carmona F, Martinez FE. Prevalence, risk factors and outcomes associated with pulmonary hemorrhage in newborns[J]. J Pediatr (Rio J), 2014, 90(3): 316-322. DOI:10.1016/j.jped.2013.12.008 (  0) 0) |
| [4] |
Louis D, Sundaram V, Mukhopadhyay K, et al. Predictors of mortality in neonates with meconium aspiration syndrome[J]. Indian Pediatr, 2014, 51(8): 637-640. DOI:10.1007/s13312-014-0466-0 (  0) 0) |
| [5] |
中华医学会儿科学分会新生儿学组, 中华儿科杂志编辑委员会. 新生儿肺出血的诊断与治疗方案[J]. 中华儿科杂志, 2001, 39(4): 248. DOI:10.3760/j.issn:0578-1310.2001.04.018 (  0) 0) |
| [6] |
潘雨晴, 薛辛东. 早产儿动脉导管未闭管理及其争议[J]. 中国实用儿科杂志, 2015, 30(2): 85-88. (  0) 0) |
| [7] |
Lakshminrusimha S, Keszler M. Persistent pulmonary hypertension of the newborn[J]. Neoreviews, 2015, 16(12): e680-e692. DOI:10.1542/neo.16-12-e680 (  0) 0) |
| [8] |
De Luca D, van Kaam AH, Tingay DG, et al. The Montreux definition of neonatal ARDS:biological and clinical background behind the description of a new entity[J]. Lancet Respir Med, 2017, 5(8): 657-666. DOI:10.1016/S2213-2600(17)30214-X (  0) 0) |
| [9] |
Swarnam K, Soraisham AS, Sivanandan S. Advances in the management of meconium aspiration syndrome[J]. Int J Pediatr, 2012, 2012: 359571. (  0) 0) |
| [10] |
林新祝, 赖基栋, 吕梅, 等. 高频振荡通气联合肺表面活性物质治疗新生儿肺出血的疗效观察[J]. 中国当代儿科杂志, 2015, 17(4): 345-349. (  0) 0) |
| [11] |
Chen YY, Wang HP, Lin SM, et al. Pulmonary hemorrhage in very low-birthweight infants:risk factors and management[J]. Pediatr Int, 2012, 54(6): 743-747. DOI:10.1111/j.1442-200X.2012.03670.x (  0) 0) |
| [12] |
Jasani B, Kabra N, Nanavati R. Surfactant replacement therapy beyond respiratory distress syndrome in neonates[J]. Indian Pediatr, 2016, 53(3): 229-234. DOI:10.1007/s13312-016-0826-z (  0) 0) |
| [13] |
Zahr RA, Ashfaq A, Marron-Corwin M. Neonatal pulmonary hemorrhage[J]. Neoreviews, 2012, 13(5): e302-e306. DOI:10.1542/neo.13-5-e302 (  0) 0) |
| [14] |
Sadeh-Vered T, Rosenberg N, Morag I, et al. A proposed role of surfactant in platelet function and treatment of pulmonary hemorrhage in preterm and term infants[J]. Acta Haematol, 2018, 140(4): 215-220. DOI:10.1159/000493082 (  0) 0) |
| [15] |
Hofer N, Jank K, Strenger V, et al. Inflammatory indices in meconium aspiration syndrome[J]. Pediatr Pulmonol, 2016, 51(6): 601-606. DOI:10.1002/ppul.23349 (  0) 0) |
| [16] |
Chettri S, Bhat BV, Adhisivam B. Current concepts in the management of meconium aspiration syndrome[J]. Indian J Pediatr, 2016, 83(10): 1125-1130. DOI:10.1007/s12098-016-2128-9 (  0) 0) |
| [17] |
李娟, 李书琴, 胡树春, 等. 多普勒血流频谱法估测肺出血新生儿肺动脉压的研究[J]. 中华儿科杂志, 2001, 39(1): 8-10. DOI:10.3760/j.issn:0578-1310.2001.01.003 (  0) 0) |
| [18] |
Lee M, Wu K, Yu A, et al. Pulmonary hemorrhage in neonatal respiratory distress syndrome:radiographic evolution, course, complications and long-term clinical outcomes[J]. J Neonatal Perinatal Med, 2019, 12(2): 161-171. DOI:10.3233/NPM-1867 (  0) 0) |
| [19] |
杨小凤, 孙斌. 新生儿肺出血结局相关的因素分析[J]. 中国血液流变学杂志, 2017, 27(1): 83-85. DOI:10.3969/j.issn.1009-881X.2017.01.023 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


