2. 大连市妇幼保健院儿保科, 辽宁 大连 116033;
3. 中国医科大学附属盛京医院发育儿科, 辽宁 沈阳 110004
C12orf65基因位于12q14.31,是一种有助于线粒体翻译的核基因[1]。目前研究发现,C12orf65基因突变可以导致复合型氧化磷酸化7型和常染色体隐性痉挛性截瘫55型两种疾病[2]。C12orf65基因突变于2010年由Antonicka等[1]首次报道,认为C12orf65基因纯合突变可导致类似于Leigh综合征(Leigh syndrome, LS)的临床表现,并伴有视神经萎缩,患者预后不佳。2012年Shimazaki等[2]发现C12orf65基因突变可导致常染色体隐性痉挛性截瘫55型,患者有视神经萎缩和运动障碍,但无明显的认知受损和LS表现。2014年Heidary等[3]报道了C12orf65基因突变可影响线粒体超微结构。2017年首个中国C12orf65基因突变患者被报道[4],临床特点与本例患儿相似且有一个相同突变位点c.394C > T。本研究对1例以视神经萎缩为主要临床表现的患儿进行全外显子组和线粒体基因组测序,发现了C12orf65基因1个新突变位点,并进行基因型与临床表型的分析与判断。
1 资料与方法 1.1 研究对象患儿女,8岁,因视力下降3年,运动能力下降1年就诊。5岁入托体检时发现双眼视力欠佳,多次就诊于外院眼科。查右眼视力:0.5(矫正不提高),左眼视力:0.3(矫正不提高),双眼角膜明,前房正常,晶体透明;眼底检查示视网膜平,视盘色苍白、界清,后极部未见出血渗出;视野检查示右眼生理盲点扩大,左眼视野正常。诊断为“视神经萎缩”,给予口服“甲钴胺片、维生素E”等对症治疗3年无明显好转。1年前患儿出现运动能力下降,劳累后易跌倒,未予重视。现为求病因学诊断就诊于我院。现患儿视力下降,下蹲正常,站起缓慢,无发热,无头痛,无喷射性呕吐。
患儿为第2胎第2产,足月剖宫产,出生体重3.9 kg,出生身长48 cm,运动和智力发育与同龄儿相似,现读小学2年级,学习成绩中等。母孕期无异常,无围产期并发症。患儿既往体健。有一12岁哥哥,身体健康。否认家族遗传病史。
入院体查:神志清楚,精神可,轻度鸭形步态。双侧瞳孔等大等圆,对光反射灵敏。双肺呼吸音清,未闻及啰音。心音有力,律齐,心率86次/min,各瓣膜区未闻及病理性杂音。腹软,无压痛及反跳痛,肝脾未触及。下蹲正常,站起缓慢但不需要扶大腿,四肢肌肉无肥大及触痛,四肢肌张力正常,生理反射存在,病理反射未引出。
辅助检查:血常规、心肌酶谱正常。肌电图示双下肢运动神经轴索损害。头部MRI平扫正常。
1.2 全外显子组和线粒体基因组测序经患儿监护人同意后,抽取患儿及其父母、哥哥外周血各2 mL,提取基因组DNA。使用Nanodrop 2000样本定量检测仪进行质控,由北京迈基诺公司进行全外显子组和线粒体基因组测序。对检测到的基因变异在单核苷酸多态性数据库(dbSNP, http://www.ncbi.nlm.nih.gov/SNP)、千人基因组(http://www.internationalgenome.org)、ExAC数据库(http://exac.broadinstitute.org)等人群数据库查找变异位点分布频率。应用人类基因突变数据库(HGMD, http://www.hgmd.cf.ac.uk)、人类在线孟德尔遗传数据库(OMIM, http://omim.org)确认已报道的致病基因位点。依据美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics, ACMG)发布的序列变异解读标准和指南[5]对变异的致病性进行评估。
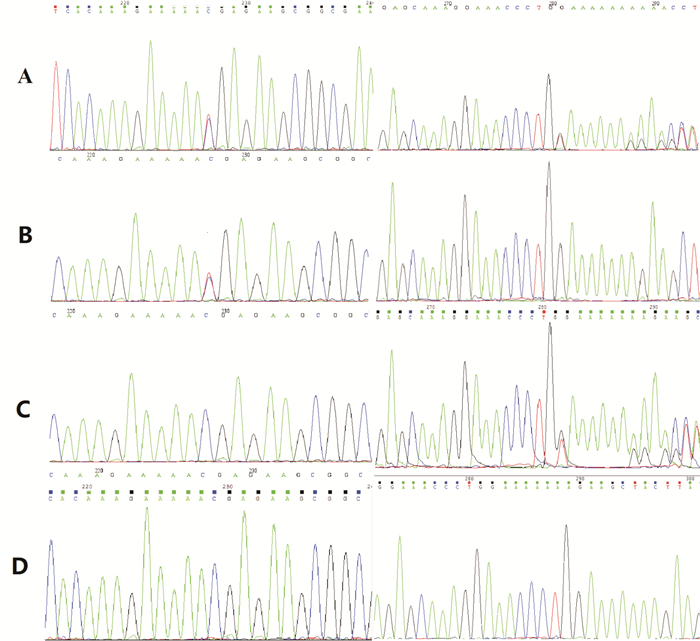
2 结果 2.1 基因检测结果及致病性分析全外显子组测序发现患儿C12orf65基因存在复合杂合变异,其中一个为无义突变c.394C > T(p.R132X),该变异使第394位编码核苷酸C变为T,使得第132位精氨酸变异为终止密码子,导致蛋白翻译提前终止;该变异在千人基因组数据库、ExAC数据库、dbSNP数据库中发生频率极低;蛋白功能预测结果均为未知,在HGMD数据库中已有报道。经Sanger家系验证分析,该变异来源于患儿父亲,患儿母亲及哥哥为野生型(图 1)。根据ACMG指南判断,该变异为致病性变异。
|
图 1 患儿及其家庭成员C12orf65基因Sanger测序图 图A示患儿C12orf65基因存在c.394C > T和c.447_449delGGAinsGT的复合杂合突变,分别遗传自父母,患儿哥哥未携带任一突变。箭头所示为突变位点。 |
另一个为未见报道的移码突变c.447_449delGGAinsGT(p.E150Kfs),该变异使第447~449位编码核苷酸缺失了3个核苷酸GGA插入了2个核苷酸GT,发生移码突变,可能导致基因功能丧失;该变异在千人基因组数据库、ExAC数据库、dbSNP数据库中为低频变异;蛋白功能预测结果均为未知,在OMIM、HGMD数据库中未见报道。经Sanger家系验证分析,该变异来源于患儿母亲,患儿父亲及哥哥为野生型(图 1)。根据ACMG指南判断,该变异为致病性变异。
2.2 治疗与结局根据患儿临床表现、实验室检查及基因测序结果,该患儿诊断为常染色体隐性痉挛性截瘫55型。本病无特殊治疗措施,嘱患儿注意休息,避免剧烈体育活动,每3个月进行1次病情评估,病情变化随诊。至今随访4个月,患儿视力情况及运动能力无明显改变。
3 讨论C12orf65基因突变可导致复合型氧化磷酸化7型和常染色体隐性痉挛性截瘫55型两种疾病,这两种疾病均可出现视神经萎缩。复合型氧化磷酸化7型的患儿除视神经萎缩外,还伴有明显的发育障碍、认知障碍、头颅MRI改变和肌酸激酶显著升高[3],临床症状进展迅速,20岁左右即需要坐轮椅,寿命缩短。而常染色体隐性痉挛性截瘫55型患儿主要临床表现为视神经萎缩及痉挛性截瘫[2],临床症状进展缓慢,大多数没有智力受损,一般不需要坐轮椅,寿命不受影响。本例患儿仅有视神经萎缩和运动障碍,而无心肌酶谱、头部MRI及认知功能改变,故诊断为常染色体隐性遗传痉挛性截瘫55型,预后较好。
C12orf65基因共有3个外显子,目前已报道涉及C12orf65基因突变的患者共有29例[1-4, 6-12]。其中11例的基因突变位于2号外显子[1, 3, 7, 10-11],均有认知功能受损,并有3例患者寿命受到影响,分别于5、8、22岁死亡[1, 3]。15例的基因突变位于3号外显子[2, 4, 6, 8-9, 12],仅有7例有认知功能受损,未有死亡病例报道。本例患儿为C12orf65基因复合杂合突变,2个突变均位于3号外显子,其中c.447_449delGGAinsGT为新发现的突变位点,无认知功能受损,仅有视力受损和运动障碍。分析本例患儿和已报道的患者,发现C12orf65基因突变位置和临床表型可能存在一定相关性。2号外显子的基因突变,导致了C12orf65蛋白截断,进而使线粒体蛋白质合成缺陷和呼吸复合酶活性降低[2]。当基因突变位于2号外显子时,寿命可能受到影响,临床症状较重;当基因突变位置位于3号外显子时,患者的临床表型呈多样化表现,但总体严重程度轻于2号外显子(表 1)。
| 表 1 C12orf65基因突变患者突变位点和临床症状总结 |
|
|
本研究中,全外显子组测序起到了3个方面作用:一方面对患儿进行了病因学诊断,从而明确了患儿遗传学病因,有利于遗传咨询;第二,通过基因型分析有利于临床表型和预后评估;第三,发现C12orf65基因新突变c.447_449delGGAinsGT,丰富了C12orf65基因突变谱。本研究同时也提示临床医生,当患儿以视神经萎缩为主要临床表现时,不能忽视运动系统检查,并警惕C12orf65基因突变的可能。
| [1] |
Antonicka H, Ostergaard E, Sasarman F, et al. Mutations in C12orf65 in patients with encephalomyopathy and a mitochondrial translation defect[J]. Am J Hum Genet, 2010, 87(1): 115-122. (  0) 0) |
| [2] |
Shimazaki H, Takiyama Y, Ishiura H, et al. A homozygous mutation of C12orf65 causes spastic paraplegia with optic atrophy and neuropathy (SPG55)[J]. J Med Genet, 2012, 49(12): 777-784. DOI:10.1136/jmedgenet-2012-101212 (  0) 0) |
| [3] |
Heidary G, Calderwood L, Cox GF, et al. Optic atrophy and a Leigh-like syndrome due to mutations in the C12orf65 gene:report of a novel mutation and review of the literature[J]. J Neuroophthalmol, 2014, 34(1): 39-43. DOI:10.1097/WNO.0000000000000076 (  0) 0) |
| [4] |
Fang XJ, Zhang W, Lyu H, et al. Compound heterozygote mutation of C12orf65 causes distal motor neuropathy and optic atrophy[J]. Chin Med J (Engl), 2017, 130(2): 242-244. (  0) 0) |
| [5] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. DOI:10.1038/gim.2015.30 (  0) 0) |
| [6] |
Spiegel R, Mandel H, Saada A, et al. Delineation of C12orf65-related phenotypes:a genotype-phenotype relationship[J]. Eur J Hum Genet, 2014, 22(8): 1019-1025. DOI:10.1038/ejhg.2013.284 (  0) 0) |
| [7] |
Pyle A, Ramesh V, Bartsakoulia M, et al. Behr's syndrome is typically associated with disturbed mitochondrial translation and mutations in the C12orf65 gene[J]. J Neuromuscul Dis, 2014, 1(1): 55-63. (  0) 0) |
| [8] |
Imagawa E, Fattal-Valevski A, Eyal O, et al. Homozygous p.V116* mutation in C12orf65 results in Leigh syndrome[J]. J Neurol Neurosurg Psychiatry, 2016, 87(2): 212-216. (  0) 0) |
| [9] |
Buchert R, Uebe S, Radwan F, et al. Mutations in the mitochondrial gene C12orf65 lead to syndromic autosomal recessive intellectual disability and show genotype phenotype correlation[J]. Eur J Med Genet, 2013, 56(11): 599-602. DOI:10.1016/j.ejmg.2013.09.010 (  0) 0) |
| [10] |
Nishihara H, Omoto M, Takao M, et al. Autopsy case of the C12orf65 mutation in a patient with signs of mitochondrial dysfunction[J]. Neurol Genet, 2017, 3(4): e171. DOI:10.1212/NXG.0000000000000171 (  0) 0) |
| [11] |
Wesolowska M, Gorman GS, Alston CL, et al. Adult onset Leigh syndrome in the intensive care setting:a novel presentation of a C12orf65 related mitochondrial disease[J]. J Neuromuscul Dis, 2015, 2(4): 409-419. DOI:10.3233/JND-150121 (  0) 0) |
| [12] |
Tucci A, Liu YT, Preza E, et al. Novel C12orf65 mutations in patients with axonal neuropathy and optic atrophy[J]. J Neurol Neurosurg Psychiatry, 2014, 85(5): 486-492. DOI:10.1136/jnnp-2013-306387 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


