2. 东南大学附属中大医院儿科, 江苏 南京 210009
脑室周围白质软化症(periventricular leukoma-lacia, PVL)是早产儿最严重的损伤,极早产儿PVL的发生率超过50%[1-2],目前,PVL的致病机制尚不清楚,尚缺乏明确的安全可靠的治疗方法。虽然足月新生儿脑损伤治疗有亚低温、干细胞等治疗方法[3],但目前尚无针对早产儿的有效治疗方法。因此,为了寻找新的、安全有效的治疗方法,深入了解早产儿脑白质损伤的机制是十分重要的。肽组学是蛋白质组学的一个新兴分支,主要研究内源性蛋白片段[4],它们由活化或酶降解等水解过程产生[5],可以直接与细胞靶点相互作用,发挥功能。在本研究中,我们采用串联质谱标记(TMT)结合液相色谱串联质谱(LC-MS/MS)对早产儿脑白质损伤模型大鼠海马组织进行差异表达多肽谱分析,以期探索脑发育过程中及早产儿脑白质损伤发病机制中的关键生物活性肽和可能的作用机制。
1 材料与方法 1.1 动物选择和模型制备孕18~19 d的Sprague-Dawley母鼠购自南京医科大学实验动物中心,每只母鼠生育约10~14只幼鼠,本研究从两窝幼鼠中共取20只幼鼠,随机分为假手术组和模型组,每组10只。幼鼠和母鼠同笼饲养,饲养环境和模型制备方法参照本课题组前期研究[6-7]:模型组幼鼠在生后2 d行右侧颈总动脉永久结扎术,术后缺氧2 h;假手术组幼鼠分离右侧颈总动脉,但不行结扎和缺氧。另选取幼鼠1只于结扎和缺氧处理后12 d灌注4%多聚甲醛,取脑组织,在视神经交叉平面切片(10 μm),行苏木精-伊红染色,光学显微镜下观察。本研究经东南大学动物保护与伦理学会批准。
1.2 脑组织标本收集和储存两组幼鼠在生后5 d(造模后3 d)时断头取脑,行冠状切片,前囱0~3.0 cm部分被切割成海马体、丘脑、杏仁核和下丘脑。按分组收集海马组织汇集成1个标本池,用0.9%的盐水冲洗后置于匀浆器中,滴加裂解缓冲液[含2 mol/L硫脲、7 mol/L尿素、1% DTT(w/v)、1%蛋白酶抑制剂的混合物(v/v)],于冰上行海马组织匀浆。在4℃条件下,以3 263 r/min离心10 min,收集上清液。然后加入20%乙腈(v/v),孵育20 min,采用分子截留量为30 kDa的MWCO过滤器,在4℃条件下,以7 297 r/min离心30~45 min,收集流出液。使用BCA蛋白质测定法测定上清液中的多肽/蛋白质的浓度。
1.3 TMT和LC-MS/MS分析根据TMT 6-plex试剂盒(Thermo Fisher Scientific, 美国)使用说明,进行多肽的TMT标记。多肽的分析采用纳升级液相系统(Easy-nLC 1200,美国Thermo Fisher Scientific, 美国)分离,并联合在线连接双压线性离子阱高分辨率组合型质谱仪(LTQ-OrbitrapVelos mass spectrometer, Thermo Fisher Scientific, 美国)系统分析。假阳性率(FDR)被定在两个蛋白质和肽水平≤1%(-logP≥2)。只有当多肽的峰在每个样本质谱峰图中至少出现2次,才被认为鉴定到。海马组织中多肽的相对定量采用PEAKS Q模块中的TMT标记方法进行,使用最大期望算法对每个样本分别进行特征数据库检索。来自不同样本的相同肽的特征采用高性能的保留时间比对算法进行可靠性比对[8],最后进行量化分析。当倍数变化绝对值≥2.5时,多肽的差异表达被认为是有统计学意义的。
1.4 生物信息学分析每个差异多肽的等电点(PI)/分子量(MW)采用在线计算工具(http://web.expasy.org/compute_pi/)获得。进行基因本体(GO)分析(http://geneontology.org),以揭示多肽蛋白前体可能发挥的作用,确定潜在的生理功能。分析过程由P < 0.01和FDR < 0.01共同决定是否具有统计学差异。为了进一步探索差异表达多肽及其前体蛋白的生物学意义,本研究采用Ingenuity Pathway Analysis(IPA)软件7.1版(Mountain View,加拿大)[9]进行分析。根据上传数据给出相关的经典信号通路,同时给出P值,P值是用右侧Fisher确切概率法计算出来的,P < 0.05为差异有统计学意义。
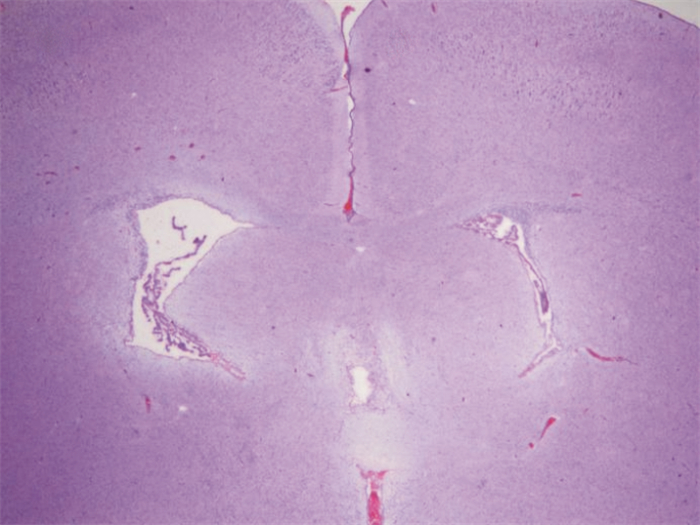
2 结果 2.1 模型组大鼠大脑病理特点光学显微镜下观察提示右侧脑室较对侧明显增大,脑室形状不规则(图 1);白质区着色较浅,脑室周围胼胝体及内囊组织减少,胼胝体变薄,层次混乱,可见水肿、细胞周围间隙增宽,部分神经细胞变性、坏死,部分可见内囊部位空腔形成;皮质部位亦有病变,但大脑皮层细胞结构相对完整,布局有序,分层欠清,可见水肿的神经元和核固缩细胞。提示建模成功。
|
图 1 脑组织病理变化(苏木精-伊红染色,×20) 光学显微镜下观察提示右侧脑室较对侧明显增大,脑室形状不规则。 |
本研究中共鉴定并量化4 164条多肽,其中262条多肽在两组大鼠海马组织中有差异表达(倍数变化绝对值≥2.5),164条多肽表达上调,98条多肽表达下调。部分差异表达多肽见表 1。
| 表 1 假手术组和模型组大鼠海马组织中差异表达多肽 |
|
|
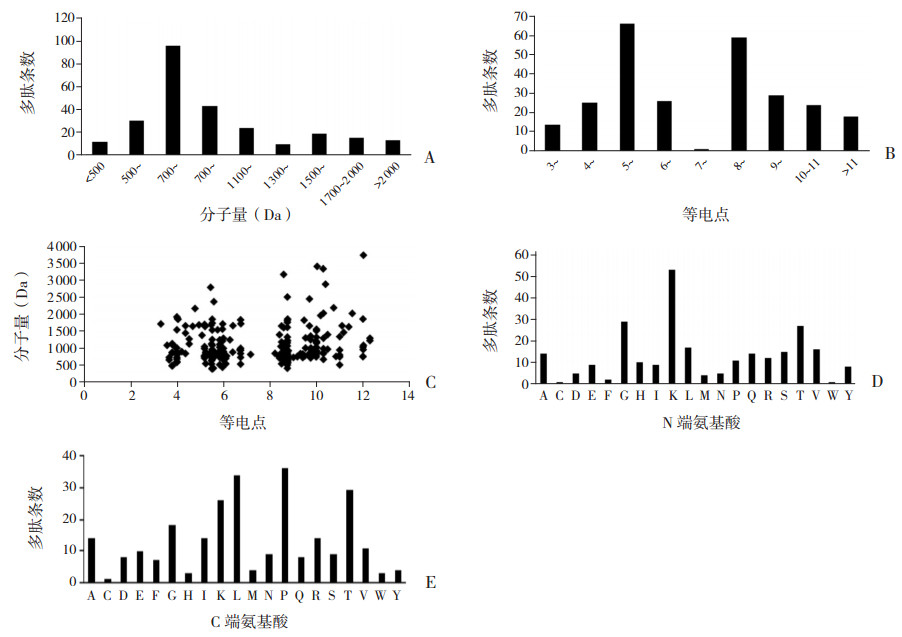
通过对海马组织中发现的262条差异表达多肽进行分析,结果发现MW和PI分布范围较广,但MW为1 300 Da以下分布较多(图 2A),PI为5~和8~分布最多(图 2B)。PI与MW的关系如图 2C。大部分差异表达多肽的MW低于2 000 Da。
|
图 2 假手术组和模型组大鼠海马组织中差异表达多肽的特征 A:差异表达多肽分子量分布;B:差异表达多肽等电点分布;C:差异表达多肽分子量与等电点的散点图分布;D:差异表达多肽(N端氨基酸)的裂解位点分布;E:差异表达多肽(C端氨基酸)的裂解位点分布;[A]丙氨酸;[C]半胱氨酸;[D]天冬氨酸;[E]谷氨酸;[F]苯丙氨酸;[G]甘氨酸;[H]组氨酸;[I]异亮氨酸;[K]赖氨酸;[L]亮氨酸;[M]甲硫氨酸;[N]天冬酰胺;[P]脯氨酸;[Q]谷氨酰胺;[R]精氨酸;[S]丝氨酸;[T]苏氨酸;[V]缬氨酸;[W]色氨酸;[Y]酪氨酸。 |
本研究对两组幼鼠海马组织262条差异表达多肽的N端和C端裂解位点进行生物信息学分析。赖氨酸(K)、甘氨酸(G)、苏氨酸(T)、亮氨酸(L)为起始断裂位点的4个主要氨基酸(N端氨基酸,图 2D),而终端断裂位点的4个主要氨基酸(C端氨基酸,图 2E)为脯氨酸(P)、L、T、K。
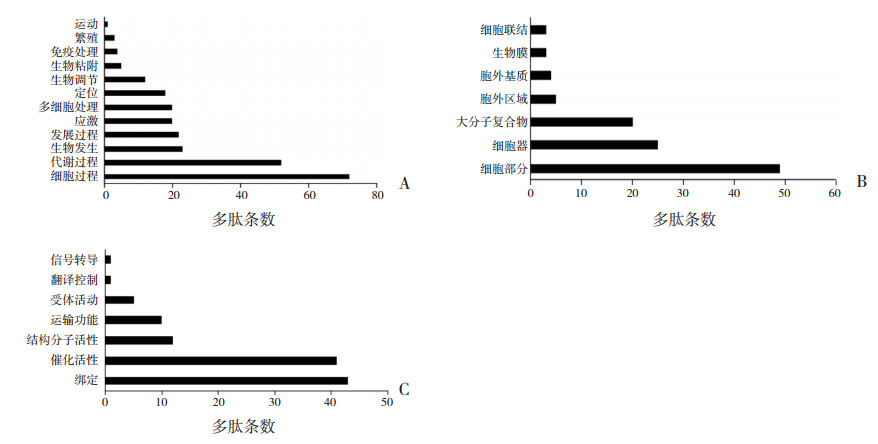
2.5 差异表达多肽前体蛋白的GO分析与通路分析为确定差异表达多肽及其前体蛋白的潜在作用,本研究进行了GO和通路分析。图 3中列出了最常见的生物过程(图 3A)、细胞成分(图 3B)和分子功能(图 3C)类别,它们各自涉及到多个方面。涉及神经系统发育和功能的生物过程有细胞过程、代谢过程和生物发生等;细胞成分有细胞部分、细胞器和大分子复合物等;分子功能有绑定、催化活性和结构分子活性等。
|
图 3 差异表达多肽及其前体蛋白GO分析 A:生物过程类别的GO分析;B:细胞成分类别的GO分析;C:分子功能类别的GO分析。 |
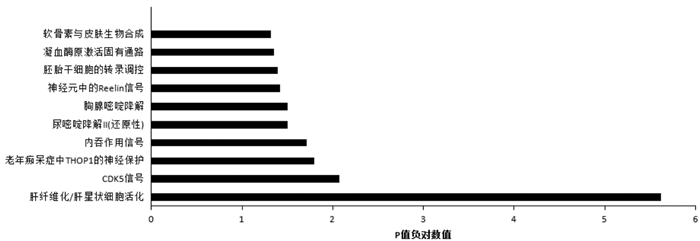
将两组海马组织中差异表达多肽的前体蛋白与标准通路进行比对,图 4是将具有统计学意义的前体蛋白参与的经典信号通路绘制成条形图,结果提示CDK5信号通路和肝纤维化/肝星状细胞活化通路差异有统计学意义(P值负对数值> 2)。结合文献分析[10-11],CDK5信号通路与神经系统发育和功能关系密切,提示该通路在模型组海马组织中被激活。
|
图 4 差异表达多肽及其前体蛋白的经典信号通路分析 P值负对数值> 2,表示差异有统计学意义。 |
差异表达多肽存在于蛋白质功能结构域内是其发挥生物学功能的前提,这些差异表达多肽相应的前体蛋白多数与神经系统发育和功能相关,将之与对应前体蛋白的生物活性功能结构域相匹配,位于前体蛋白结构域内的差异表达多肽在图 5中列出,其中ELN、PCLO、MAP4、MYO15a和MAP1b含有差异表达多肽的条数最多;表 2中列出了上述5种在调节中变化最多蛋白的多肽氨基酸序列,包括蛋白名称、氨基酸序列、肽段位置。
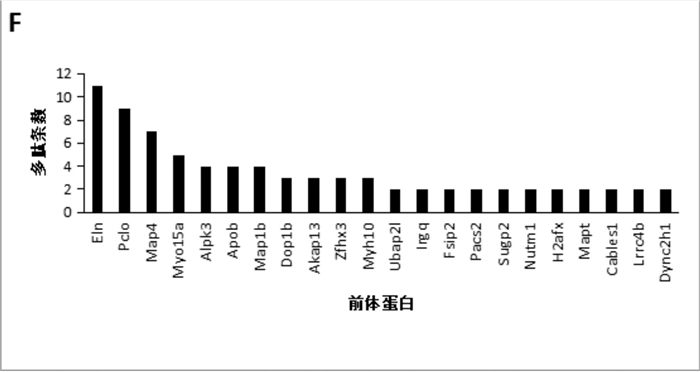
|
图 5 差异表达多肽的前体蛋白分析 |
| 表 2 早产儿脑白质损伤模型大鼠海马组织中与神经系统发育和功能相关的差异表达多肽及其前体蛋白 |
|
|
该研究中我们鉴定并量化4 164条多肽,其中262条多肽存在差异表达;164条多肽上调,98条多肽下调。蛋白质组学是通过蛋白质降解形成的,而稳定的裂解产物是通过限制性的蛋白水解生成的[12]。不同的裂解事件反映蛋白酶的特异性,不同的裂解位点可能代表不同的蛋白酶活性。图 2D和2E分析了差异表达多肽的所有裂解位点。20个氨基酸(裂解位点)之间的差异明显,值得深入探讨蛋白酶功能的变化。
研究结果提示CDK5信号通路在模型组海马组织中被激活,早产儿脑白质损伤可能与CDK5信号通路有关,这可能是差异表达多肽及其前体蛋白介导神经系统发育和功能失调的途径,具体作用机制有待进一步研究。现有文献表明CDK5除了维持神经元的结构外,还可能在突触可塑性、神经递质释放、神经元迁移和神经突生长的调控中发挥重要作用。抑制CDK5在神经损伤或神经退行性疾病中存在神经保护作用。Hawasli等[10]认为CDK5通过直接与NR2b及其Calpain蛋白酶相互作用促进NR2b的降解,从而控制突触可塑性和学习,Mushtaq等[11]认为CDK5药物抑制剂具有神经保护作用,可以治疗人类神经退行性疾病,如阿尔茨海默症、肌萎缩侧索硬化症和与脑卒中相关的神经元损失。
在本研究中共有11个内源性差异表达多肽映射到ELN蛋白的功能域。威廉斯综合征是一种神经遗传疾病,由7q11.23缺失1.5 Mb引起,该区域覆盖20个基因,目前发现的最短的缺失仅仅涉及两个基因:ELN和LIMK1。儿童威廉斯综合征存在认知能力下降相关的临床症状,ELN基因缺失不仅可能导致心脏发育畸形,还可能导致认知能力下降。从另一个角度来看,也许心脏和大脑存在共同的发育遗传学机制。本研究结果提示ELN蛋白可能与认知病理学有关,值得重新认识。另外,无论这些多肽是来自ELN降解还是新合成的小分子物质,其在PVL中的差异表达的丰度可能反映了ELN在神经系统发育中的表达和功能的变化,因此可能是PVL的生物活性肽。
本研究中共有9个内源性差异表达多肽映射到PCLO蛋白的功能域。人类PCLO基因定位于7q11.23-q21.3,这是7号染色体的一个区域,被认为是孤独症谱系障碍和威廉姆斯综合征的联系位点,提示PCLO基因表达的改变可能会导致发育障碍和智力迟钝。Ibi等[13]发现Piccolo蛋白在小鼠海马CA1区突触可塑性和海马依赖性学习中起关键作用,在应激条件下调控海马区谷氨酸细胞外浓度。Ho Kim等[14]将阿尔茨海默症患者死亡后脑组织海马CA4区、齿状回亚区与对照组脑组织进行蛋白组学质谱分析,结合无标签定量鉴别差异表达蛋白,确定PCLO为阿尔茨海默症的生物标志物。
本研究中分别有7个和4个内源性差异表达多肽映射到MAP4和MAP1b蛋白的功能域。MAP4与细胞分裂过程相关,可促进微管组装,它的磷酸化影响微管性能和细胞周期的进展。MAP1家族成员存在于神经细胞的轴突和树突中,它主要在脑发育早期表达,在微管动力学调节中发挥重要作用,对神经突的生长和延伸至关重要[15],MAP1b敲除可导致神经元轴突缺陷[16]。MAP1b以细胞自主的方式介导细胞伸长和极化的突起活动,这是神经细胞的内侧位移和微管相关依赖的基础[17],MAP1b在神经突和轴突扩展过程中直接调控EBs功能和MT动力学变化[18],在神经突分支点处,其磷酸化和亚细胞数量均受到精细调控,共同参与轴突再生[19],在侧支形成的早期,NGF调控MAP1b在轴突丝足中的磷酸化[20]。最近发现MAP1b还参与少突胶质细胞髓鞘化[21],而且MAP1b及其磷酸化对皮质神经元间突触的形成具有重要意义[22]。MAP1b 1~126过表达导致神经突延长和神经元死亡,提示该片段可能参与神经元变性和异常萌发[23]。在本研究中,MAP1b 125~131的肽段“RLMITDA”在模型组中降低,是否存在一种自我保护机制来减少神经元死亡和抑制神经突延长?这值得进一步研究。
本研究中5个差异性表达的内源性多肽被映射到MYO15a蛋白功能域。MYO15a的复合杂合突变与非综合征性听力损失相关,Motavaf等[24]在先天性感音神经性听力损失患者MYO15a基因中发现了一种新的纯合供体剪接位点突变。这可能与许多PVL患者常常出现学习障碍和听力问题等终生残疾有关[25]。
综上所述,本研究首先提供了早产儿脑白质损伤模型大鼠海马组织多肽发生差异表达的概况,现有很多文献讨论这些多肽相关前体蛋白与大脑功能之间的关系,尤其是MAP1b与大脑发育和功能的关系,如神经突伸长、神经突延长、神经元迁移、神经元分化、髓鞘化少突胶质细胞、突触发生、工作记忆等。这些多肽可能是早产儿脑白质损伤过程中参与神经系统发育和功能的关键生物活性多肽,它们在早产儿脑白质损伤致病机制中的重要生物学功能及其分子机制尚有待进一步研究。同时本研究提示早产儿脑白质损伤过程中海马区CDK5信号通路被激活,CDK5抑制在神经发育和功能中的保护机制值得进一步研究。
| [1] |
du Plessis AJ. Neurology of the newborn infant. Preface[J]. Clin Perinatol, 2009, 36(4): ⅺ-ⅹⅲ. (  0) 0) |
| [2] |
Volpe JJ. Brain injury in premature infants:a complex amalgam of destructive and developmental disturbances[J]. Lancet Neurol, 2009, 8(1): 110-124. DOI:10.1016/S1474-4422(08)70294-1 (  0) 0) |
| [3] |
Rocha-Ferreira E, Hristova M. Plasticity in the neonatal brain following hypoxic-ischaemic injury[J]. Neural Plast, 2016, 2016: 4901014. (  0) 0) |
| [4] |
Dallas DC, Guerrero A, Parker EA, et al. Current peptidomics:applications, purification, identification, quantification, and functional analysis[J]. Proteomics, 2015, 15(5-6): 1026-1038. DOI:10.1002/pmic.201400310 (  0) 0) |
| [5] |
Lone AM, Kim YG, Saghatelian A. Peptidomics methods for the identification of peptidase-substrate interactions[J]. Curr Opin Chem Biol, 2013, 17(1): 83-89. DOI:10.1016/j.cbpa.2012.10.038 (  0) 0) |
| [6] |
凤尔翠, 蒋犁. 瘦素对早产儿脑白质损伤模型大鼠远期空间记忆能力的影响[J]. 中国当代儿科杂志, 2017, 19(12): 1267-1271. (  0) 0) |
| [7] |
Feng EC, Jiang L. Effects of leptin on neurocognitive and motor functions in juvenile rats in a preterm brain damage model[J]. Mol Med Report, 2018, 18(4): 4095-4102. (  0) 0) |
| [8] |
Lin H, He L, Ma B. A combinatorial approach to the peptide feature matching problem for label-free quantification[J]. Bioinformatics, 2013, 29(14): 1768-1775. DOI:10.1093/bioinformatics/btt274 (  0) 0) |
| [9] |
Bortner JD Jr, Das A, Umstead TM, et al. Down-regulation of 14-3-3 isoforms and annexin A5 proteins in lung adenocarcinoma induced by the tobacco-specific nitrosamine NNK in the A/J mouse revealed by proteomic analysis[J]. J Proteome Res, 2009, 8(8): 4050-4061. DOI:10.1021/pr900406g (  0) 0) |
| [10] |
Hawasli AH, Benavides DR, Nguyen C, et al. Cyclin-dependent kinase 5 governs learning and synaptic plasticity via control of NMDAR degradation[J]. Nat Neurosci, 2007, 10(7): 880-886. DOI:10.1038/nn1914 (  0) 0) |
| [11] |
Mushtaq G, Greig NH, Anwar F, et al. Neuroprotective mechanisms mediated by CDK5 inhibition[J]. Curr Pharm Des, 2016, 22(5): 527-534. DOI:10.2174/1381612822666151124235028 (  0) 0) |
| [12] |
Shahinian H, Tholen S, Schilling O. Proteomic identification of protease cleavage sites:cell-biological and biomedical applications[J]. Expert Rev Proteomics, 2013, 10(5): 421-433. DOI:10.1586/14789450.2013.841547 (  0) 0) |
| [13] |
Ibi D, Nitta A, Ishige K, et al. Piccolo knockdown-induced impairments of spatial learning and long-term potentiation in the hippocampal CA1 region[J]. Neurochem Int, 2010, 56(1): 77-83. DOI:10.1016/j.neuint.2009.09.004 (  0) 0) |
| [14] |
Ho Kim J, Franck J, Kang T, et al. Proteome-wide characterization of signalling interactions in the hippocampal CA4/DG subfield of patients with Alzheimer's disease[J]. Sci Rep, 2015, 5: 11138. DOI:10.1038/srep11138 (  0) 0) |
| [15] |
Chapin SJ, Bulinski JC. Non-neuronal 210×10(3) Mr microtubule-associated protein (MAP4) contains a domain homologous to the microtubule-binding domains of neuronal MAP2 and tau[J]. J Cell Sci, 1991, 98(Pt 1): 27-36. (  0) 0) |
| [16] |
Villarroel-Campos D, Henríquez DR, Bodaleo FJ, et al. Rab35 functions in axon elongation are regulated by P53-related protein kinase in a mechanism that involves Rab35 protein degradation and the microtubule-associated protein 1b[J]. J Neurosci, 2016, 36(27): 7298-7313. DOI:10.1523/JNEUROSCI.4064-15.2016 (  0) 0) |
| [17] |
Jayachandran P, Olmo VN, Sanchez SP. Microtubule-associated protein 1b is required for shaping the neural tube[J]. Neural Dev, 2016, 11: 1. DOI:10.1186/s13064-015-0056-4 (  0) 0) |
| [18] |
Tortosa E, Galjart N, Avila J, et al. MAP1B regulates microtubule dynamics by sequestering EB1/3 in the cytosol of developing neuronal cells[J]. EMBO J, 2013, 32(9): 1293-1306. DOI:10.1038/emboj.2013.76 (  0) 0) |
| [19] |
Ketschek A, Jones S, Spillane M, et al. Nerve growth factor promotes reorganization of the axonal microtubule array at sites of axon collateral branching[J]. Dev Neurobiol, 2015, 75(12): 1441-1461. DOI:10.1002/dneu.22294 (  0) 0) |
| [20] |
Barnat M, Benassy MN, Vincensini L, et al. The GSK3-MAP1B pathway controls neurite branching and microtubule dynamics[J]. Mol Cell Neurosci, 2016, 72: 9-21. DOI:10.1016/j.mcn.2016.01.001 (  0) 0) |
| [21] |
Salatino-Oliveira A, Wagner F, Akutagava-Martins GC, et al. MAP1B and NOS1 genes are associated with working memory in youths with attention-deficit/hyperactivity disorder[J]. Eur Arch Psychiatry Clin Neurosci, 2016, 266(4): 359-366. DOI:10.1007/s00406-015-0626-9 (  0) 0) |
| [22] |
Liu YF, Sowell SM, Luo Y, et al. Autism and intellectual disability-associated KIRREL3 interacts with neuronal proteins MAP1B and MYO16 with potential roles in neurodevelopment[J]. PLoS One, 2015, 10(4): e0123106. DOI:10.1371/journal.pone.0123106 (  0) 0) |
| [23] |
Gomi F, Uchida Y. MAP1B 1-126 interacts with tubulin isoforms and induces neurite outgrowth and neuronal death of cultured cortical neurons[J]. Brain Res, 2012, 1433: 1-8. DOI:10.1016/j.brainres.2011.11.028 (  0) 0) |
| [24] |
Motavaf M, Soveizi M, Maleki M, et al. MYO15A splicing mutations in hearing loss:a review literature and report of a novel mutation[J]. Int J Pediatr Otorhinolaryngol, 2017, 96: 35-38. DOI:10.1016/j.ijporl.2017.03.008 (  0) 0) |
| [25] |
World Health Organization. Preterm birth[DB/OL]. (2018-02-19). https://www.who.int/en/news-room/fact-sheets/detail/preterm-birth.
(  0) 0) |
 2019, Vol. 21
2019, Vol. 21


