支气管哮喘(简称哮喘)是多种因素引起的一种慢性气道炎症和气道高反应性疾病,是一种异质性疾病,炎症反应贯穿疾病发生、发展全过程[1-2]。对哮喘患者的气道炎症情况的有效评估,在哮喘的诊断及管理中有着重要的作用。支气管镜下收集支气管肺泡灌洗液和支气管内膜活检的方法是检测评估气道炎症的金标准,但其有创性和较高的花费使其很难成为常用的检查方法。而呼出气一氧化氮(fractional exhaled nitric oxide, FeNO)是一种操作简单并且不会对患者造成创伤的能反映气道嗜酸性粒细胞性炎症的无创性标志物[3],近年来FeNO检测在临床工作中越发受到重视。已有研究[4]证明哮喘患者的FeNO水平与气道炎症具有良好的相关性,但其与患者的过敏体质及气道可逆性的相关性的研究并不多见,本文研究哮喘患者FeNO、血清特异性过敏原及肺功能舒张试验阳性率的相关性及意义,以探讨FeNO在哮喘诊断、治疗中的意义。
1 资料与方法 1.1 一般资料选取2016年9月至2018年8月于南方医科大学附属中山市博爱医院小儿呼吸内科门诊就诊或住院的哮喘患儿86例为研究对象,其中男52例,女34例,年龄6~14岁,均为初次诊断为轻度或中度哮喘并处于急性发作期,儿童哮喘诊断标准及分度标准参照《儿童支气管哮喘诊断与防治指南(2016年版)》[1];排除标准:(1)患有慢性肺疾病、支气管肺发育畸形、先天性心脏病、免疫缺陷病、神经退行性疾病;(2)试验前4周内有呼吸道感染;(3)重度、极重度哮喘急性发作患者。
1.2 FeNO的测定应用瑞典NIOX型Exhaled NO分析仪检测FeNO,患儿用口尽量吸气至肺总容量位(TLC),然后用口稳速呼出气体,呼气流速保持在0.05 L/s,压力保持在5~20 cm H2O以使软腭闭合,测定结果以ppb表示。FeNO的测量需在肺通气功能及支气管舒张试验之前完成。FeNO测定24 h前未应用静脉糖皮质激素,6 h前未吸入糖皮质激素,1 h内禁食水、避免剧烈运动及被动吸烟。
1.3 血清特异性过敏原检测采用瑞典法玛西亚UniCAP系统检测血清中总IgE及特异性IgE(sIgE),包括:屋尘螨、粉尘满、蟑螂、鸡蛋白、牛奶、小麦、花生、黄豆、螃蟹、虾共10项。按照血清sIgE检查结果分为IgE介导组(sIgE至少有1项血清浓度 > 0.35 kUA/L,n=61)和非IgE介导组(所有sIgE浓度均≤0.35 kUA/L,n=25)。IgE介导组中,男37例,女24例,平均年龄7.2±2.5岁;非IgE介导组中,男15例,女10例,平均年龄7.5±2.7岁。两组性别、年龄比较差异无统计学意义,具有可比性。
1.4 常规通气肺功能检测采用德国CareFusion公司的肺功能仪,参照2011年美国胸科协会标准,获得最大气流-容积曲线,得到第1秒末用力呼气量(force expiratory volumein 1 second, FEV1)、用力肺活量(forced vital capacity, FVC)、用力呼气流量(forced expiratory flow, FEF)、呼气峰流速(peak expiratory flow, PEF)值、用力呼出75%肺活量的瞬间流速(FEF75)、用力呼出50%肺活量的瞬间流速(FEF50)、用力呼出25%肺活量的瞬间流速(FEF25)和最大呼气中期流速(MMEF)。受检者试验前4 h内停用短效β2激动剂,12 h内停用支气管舒张剂,15 h内停用长效β2激动剂,48 h内停用抗组胺药物、色甘酸钠及皮质激素类药物。
1.5 支气管舒张试验无论常规通气肺功能结果是否异常,均行支气管舒张试验,使用德国百瑞空气压缩雾化泵雾化吸入β2受体激动剂,吸入药物结束15~20 min后,再次采用德国CareFusion公司的肺功能仪测定常规通气肺功能,计算用药前后肺功能各项指标的改善率。
1.6 统计学分析采用SPSS 20.0统计学软件对数据进行统计学分析。计量资料以均数±标准差(x±s)表示,两组间比较采用两样本t检验;多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。计数资料以百分率(%)表示,两组间比较采用χ2检验。两计量资料的相关性分析则采用Pearson相关系数分析。P < 0.05为差异有统计学意义。
2 结果 2.1 IgE介导组与非IgE介导组FeNO水平及肺功能指标比较IgE介导组的FeNO水平(36±11 pbb)明显高于非IgE介导组(26±13 pbb)(t=3.357,P < 0.05)。两组间基础肺功能各指标(FVC、FEV1、FEV1/FVC、PEF、FEF75、FEF50、FEF25、MMEF)的比较差异均无统计学意义(P > 0.05),见表 1。
| 表 1 两组基础肺功能指标比较 (x±s) |
|
|
IgE介导组中,1种过敏原阳性者32例,2种过敏原阳性者14例,3种过敏原阳性者9例,4种及以上过敏原阳性者6例,FeNO值随着血清特异性过敏原检测中变应原阳性种类的增加而增加(P < 0.05),见表 2。
| 表 2 不同过敏程度哮喘患儿FeNO水平比较 (x±s,pbb) |
|
|
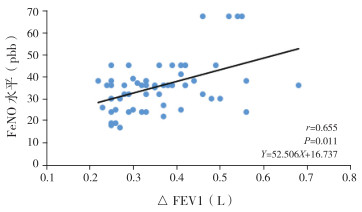
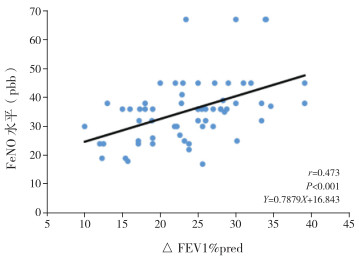
IgE介导组FeNO与支气管舒张试验用药前后FEV1的改变量(△FEV1)和改善率(△FEV1%pred)呈正相关(分别r=0.655、0.473,P < 0.05)(图 1~2)。IgE介导组FeNO与FEV1、FEV1占预计值的百分比(FEV1%pred)、PEF、用药前后PEF的改变量(△PEF)和改善率(△PEF%pred)、PEF占预计值的百分比(PEF%pred)均无相关性(P > 0.05)。非IgE介导组FeNO与肺功能各项指标均无相关性(P > 0.05)。见表 3。
|
图 1 IgE介导组FeNO水平与△FEV1的相关性分析图 |
|
图 2 IgE介导组FeNO水平与△FEV1%pred的相关性分析图 |
| 表 3 非IgE介导组及IgE介导组患儿FeNO水平与肺功能各指标的相关性分析结果 |
|
|
2010年在全国范围内40万儿童的调查显示,儿童哮喘患病率达3.02%[5]。而全球哮喘防治创议(GINA)[6]及现行我国儿童哮喘防治指南[1]指出哮喘规范化管理和治疗的长期目标是获得良好的症状控制,降低未来急性发作及气道受限持续存在的风险。而检测可逆的呼气气流受限的方法主要是通过支气管激发或舒张试验。由于潮气呼吸肺功能及脉冲震动肺功能的支气管激发及舒张试验的应用价值目前仍处于研究阶段,而得到广泛公认的常规通气肺功能的激发试验及舒张试验只限于主动配合程度较好的5岁以上儿童,且激发试验有一定的危险性,限制了其在各地医院的推广应用,因此探讨采用其他安全有效的检测手段来评估气道可逆性尤为重要。
FeNO是一种新型、无创、检测方便的生物标志物,主要与过敏性气道炎症相关,能明确哮喘的气道炎症类型,反映气道炎症严重程度,有助于哮喘的诊断、评估和治疗[7-9],其在线模式适用于4岁以上能配合的儿童,离线模式适用于4岁以下配合不佳的儿童及婴幼儿,故无适用年龄的限制。基于以上优点,近年来,FeNO检测已逐渐在临床上推广应用。但其对哮喘患儿气道可逆性的评价及临床应用价值尚存在争议。早已证实,FeNO作为评价哮喘嗜酸性粒细胞型气道炎症的指标,与诱导痰嗜酸性粒细胞计数、外周血嗜酸性粒细胞、总IgE等各项嗜酸性粒细胞性炎症指标存在良好的相关性[10]。但众所周知,哮喘气道炎症有不同的表型,包括嗜酸性粒细胞型、中性粒细胞型、混合型及寡粒细胞型,只有大约50%~60%的哮喘属于嗜酸性粒细胞型,而FeNO主要反映嗜酸性粒细胞型气道炎症[11]。故本研究按照血清特异性过敏原检查结果分为IgE介导组和非IgE介导组,分别探讨FeNO水平在哮喘患儿的气道可逆性评价及病情评估方面的应用价值。
有研究证实,血清总IgE参与过敏性疾病的发生机制,过敏原激活辅助性T细胞后会产生一系列炎症因子,当过敏原再次进入体内时,与IgE结合并迅速释放大量炎性因子,就会引起平滑肌收缩、黏液分泌增加、血管通透性增加,从而导致喘息的发生,这是IgE介导的哮喘发生的重要机制[12]。本研究发现,IgE介导组FeNO值明显高于非IgE介导组,提示IgE介导的哮喘患儿气道炎症反应水平较高。研究也进一步显示,FeNO水平随着血清特异性过敏原检测中变应原数量的增加而增加,说明FeNO的水平与过敏的严重程度呈正相关。这与国内外学者的研究结果一致[10, 13-14]。本研究结果提示,可以将FeNO作为鉴别诊断IgE介导的哮喘和非IgE介导的哮喘的辅助指标,Chawes等[15]学者还研究发现,在哮喘患者中检测FeNO和sIgE水平反映哮喘急性发作炎症程度,得出FeNO和sIgE水平与疾病严重程度呈正相关。
支气管舒张试验可以对哮喘气流受限的相关可逆性进行反映,其在支气管哮喘鉴别中应用,具有较高的特异度,本研究发现:IgE介导组FeNO与支气管舒张试验△FEV1和△FEV1%pred呈正相关,而与FEV1、FEV1%pred、PEF、△PEF、PEF%pred和△PEF%pred无相关性。与国内学者刘欣等[16]研究结果类似,但国外研究却显示[17-18]哮喘患儿(不论IgE介导还是非IgE介导)FeNO水平与舒张后FEV1改善率均存在相关性。分析原因:(1)非IgE介导的哮喘患儿,其气道类型为非嗜酸性粒细胞型炎症,此类患儿气道FeNO水平相对较低,故导致出现其与气道可逆性无相关性的结果;(2)不排除与患者种族、人群、环境的不同可能导致结果的差异。本研究表明,FeNO检查应考虑到患者的IgE介导的过敏情况,对于IgE介导的哮喘患者,FeNO与支气管舒张试验△FEV1和△FEV1%pred存在明显的正相关,可作为评估哮喘病情、预测气道可逆性的一个参考指标。而对于非IgE介导的哮喘患儿,FeNO水平则不能有效反映气道可逆性水平,两者需区分对待。
本研究不足之处在于收集的病例数仍较少,故本研究结果仍需更大样本量进一步验证,还需进一步跟踪随访,以期探讨FeNO在不同表型哮喘中的诊断、诊疗及预后价值。
| [1] |
中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童支气管哮喘诊断与防治指南(2016年版)[J]. 中华儿科杂志, 2016, 54(3): 167-178. DOI:10.3760/cma.j.issn.0578-1310.2016.03.003 (  0) 0) |
| [2] |
Fleming L, Bush A. Fraction of exhaled nitric oxide measurements and asthma control:are the numbers starting to add up?[J]. J Investig Allergol Clin Immunol, 2015, 135(3): 689-690. DOI:10.1016/j.jaci.2014.12.1920 (  0) 0) |
| [3] |
Lee JW, Shim JY, Kwon JW, et al. Exhaled nitric oxide as a better diagnostic indicator for evaluating wheeze and airway hyperresponsiveness in preschool children[J]. J Asthma, 2015, 52(10): 1054-1059. DOI:10.3109/02770903.2015.1046078 (  0) 0) |
| [4] |
Lex C, Ferreira F, Zacharasiewicz A, et al. Airway eosinophilia in children with severe asthma:predictive values of noninvasive tests[J]. Am J Respir Crit Care Med, 2006, 174(12): 1286-1291. DOI:10.1164/rccm.200603-352OC (  0) 0) |
| [5] |
全国儿科哮喘协作组, 中国疾病预防控制中心环境与健康相关产品安全所. 第三次中国城市儿童哮喘流行病学调查[J]. 中华儿科杂志, 2013, 51(10): 729-735. DOI:10.3760/cma.j.issn.0578-1310.2013.10.003 (  0) 0) |
| [6] |
Global Initiative for Asthma. Global strategy for asthma management and prevention[EB/OL]. (2019-11-12). https://ginasthma.org/wp-content/uploads/2019/06/GINA-2019-main-report-June-2019-wms.pdf.
(  0) 0) |
| [7] |
曾靖, 胡琦, 钟世民, 等. 学龄前儿童呼出一氧化氮及气道高反应性与哮喘控制的相关性研究[J]. 重庆医学, 2017, 46(25): 3529-3531. DOI:10.3969/j.issn.1671-8348.2017.25.025 (  0) 0) |
| [8] |
顾剑华, 金晓群, 徐艳娜, 等. 呼出气一氧化氮检测在儿童哮喘管理中的价值[J]. 中国医药, 2015, 10(6): 812-815. DOI:10.3760/cma.j.issn.1673-4777.2015.06.013 (  0) 0) |
| [9] |
朱惠源, 吴景硕, 张钟, 等. 慢性喘息型支气管炎与支气管哮喘患者的呼出气一氧化氮检测对比研究[J]. 中国现代医学杂志, 2016, 26(7): 44-47. DOI:10.3969/j.issn.1005-8982.2016.07.010 (  0) 0) |
| [10] |
Choi BS, Kim KW, Lee YJ, et al. Exhaled nitric oxide is associated with allergic inflammation in children[J]. J Korean Med Sci, 2011, 26(10): 1265-1269. DOI:10.3346/jkms.2011.26.10.1265 (  0) 0) |
| [11] |
中国医师协会呼吸医师分会. 无创气道炎症评估支气管哮喘的临床应用中国专家共识[J]. 中华结核和呼吸杂志, 2015, 38(5): 329-341. DOI:10.3760/cma.j.issn.1001-0939.2015.05.004 (  0) 0) |
| [12] |
王修海, 赵炜, 刘世国, 等. 白细胞介素4和13基因多态性对支气管哮喘患者易感性及血清总IgE水平的影响[J]. 中华结核和呼吸杂志, 2009, 32(3): 161-164. DOI:10.3760/cma.j.issn.1001-0939.2009.03.001 (  0) 0) |
| [13] |
阿选德, 关英, 马明铭. 支气管哮喘患者呼出气一氧化氮与过敏原sIgE的相关性分析[J]. 国际呼吸杂志, 2019, 39(7): 504-507. DOI:10.3760/cma.j.issn.1673-436X.2019.07.005 (  0) 0) |
| [14] |
Bukhari SI, Pattnaik B, Rayees S, et al. Safranal of Crocus sativus L. inhibits inducible nitric oxide synthase and attenuates asthma in a mouse model of asthma[J]. Phytother Res, 2015, 29(4): 617-627. (  0) 0) |
| [15] |
Chawes BL, Bischoff AL, Kreiner-Møller E, et al. DENND1B gene variants associate with elevated exhaled nitric oxide in healthy high-risk neonates[J]. Pediatr Pulmonol, 2015, 50(2): 109-117. DOI:10.1002/ppul.22958 (  0) 0) |
| [16] |
刘欣, 尚云晓, 冯雍, 等. 5~14岁哮喘患儿呼出气一氧化氮检测与气道可逆性相关性研究[J]. 中国实用儿科杂志, 2018, 33(3): 224-228. (  0) 0) |
| [17] |
Silvestri M, Sabatini F, Sale R, et al. Correlations between exhaled nitric oxide levels, blood eosinophilia, and airway obstruction reversibility in childhood asthma are detectable only in atopic individuals[J]. Pediatr Pulmonol, 2003, 35(5): 358-363. DOI:10.1002/ppul.10264 (  0) 0) |
| [18] |
Ciprandi G, Tosca MA, Capasso M. High exhaled nitric oxide levels may predict bronchial reversibility in allergic children with asthma or rhinitis[J]. J Asthma, 2013, 50(1): 33-38. (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


