胆道闭锁(biliary atresia, BA)是小于3月龄婴儿胆汁淤积症的重要原因之一,表现为肝内外胆管炎症进行性加重,逐步发展为肝硬化及肝衰竭,患儿不经治疗多在1~3岁左右死亡,为儿童期肝移植的常见原因[1-3]。目前诊断BA的金标准为剖腹探查或腹腔镜术中胆管造影,由于尚无统一的标准化术前检查流程,一些诊断困难的非BA患儿不得不接受剖腹探查或腹腔镜手术以明确诊断。而且由于上述检查为有创性操作,在疾病早期家长接受度不高,导致诊断及治疗的延迟,影响患儿预后。临床需要简便有效的无创性检查指标为BA的早期诊断提供线索。多项研究认为,γ-谷氨酰转肽酶(gamma-glutamyl transpeptidase, GGT)显著升高对BA的鉴别诊断具有重要作用[4-9],但其受到性别、年龄、喂养情况等因素的影响,单独诊断BA的可靠性和准确度仍有待于进一步研究。有研究显示多种指标联合诊断BA可具有更好的诊断效能[10]。Dong等[11]发现GGT、直接胆红素(direct bilirubin, DB)、碱性磷酸酶(alkaline phosphatase, ALP)等指标在BA组显著升高,建立了包括GGT、DB、ALP、性别、体重等5个因素在内的BA评分模型;Liu等[8]也建立了BA患儿的评分模型,选用血清总胆红素(total bilirubin, TB)、总胆汁酸(total bile acid, TBA)、DB、GGT等10项指标。但上述评分模型尚需进行大样本验证,且涉及指标较多,临床应用存在一定局限性。本研究对667例胆汁淤积症患儿TB、DB、GGT、TBA、丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天门冬氨酸氨基转移酶(aspertate aminotransferase, AST)等指标进行分析,旨在探讨上述生化指标的联合诊断对小于3月龄婴儿胆汁淤积症中BA的诊断价值。
1 资料与方法 1.1 研究对象选取2010年7月至2018年12月于河北省儿童医院住院治疗的胆汁淤积症患儿667例为研究对象。其中男406例(60.9%),女261例(39.1%),年龄28~90 d,中位年龄54 d。胆汁淤积定义为:TB < 5 mg/L时,DB > 1 mg/L;或TB > 5 mg/L时,DB与TB的比值> 20%[12]。
1.2 病因分析患儿入院后通过各项检查进行病因分析。(1)感染因素:甲肝病毒、乙肝病毒、丙肝病毒、单纯疱疹病毒-Ⅰ型及Ⅱ型、风疹病毒、人类免疫缺陷病毒抗体检测;梅毒螺旋体、弓形虫抗体检测;巨细胞病毒、EB病毒抗体及核酸检测,血、尿、粪便细菌培养等。(2)实验室及影像学检查:包括血氨、乳酸、甲胎蛋白、铁蛋白、血脂、凝血功能、甲状腺功能、自身抗体、免疫球蛋白、血尿串联质谱分析、腹部超声等检查,了解有无遗传代谢性疾病、自身免疫性疾病、血液肿瘤性疾病等。(3)肝穿刺活检:经家长知情同意后,部分患儿行经皮肝穿刺活检术,病理组织送检。(4)骨髓穿刺:考虑血液系统疾病患儿行骨髓穿刺检查。(5)基因检测:病因不明确患儿进行全外显子检测。(6)怀疑BA的患儿进行腹腔镜或剖腹探查手术,术中胆道造影明确诊断。本研究方案经河北省儿童医院伦理委员会审批同意,并获得患儿监护人知情同意。
1.3 分组根据病因将患儿分为BA组和肝内胆汁淤积组。BA组患儿经腹腔镜探查或剖腹探查,术中胆管造影明确诊断,如接受Kasai手术,术后病理组织镜下观察再次确诊。肝内胆汁淤积组患儿存在胆汁淤积,经上述检查明确病因,或未明确病因,但经治疗病情好转,随访中胆红素水平恢复正常。
1.4 数据收集与分析收集患儿未经治疗的首次外周静脉血生化结果,包括TB、DB、TBA、GGT、ALT、AST,评价血生化指标对BA的诊断价值。
1.5 统计学分析采用Stata 10.0统计软件对数据进行统计学分析。计数资料以百分比表示,组间比较采用χ2检验。符合正态分布计量资料以均数±标准差(x±s)表示,两组间比较采用两独立样本t检验;非正态分布计量资料以中位数(四分位间距)[M(P25,P75)]表示,两组间比较采用Wilcoxon秩和检验。P < 0.05为差异有统计学意义。对差异有统计学意义的指标进行受试者工作特征曲线(receiver operator characteristic, ROC)分析,计算ROC曲线下面积(AUC)及最佳诊断界值。
2 结果 2.1 一般情况BA组234例,其中男137例(58.5%),女97(41.5%)例,中位年龄58 d,中位发病年龄9 d;胆汁淤积组433例,其中男269例(62.1%),女164例(37.9%),中位年龄52 d,中位发病年龄13 d。胆汁淤积组患儿病因包括感染172例(39.7%),遗传代谢性疾病61例(14.1%),肠外营养相关胆汁淤积症18例(4.2%),血液系统疾病3例(0.7%),179例(41.3%)患儿病因不明。两组间性别构成及年龄比较差异无统计学意义(P > 0.05)。BA组患儿发病年龄早于胆汁淤积组(P < 0.05)。见表 1。
| 表 1 两组一般资料及生化指标比较 [例或M(P25,P75)] |
|
|
BA组TB、DB、TBA及GGT水平均显著高于胆汁淤积组(P < 0.05),ALT和AST水平虽高于胆汁淤积组,但差异无统计学意义(P > 0.05),见表 1。
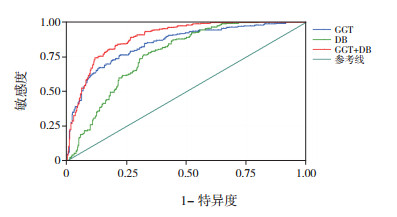
2.3 ROC分析分别对GGT、DB、TBA、GGT+DB、GGT+ TBA、DB+TBA、GGT+DB+TBA进行ROC分析,结果显示:GGT+DB的AUC最大,为0.892(95%CI:0.868~0.916)(表 2)。当GGT取值为324.0 U/L,DB取值为115.1 μmol/L时,GGT与DB联合诊断BA的敏感度和特异度分别为79.8%、83.2%,见表 3,图 1。
| 表 2 各生化指标ROC分析 |
|
|
| 表 3 GGT与DB联合对BA的诊断价值 |
|
|
|
图 1 GGT、DB及GGT与DB联合诊断BA的ROC分析 |
BA以进行性肝内外胆管炎症和梗阻为特征,欧美地区发病率约为1/12 000~15 000[1, 13],我国台湾地区约为1.51/10 000[14],目前有效的治疗方法为Kasai手术。Serinet等[15]对695例接受手术治疗的BA患儿进行分析,从30~90日龄,每隔15 d分一组,发现患儿长期生存率呈逐步下降趋势。小于60日龄患儿接受手术治疗,重建胆汁流在70%~80%,而90~120日龄患儿接受手术,仅25%重建胆汁流。手术时机为影响患儿预后的重要因素之一。及早进行诊断,对于改善BA患儿预后具有重要意义。本研究分析了667例胆汁淤积症患儿的上述指标,发现GGT联合DB对BA具有良好的诊断价值。
本研究中,两组患儿间TB水平比较差异有统计学意义,但TB由DB与间接胆红素构成,间接胆红素水平的变化同样可引起TB水平的显著波动,如溶血、新生儿高胆红素血症等情况均可导致TB水平的显著波动,其变化影响因素多,故本研究中未对其诊断BA进行具体分析。而DB升高是提示胆汁淤积的重要指标,血清DB升高对于及早发现BA具有重要意义。北美儿童胃肠肝病和营养学会将DB升高大于17.1 μmol/L定义为胆汁淤积,建议对持续黄疸超过2周的婴儿进行DB或结合胆红素检测,以了解患儿是否需要进一步排查,及早发现BA[16]。Harpavat等[17-18]对9 137例新生儿进行筛查,发现所有BA患儿的DB值均高于参考范围,敏感度为100%;在非BA组9 102名新生儿中,8 936例DB值在参考范围以内,特异度为98.2%,证实DB检测对筛查BA有较高的敏感度和特异度,建议BA的筛查指标为DB,无论TB水平高低及DB与TB比值情况。
有研究发现,GGT为胆汁淤积的敏感指标,GGT显著升高对BA的鉴别诊断具有重要作用[4-5, 7, 9],Tang等[19]发现GGT高于300 U/L时,诊断BA的敏感度为38%,特异度为98%。El-Guindi等[20]报道GGT > 286 U/L时,诊断BA的灵敏度和特异度分别为76.7%和80.0%。本研究与以往研究一致,BA组GGT中位值为503 U/L,显著高于胆汁淤积组中位值(147 U/L)。ROC结果显示,GGT的AUC为0.847,95%CI为0.816~0.878,高于TBA、DB的AUC,具有较好的诊断价值。
但BA临床表现多样,生化指标改变多样,单一指标的改变不能完全反映出病变情况,多个指标联合诊断可提高诊断价值。本研究中,GGT+DB联合的AUC为0.892,在多种指标联合的AUC中最大,具有良好的诊断效能。当DB为115.1 μmol/L,GGT为324.0 U/L时,诊断BA的敏感度和特异度分别为79.8%、83.2%。值得注意的是,Cabrera-Abreu等[21]发现,GGT水平因年龄而波动,正常足月新生儿出生时GGT可达成人参考值6~7倍,在7月龄时GGT才恢复到成人水平。Chen等[4]对1 338例BA患儿依据年龄进行分组,发现不同月龄组GGT的中位数也不相同,31~60日龄患儿GGT中位值为567 U/L,61~90日龄患儿GGT为779.5 U/L,91~120日龄患儿GGT为923 U/L,大于120日龄BA患儿GGT水平降低,为583 U/L,其AUC也小于3月龄内婴儿。本研究样本量仍需进一步扩大,分析不同年龄组胆汁淤积患儿GGT、DB水平及其诊断价值。
TBA主要在肝脏内合成,并在代谢过程中由肝脏从门静脉摄取,为肝细胞损伤的敏感指标之一,其升高程度与胆汁淤积并不完全平行。本研究中TBA的AUC为0.601,其与GGT、DB三者联合的AUC为0.891,低于GGT与DB两者联合的AUC。研究中ALT、AST在两组间的差异无统计学意义,与其他研究一致[4-6]。ALT主要存在于肝脏细胞质内,AST主要存在于细胞质及线粒体当中,两者升高多反映肝细胞损伤,提示在BA早期,患儿肝细胞损伤与其他胆汁淤积症所引起肝细胞损伤程度差别不大。
本研究不足之处为回顾性分析,部分数据不完善,导致不能纳入更多的无创性检查项目进行统计分析,尚需进一步扩大样本量进行深入研究;此外,目前BA的筛查手段之一为粪便比色卡的应用,本研究未纳入大便颜色改变这一指标,原因为患儿年龄小,浅色大便易于和深色尿液混在一起,家属对被黄色尿液污染的大便颜色识别能力不足,且大便颜色的判断易受主观因素影响,出现假阴性结果。但粪便比色卡的应用作为简便的筛查方法之一,值得推广。
| [1] |
Schreiber RA, Barker CC, Roberts EA, et al. Biliary atresia:the Canadian experience[J]. J Pediatr, 2007, 151(6): 659-665. DOI:10.1016/j.jpeds.2007.05.051 (  0) 0) |
| [2] |
Superina R. Biliary atresia and liver transplantation:results and thoughts for primary liver transplantation in select patients[J]. Pediatr Surg Int, 2017, 33(12): 1297-1304. DOI:10.1007/s00383-017-4174-4 (  0) 0) |
| [3] |
Kasahara M, Umeshita K, Sakamoto S, et al. Liver transplantation for biliary atresia:a systematic review[J]. Pediatr Surg Int, 2017, 33(12): 1289-1295. DOI:10.1007/s00383-017-4173-5 (  0) 0) |
| [4] |
Chen X, Dong R, Shen Z, et al. Value of gamma-glutamyl transpeptidase for diagnosis of biliary atresia by correlation with age[J]. J Pediatr Gastroenterol Nutr, 2016, 63(3): 370-373. DOI:10.1097/MPG.0000000000001168 (  0) 0) |
| [5] |
Hayashida M, Matsuura T, Kinoshita Y, et al. Parameters that help to differentiate biliary atresia from other diseases[J]. Pediatr Int, 2017, 59(12): 1261-1265. DOI:10.1111/ped.13392 (  0) 0) |
| [6] |
Sun S, Chen G, Zheng S, et al. Analysis of clinical parameters that contribute to the misdiagnosis of biliary atresia[J]. J Pediatr Surg, 2013, 48(7): 1490-1494. DOI:10.1016/j.jpedsurg.2013.02.034 (  0) 0) |
| [7] |
Dong C, Zhu HY, Chen YC, et al. Clinical assessment of differential diagnostic methods in infants with cholestasis due to biliary atresia or non-biliary atresia[J]. Curr Med Sci, 2018, 38(1): 137-143. DOI:10.1007/s11596-018-1857-6 (  0) 0) |
| [8] |
Liu X, Peng X, Huang Y, et al. Design and validation of a noninvasive diagnostic criteria for biliary atresia in infants based on the STROBE compliant[J]. Medicine (Baltimore), 2019, 98(6): e13837. DOI:10.1097/MD.0000000000013837 (  0) 0) |
| [9] |
Ağın M, Tümgör G, Alkan M, et al. Clues to the diagnosis of biliary atresia in neonatal cholestasis[J]. Turk J Gastroenterol, 2016, 27(1): 37-41. DOI:10.5152/tjg.2015.150379 (  0) 0) |
| [10] |
Nakamura H, Yamataka A. Non-invasive and accurate diagnostic system for biliary atresia[J]. EBioMedicine, 2018, 36: 16-17. DOI:10.1016/j.ebiom.2018.09.032 (  0) 0) |
| [11] |
Dong R, Jiang J, Zhang S, et al. Development and validation of novel diagnostic models for biliary atresia in a large cohort of Chinese patients[J]. EBioMedicine, 2018, 34: 223-230. DOI:10.1016/j.ebiom.2018.07.025 (  0) 0) |
| [12] |
Moyer V, Freese DK, Whitington PF, et al. Guideline for the evaluation of cholestatic jaundice in infants:recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition[J]. J Pediatr Gastroenterol Nutr, 2004, 39(2): 115-128. DOI:10.1097/00005176-200408000-00001 (  0) 0) |
| [13] |
Chardot C, Buet C, Serinet MO, et al. Improving outcomes of biliary atresia:french national series 1986-2009[J]. J Hepatol, 2013, 58(6): 1209-1217. DOI:10.1016/j.jhep.2013.01.040 (  0) 0) |
| [14] |
Chiu CY, Chen PH, Chan CF, et al. Biliary atresia in preterm infants in Taiwan:a nationwide survey[J]. J Pediatr, 2013, 163(1): 100-103. DOI:10.1016/j.jpeds.2012.12.085 (  0) 0) |
| [15] |
Serinet MO, Wildhaber BE, Broué P, et al. Impact of age at Kasai operation on its results in late childhood and adolescence:a rational basis for biliary atresia screening[J]. Pediatrics, 2009, 123(5): 1280-1286. DOI:10.1542/peds.2008-1949 (  0) 0) |
| [16] |
Fawaz R, Baumann U, Ekong U, et al. Guideline for the evaluation of cholestatic jaundice in infants:joint recommendations of the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition and the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition[J]. J Pediatr Gastroenterol Nutr, 2017, 64(1): 154-168. DOI:10.1097/MPG.0000000000001334 (  0) 0) |
| [17] |
Harpavat S, Finegold MJ, Karpen SJ. Patients with biliary atresia have elevated direct/conjugated bilirubin levels shortly after birth[J]. Pediatrics, 2011, 128(6): e1428-e1433. DOI:10.1542/peds.2011-1869 (  0) 0) |
| [18] |
Harpavat S, Ramraj R, Finegold MJ, et al. Newborn direct or conjugated bilirubin measurements as a potential screen for biliary atresia[J]. J Pediatr Gastroenterol Nutr, 2016, 62(6): 799-803. DOI:10.1097/MPG.0000000000001097 (  0) 0) |
| [19] |
Tang KS, Huang LT, Huang YH, et al. Gamma-glutamyl transferase in the diagnosis of biliary atresia[J]. Acta Paediatr Taiwan, 2007, 48(4): 196-200. (  0) 0) |
| [20] |
El-Guindi MA, Sira MM, Sira AM, et al. Design and validation of a diagnostic score for biliary atresia[J]. J Hepatol, 2014, 61(1): 116-123. DOI:10.1016/j.jhep.2014.03.016 (  0) 0) |
| [21] |
Cabrera-Abreu JC, Green A. Gamma-glutamyltransferase:value of its measurement in paediatrics[J]. Ann Clin Biochem, 2002, 39(Pt 1): 22-25. (  0) 0) |
 2019, Vol. 21
2019, Vol. 21

