2. 国家儿童医学中心(北京)首都医科大学附属北京儿童医院/儿科学重点学科内分泌遗传代谢中心, 北京 100045
Floating-Harbor综合征(Floating-Harbor syndrome, FHS),也称Pelletier-Leisti综合征,是一种罕见的常染色体显性遗传病,主要由编码SNF-2相关CREBBP激活蛋白的SRCAP基因突变引起,临床可表现为身材矮小、骨龄延迟、语言发育迟缓、智力障碍及特殊面部特征[1]。其发病率极低。近期,我院收治了1例FHS患儿,经基因检测,发现患儿SRCAP基因存在c.7330C > T(p.R2444X)杂合突变。本文对该病例进行了总结、分析,以期提高临床医师对本病的认识。
1 临床资料 1.1 一般情况患儿,男,11岁7个月,因发现身材矮小8年余就诊。患儿3岁时,家长发现患儿身高比同年龄、同性别儿童矮,具体生长速率不详,平素食欲差,食量小,应用“生长激素”治疗1年8个月,因效果欠佳自行停药。随年龄增长,患儿身材矮小呈进行性加重。患儿系第2胎第2产,足月剖宫产出生,出生体重2.8 kg,出生身长48 cm。生后母乳喂养,6月龄添加辅食。智力及体格发育均落后于同龄儿。按计划预防接种。现上小学五年级,学习成绩较差,平时较沉默,与人交流少。父母亲非近亲婚配,否认家族遗传病史。父亲目前45岁,身高172 cm;母亲47岁,身高150 cm;患儿姐姐,21岁,身高154 cm,精神、智力无异常。
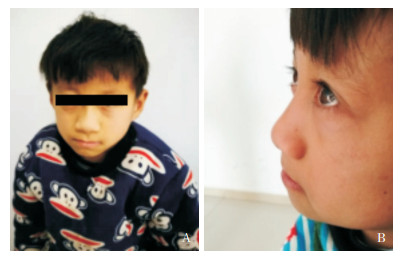
体格检查:身高:119 cm(-4.2 SD),体重18.5 kg。上部量59 cm,下部量60 cm,上部量/下部量之比=0.98。体格发育落后,营养一般,体型匀称。神志清楚,精神反应好。全身皮肤未见皮疹,无牛奶咖啡斑及色素脱失斑。全身浅表淋巴结无肿大。三角脸,深眼窝,睫毛长。鼻梁长,鼻梁高宽。鼻小柱悬垂(鼻小柱延伸至鼻基部以下)。人中短。嘴唇薄(上唇尤甚)。耳位正常,后发际线不低。患儿面部特征见图 1。甲状腺无肿大。心肺腹及神经系统体查未见异常。四肢左右基本对称,脊柱无明显侧弯。手指弯曲(中指、无名指和小指),手指短,小指尤甚。未见异常掌纹。男童外生殖器,阴茎长约4 cm,直径约1 cm,双侧睾丸容积约3 mL。
|
图 1 患儿面部特征 A:正面,三角脸,鼻梁宽,人中短,嘴唇薄。B:侧面,眼窝深凹,睫毛长。 |
血常规、尿常规检查正常。血电解质、肝肾功能、甲状腺功能五项检查均正常。行精氨酸生长激素激发试验,生长激素峰值为12.21 ng/mL。皮质醇、促肾上腺皮质激素(8am)正常。胰岛素样生长因子110 ng/mL(11岁男孩正常范围:38~318 ng/mL)。糖化血红蛋白正常。25-羟基维生素D 29 μg/L,略低于正常。微量元素测定均正常。
1.3 影像学检查左腕关节X线片:左侧腕骨骨龄相当于5岁左右,左侧第5指末节指骨近端骨骺密度增高,中节指形态不规则。垂体磁共振平扫未见异常改变。腹部彩超:肝胆胰脾肾未见明显异常,腹腔未见增大淋巴结,腹腔未见包块及积液。肾上腺及双肾彩超:双侧肾上腺区未见异常占位性回声及增大的肾上腺。阴囊腹股沟彩超:双侧睾丸较同龄儿偏小。心脏超声提示二叶主动脉瓣、主动脉瓣反流(少量)。
1.4 遗传学检查(1)测序方法:经患儿家属知情同意后,分别抽取患儿及父母亲EDTA抗凝血3 mL,进行全外显子测序分析。
全外显子基因检测技术路线:从受检者外周血中提取基因DNA,构建基因组文库,经过生物素标记的探针(其中全外显子探针为P039-Exome)与文库DNA在一定条件下进行杂交,用链霉亲和素修饰的磁珠共价结合生物素标记的探针,从而抓取目的基因,最后用磁力架吸附携带目的基因的磁珠,洗脱纯化,进行富集。富集的目的基因通过NextSeq 500高通量测序仪(Illumina)进行测序。测序数据运用BWA软件与人类基因组hg19参考序列进行对比,并将对比文件进行排序、过滤,局部多序列对比等,消除假阳性。对明确或可能与受检者临床表型相关的基因变异采用Sanger测序进行验证。上述检测由北京迈基诺基因科技股份有限公司完成。
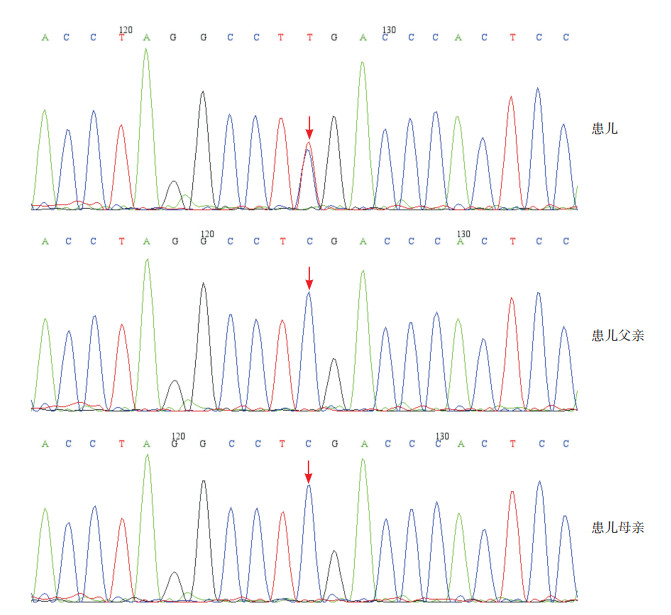
(2)基因测序结果:患儿SRCAP基因第34外显子区发现了1个c.7330C > T杂合突变(编码区第7330号核苷酸由胞嘧啶变异为胸腺嘧啶),导致氨基酸改变p.R2444X(编码产物第2444号氨基酸精氨酸缺失),该变异为零效变异(无义突变),可能导致基因功能丧失,在正常人群数据库中的频率为零,为低频变异。生物信息学蛋白功能预测软件SIFT、PolyPhen_2、REVEL分别预测为未知、未知、未知;已报道与FHS相关。经家系验证分析,受检人的父母该位点均无变异,提示该突变为自发突变。对于所有检查及治疗,患儿监护人均知情同意并签署知情同意书,并经保定市儿童医院医学伦理委员会批准。患儿及其父母基因测序结果见图 2。
|
图 2 基因测序结果 患儿携带SRCAP基因c.7330C > T突变,箭头所示为突变位点。患儿父母该位点基因型均正常。 |
FHS(OMIM136140)是一种极为罕见的常染色体显性遗传病,以身材矮小、骨骼发育迟缓、面部形态独特和语言表达障碍为特征[1]。本病主要由编码SNF-2相关的CREBBP激活蛋白基因,即SRCAP基因突变引起[2]。迄今为止,已报道了大约50多例SRCAP外显子34突变和2例SRCAP外显子33突变[3-4]。SRCAP基因位于染色体16p11.2,共由34个外显子组成,编码一种SNF-2相关的染色质重组ATP酶,即SRCAP蛋白,该蛋白在人类细胞核中含量丰富,可激活参与调解细胞生长和分裂的CREBBP,而CREBBP又在调节细胞生长、细胞分裂、DNA修复、分化、细胞死亡和肿瘤抑制等方面起着关键作用[4-6]。
FHS主要临床特征包括矮身材、骨龄延迟、骨骼畸形、语言迟缓、面部异常等。典型的面部特征为三角脸、深眼窝、长睫毛、高鼻梁、宽嘴巴、薄嘴唇[7],部分可有行为异常,如多动、注意力缺陷、强迫症。其他症状包括骨骼异常、先天性心脏病、胃肠道疾患、泌尿生殖系统异常、牙齿异常、耳眼异常、癫痫发作和甲状腺功能减退等[7]。本研究中,患儿存在严重矮身材(-4.2 SD),骨龄明显延迟(生活年龄11岁7个月,骨龄5岁左右),智力缺陷,语言发育迟缓,三角形脸,嘴唇薄,尤上嘴唇明显,深眼窝、长睫毛,同时手指畸形,心脏超声异常,与Lacombe等[7]报道一致,故临床诊断为FSH。
迄今报道的SRCAP基因突变主要包括无义突变、移码突变等。SRCAP基因突变可产生一个C-端截断的SRCAP蛋白,该蛋白因失去了其功能域,导致显性负效应[4],从而导致FHS的发生。本研究中,在患儿SRCAP基因第34号外显子区发现了一个c.7330C > T突变,此前已有多次文献报道。在Hood等[5]报道的13例患者中,6例携带该突变,均为新生突变;在Nikkel等[8]报道的52例患者中,24例患者携带该突变,亦为新生突变,提示该突变为FHS的热点突变。
FHS患儿需早期进行干预计划、特殊教育和职业培训,以解决生长发育障碍,由行为专家或心理学家进行行为管理,并根据需要考虑药物治疗。如果出现了以下问题进行标准化治疗:屈光不正和斜视、听力丧失、癫痫、肾脏疾病、隐睾症、骨科并发症、眼科疾病、牙科疾病;每年一次进行眼科评估、听力筛查(如果有多次中耳炎发作可以提高筛查频率)、血压监测和肾功能监测。Singh等[9]报道1名14岁FHS男童患有少齿症和强直性舌症,其治疗与其特征有关,主要包括龋齿的修复、窝沟封闭剂的应用舌系带的切除。对于FHS患儿身材矮小的治疗,可考虑使用人生长激素(human growth hormone, hGH)疗法。Seifert等[10]报道5例FHS患者中3例对hGH治疗反应良好;Galli-Tsinopoulou等[11]报道1例生长激素缺乏FHS患儿应用21个月hGH后生长速度和身高明显改善,但也出现骨龄不适当加速。hGH治疗是否有利于提高FHS患儿终身高有待进一步研究。目前FHS资料中有关hGH治疗的数据有限,所以需谨慎。针对本例患儿生长明显受损,我们使用hGH治疗,每日剂量0.15 IU/kg,每晚一次。应用3个月后复诊,患儿身高增长了3 cm,目前仍在应用中,但尚需进一步观察hGH治疗FSH的安全性及有效性。
总体而言,FHS患儿尽管有一些器官、系统受累,但生活质量尚好。FHS临床极为罕见,容易漏诊及误诊。对于具有特征性临床表现的患者,应考虑FHS的诊断,并进一步行致病基因测序分析协助诊断。SRCAP是目前已知的唯一的一种可引起FHS的致病基因。如经进一步基因测序,发现患者携带SRCAP突变,可从遗传学上证实诊断。
| [1] |
Hood RL, Schenkel LC, Nikkel SM, et al. The defining DNA methylation signature of Floating-Harbor syndrome[J]. Sci Rep, 2016, 6: 38803. DOI:10.1038/srep38803 (  0) 0) |
| [2] |
Gerundino F, Marseglia G, Pescucci C, et al. 16p11. 2 de novo microdeletion encompassing SRCAP gene in a patient with speech impairment, global developmental delay and behavioural problems[J]. Eur J Med Genet, 2014, 57(11-12): 649-653. DOI:10.1016/j.ejmg.2014.09.009 (  0) 0) |
| [3] |
Kehrer M, Beckmann A, Wyduba J, et al. Floating-Harbor syndrome:SRCAP mutations are not restricted to exon 34[J]. Clin Genet, 2014, 85(5): 498-499. DOI:10.1111/cge.12199 (  0) 0) |
| [4] |
Messina G, Atterrato MT, Dimitri P. When chromatin organisation floats astray:the Srcap gene and Floating-Harbor syndrome[J]. J Med Genet, 2016, 53(12): 793-797. DOI:10.1136/jmedgenet-2016-103842 (  0) 0) |
| [5] |
Hood RL, Lines MA, Nikkel SM, et al. Mutations in SRCAP, encoding SNF2-related CREBBP activator protein, cause Floating-Harbor syndrome[J]. Am J Hum Genet, 2012, 90(2): 308-313. DOI:10.1016/j.ajhg.2011.12.001 (  0) 0) |
| [6] |
Roelfsema JH, White SJ, Ariyürek Y, et al. Genetic heterogeneity in rubinstein-taybi syndrome:mutations in both the CBP and EP300 genes cause disease[J]. Am J Hum Genet, 2005, 76(4): 572-580. DOI:10.1086/429130 (  0) 0) |
| [7] |
Lacombe D, Patton MA, Elleau C, et al. Floating-Harbor syndrome:description of a further patient, review of the literature, and suggestion of autosomal dominant inheritance[J]. Eur J Pediatr, 1995, 154(8): 658-661. DOI:10.1007/BF02079072 (  0) 0) |
| [8] |
Nikkel SM, Dauber A, de Munnik S, et al. The phenotype of Floating-Harbor syndrome:clinical characterization of 52 individuals with mutations in exon 34 of SRCAP[J]. Orphanet J Rare Dis, 2013, 8: 63. DOI:10.1186/1750-1172-8-63 (  0) 0) |
| [9] |
Singh A, Bhatia HP, Sood S, et al. A novel finding of oligodontia and ankyloglossia in a 14-year-old with Floating-Harbor syndrome[J]. Spec Care Dentist, 2017, 37(6): 318-321. DOI:10.1111/scd.12257 (  0) 0) |
| [10] |
Seifert W, Meinecke P, Krüger G, et al. Expanded spectrum of exon 33 and 34 mutations in SRCAP and follow-up in patients with Floating-Harbor syndrome[J]. BMC Med Genet, 2014, 15: 127. (  0) 0) |
| [11] |
Galli-Tsinopoulou A, Kyrgios I, Emmanouilidou E, et al. Growth hormone deficiency:an unusual presentation of Floating-Harbor syndrome[J]. Hormones (Athens), 2011, 10(3): 236-240. (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


