(1)病史:患儿女性,生后2 d,因发现皮肤黄染半天入院。半天前发现皮肤黄染明显,经皮胆红素测定(前胸)28.8 mg/dL,无抽搐、呕吐、腹泻。入院体查:T 37.7℃,P 134次/min,R 50次/min,BP 66/42 mm Hg,体重2 690 g,反应可,全身皮肤及巩膜重度黄染,心肺听诊无异常,肝脾未触及,全身未见瘀点瘀斑,哭声较尖,四肢肌张力正常。患儿系第1胎第1产,胎龄38+4周,顺产出生,出生体重2 900 g,无窒息抢救史,胎盘、脐带、羊水均无异常。出生后一直配方奶喂养,吃奶一般。出生时父亲24岁,母亲23岁,均体健,家族中无黄疸、出血性疾病及其他重大疾病史。
(2)辅助检查:血常规示WBC 23.81×109/L(参考值:15.00~20.00×109/L),PLT 12×109/L(参考值:100~400×109/L),Hb 137 g/L(参考值:170~200 g/L)。肝肾功能示总胆红素571 μmol/L(参考值:68~205 μmol/L),直接胆红素15.4 μmol/L(参考值:0~5.1 μmol/L),肌酐114 μmol/L(参考值:15~77 μmol/L),尿素10.06 mmol/L(参考值:1.79~6.43 mmlo/L)。血型鉴定示患儿O型Rh阳性,父亲O型Rh阳性,母亲B型Rh阳性。新生儿溶血筛查、Coomb' s试验均阴性,超敏C反应蛋白、葡萄糖-6-磷酸脱氢酶(G-6-PD)活性、凝血功能正常。外周血涂片可见裂体红细胞。粪便肠道病毒检测阴性。腹部B超示左肝探及大小1.6 cm×1.5 cm×1.3 cm低回声团,考虑血管瘤。头颅B超、双侧肾上腺B超均未见异常。
2 诊断思维患儿系足月适于胎龄儿,生后2 d即出现严重黄疸,总胆红素高达571 μmol/L,以间接胆红素升高为主,同时血常规提示贫血和显著的PLT减少。因此该患儿的诊断从以下两条思路着手:(1)重度高间接胆红素血症和贫血:病因主要是红细胞破坏后胆红素产生增加或清除减少,胆红素生成增加的病因较多,临床常见如ABO或Rh血型不合、G-6-PD缺乏、感染、头颅血肿、肾上腺血肿等;胆红素清除减少的病因主要有Gilbert综合征、Crigler-Najjar综合征、肠肝循环增加及甲状腺功能低下等。(2)PLT减少:新生儿PLT减少症可根据生后起病的时间分为早发型(< 72 h)和晚发型(≥72 h),患儿生后第2天起病,属于早发型PLT减少症,其主要病因为慢性宫内缺氧、围产期窒息、免疫性PLT减少、围产期细菌感染(大肠杆菌、无乳链球菌)、肠道病毒感染等,其他较少见的原因包括血栓性血小板减少性紫癜(thrombotic thrombocytopenic purpura, TTP)、血管性血友病2B型、范科尼贫血等遗传性疾病[1]。临床医师通过血型鉴定及新生儿溶血筛查排除了ABO溶血及Rh溶血,G-6-PD活性正常可排除G-6-PD缺乏症,头颅B超及肾上腺B超未见异常,头颅、肾上腺血肿亦不考虑。免疫性血小板减少症是新生儿重度PLT减少的常见原因,其诊断需排除其他引起PLT减少的原因,其中同族免疫性血小板减少症可结合患儿及母亲抗PLT抗体检测辅助诊断,当高度怀疑免疫性血小板减少症,而患者病情危重无法及时确诊时,可应用静脉注射人免疫球蛋白(IVIG)行诊断性治疗,若应用IVIG后PLT显著上升亦可辅助诊断。患儿无常见的早发型败血症的高危因素,反复多次监测血常规,白细胞及超敏C反应蛋白均正常,细菌性败血症基本排除,有待血培养进一步支持;肠道病毒感染可引起PLT降低,严重者进展迅速,但该患儿粪便肠道病毒阴性,不支持该诊断。患儿母亲孕期体健,无妊娠期糖尿病、高血压等导致慢性宫内缺氧的高危因素,分娩顺利,故宫内缺氧、窒息等致PLT减少的因素可排除。
新生儿常见的溶血性疾病和血小板减少症均难以解释患儿的表现。患儿外周血涂片发现裂体红细胞,考虑到裂体红细胞源自于红细胞碎片或不完整的红细胞,是红细胞受到纤维蛋白丝切割所致的机械性损伤或由某些产生湍急血流的疾病导致, 裂体红细胞的出现在一定条件下提示血栓性微血管病性贫血(thrombotic microangiopathic anemia, TMA)的存在,是诊断TMA的重要形态学线索[2]。裂体红细胞可能在TMA起病急性期出现,也可能在起病多日后出现甚至整个病程不出现。TMA主要包括TTP和溶血尿毒综合征等,其主要表现为PLT减少和微血管病性溶血性贫血,结合该患儿同时存在高胆红素血症、贫血、PLT减少,故需考虑TMA。根据《新英格兰医学杂志》对TMA的评估诊断流程推荐,对于无肾损伤或轻度肾损伤的患者,应首先考虑TTP,其中在儿童期起病者,首先考虑先天性TTP[3]。该患儿仅急性期血肌酐轻度升高,但无少尿、水肿等严重肾功能损害的症状,故诊断上重点考虑先天性TTP。需行ADAMTS13酶活性及其抑制物检测或基因检测以进一步明确。
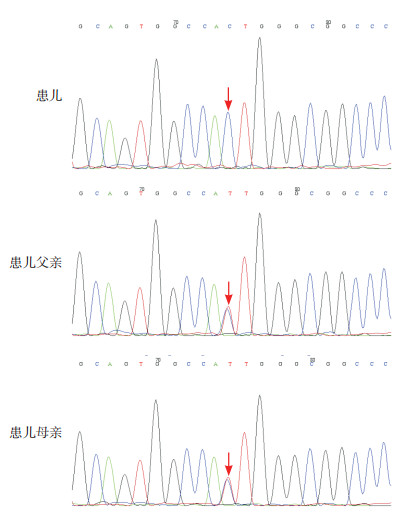
3 进一步检查征得家属同意后,采集患儿及其父母外周静脉血3 mL(EDTA抗凝)送检北京迈基诺医学检验所行全外显子组测序,对测序结果中变异位点行Sanger测序验证。基因结果提示患儿ADAMTS13基因存在纯合错义突变c.3650T > C(p.I1217T),使编码区第3 650号核苷酸由胸腺嘧啶变异为胞嘧啶,导致第1 217号氨基酸由异亮氨酸变异为苏氨酸,分别遗传自父母(图 1)。人类基因突变数据库(HGMD, http://www.hgmd.cf.ac.uk)已有该位点与先天性TTP的致病性报道,符合PS1;该突变在正常人群数据库中的频率为0.00020,为低频变异,符合PM2;经生物信息学蛋白功能预测软件MutationTaster(http://www.mutationtaster.org)、PolyPhen-2(http://genetics.bwh.harvard.edu/pph2)、SIFT(https://sift.bii.a-star.edu.sg)、GERP++(http://mendel.stanford.edu/SidowLab/downloads/gerp/index.html)、REVEL(https://sites.google.com/site/revelgenomics/)预测,均提示为有害,符合PP3。根据美国医学遗传学与基因组学(American College of Medical Genetics and Genomics, ACMG)遗传变异分类标准和指南[4],该变异判定为可能致病性变异。
|
图 1 患儿及其父母ADAMTS13基因Sanger测序图 患儿ADAMTS13基因存在c.3650T > C的纯合突变,患儿父母均为该位点的杂合突变。箭头所指为突变位点。 |
在病因尚未完全明确的情况下,立即开始对症支持治疗。包括双面蓝光光疗、补液、灌肠通便促进胎便排出等,并且积极准备换血治疗。最初考虑免疫性血小板减少症及溶血,入院后即予以IVIG 1 g/kg单次输注,IVIG输注后,监测PLT仍波动在(6~28)×109/L,Hb逐渐降至75 g/L,监测血胆红素波动于425~575 μmol/L,IVIG应用效果不佳,免疫性血小板减少症及溶血可能性小。该患儿同时存在溶血、PLT减少及轻度肾功能损害,结合外周血涂片可见裂体红细胞,考虑存在先天性TTP,予先后输注O型血浆(10 mL/kg)、洗涤红细胞及PLT。输血结束后,患儿PLT升至289×109/L,Hb升至131 g/L。患儿持续接受双面蓝光光疗24 h后查血胆红素490 μmol/L,仍达换血水平,予O型血浆洗涤红细胞及O型血浆行换血治疗,过程顺利,换血后患儿血胆红素降至316 μmol/L,病情逐渐稳定,PLT逐渐回升,于换血后第4天升至113×109/L并稳定在正常范围(PLT、Hb、总胆红素变化情况见表 1)。住院过程中肌酐最高升至158 μmol/L,后逐渐降至正常。脑干听觉诱发电位检查:左耳90 dBnHL,右耳 > 99 dBnHL;头颅MRI:T1WI苍白球信号偏高。患儿住院10 d后,病情稳定,予以出院。出院后1个月门诊随访,患儿体重增长理想,黄疸逐渐消退。
| 表 1 患儿血小板、血红蛋白及总胆红素水平动态监测 |
|
|
诊断:先天性TTP。诊断依据:(1)起病于新生儿期的严重的黄疸伴PLT减少,外周血涂片发现裂体红细胞,考虑存在TMA,且基本除外临床常见的各种导致溶血、PLT减少的病因;(2)患儿9号染色体ADAMTS13基因存在已报道的致病突变c.3650T > (p.I1217T),患儿为纯合突变,经过家系验证分析,其父母均为该位点杂合突变;(3)输注新鲜冰冻血浆及换血治疗后患儿病情好转。
6 讨论TTP是由PLT异常聚集和系统微血管血栓形成所致的危重疾病,其主要的发病机制是由于体内血管性血友病因子(von Willebrand factor, VWF)裂解蛋白酶ADAMTS13的活性下降,微血管内VWF作为ADAMTS13的底物出现水解障碍,致异常巨大的VWF释放,形成富含PLT的微血栓,从而引起PLT减少和微血管病性溶血性贫血,而微血管中形成的PLT血栓可导致以脑、肾脏为主的多器官损害[5]。TTP分为先天性与继发性,先天性TTP是一种非常罕见的常染色体隐性遗传性疾病,主要由于患者9号染色体ADAMTS13基因突变引起ADAMTS13活性低下而导致一系列临床症状[6]。先天性TTP占TTP总数的极少一部分,一项欧洲近年的临床统计研究显示其发病率为0.5~4/1 000 000[7],日本一项研究则为1/1 100 000[8]。先天性TTP分为早发型和晚发型[9],早发型多起病于新生儿及婴儿期,新生儿期患者大多数以黄疸起病,就诊过程中逐渐发现PLT减少、溶血性贫血、发热等症状,婴幼儿期患者主要因多次在感染后或接种疫苗后出现PLT减少而最终确诊;晚发型患者主要在怀孕(女性患者)、感染等过程中发现PLT下降而就诊。一项日本的临床研究回顾了38例先天性TTP患者,16例(42%)患者在新生儿期起病,另外16例(42%)患者在15岁以后起病,其余患者则在儿童期起病[10]。
先天性TTP患者的实验室检查特点主要包括PLT低下、溶血性贫血且Coomb's实验阴性、外周血涂片可见裂体红细胞、间接胆红素升高、血肌酐升高等[11]。先天性TTP的诊断主要依赖ADAMTS13活性及其抑制物检测[12],患者的ADAMTS13活性小于10%且不伴有ADAMTS13抑制物,父母作为无症状的杂合子基因突变携带者,其ADAMTS13活性通常在30%~50%[13]。ADAMTS13基因的纯合突变或复杂杂合突变亦可帮助确诊为先天性TTP[14]。日本TTP研究小组纳入了截止到2015年共59名确诊为先天性TTP的患者,其中55名接受了基因检测,结果提示10例纯合突变和45例复杂杂合突变[15]。该例患儿经基因检查明确为ADAMTS13基因c.3650T > C(p.I1217T)的纯合突变,先天性TTP诊断明确。搜索PubMed、Cochrane Library、万方数据库、中国知网等数据库未发现同位点纯合突变所致的先天性TTP病例,仅发现2008年Park等[16]报道相同位点复杂杂合突变所致先天性TTP并发烟雾病1例。
先天性TTP具有复发性,其治疗主要包括对疾病复发的预防和急性期的治疗,补充外源性的ADAMTS13可有效治疗和预防先天性TTP的发作,目前主要选择的替代制剂为新鲜冰冻血浆,输注血浆的量和频率应当根据疾病的严重程度(包括PLT计数及溶血情况等)及复发频率而定,对于症状反复发作并导致脏器功能损害的患者,需要定期输注血浆来维持病情稳定,而症状偶发且未合并脏器功能损害的患者仅需在急性感染时、手术前或接种疫苗前预防性输注。定期防治推荐每2~3周输注血浆5~10 mL/kg 1次,急性发病者每次输注血浆10 mL/kg,并根据PLT监测情况调整治疗[15, 17]。预防复发对于改善预后十分重要,轻度(仅需观察)及中度(需偶尔输注血浆或周期性输注血浆控制病情)的先天性TTP患者通常拥有良好的生活质量,重症患者由于肾功能衰竭、神经系统后遗症等因素,需持续透析或其他支持治疗[15, 17-19]。
先天性TTP的确诊方法及治疗方式并不复杂,但其发病率低,临床表现缺乏特异性,临床医师能及时地考虑到该病并针对性地展开检查甚至诊断性的治疗并不容易。部分先天性TTP患者由于临床症状反复发作而被误诊为难治性的免疫性血小板减少症或Evans综合征等,反复接受IVIG及糖皮质激素治疗,甚至接受其他的免疫抑制剂治疗[20]。正确的诊断对于先天性TTP患者的急性期治疗及改善预后十分重要,本例患儿生后2 d即发病,表现为重度高胆红素血症、贫血和PLT减少,极易被诊断为免疫性溶血、重症感染等疾病,但进一步实验室检查结果及疾病进展情况均不支持。外周血涂片可见裂体红细胞给我们提供了诊断的方向,它是诊断TTP的重要形态学线索。基因结果回报需要1个月左右时间,由于患儿病情危重,虽然缺乏确诊依据,我们仍及时给予了新鲜冰冻血浆输注并进行换血治疗,二者均可补充外源性的ADAMTS13,最终患儿病情好转,随后通过基因检测结果明确诊断并进入随访阶段。
7 结语新生儿期出现进展迅速的溶血性贫血及PLT减少,且无法用常见病因解释时,应当考虑到先天性TTP这一罕见的血栓性微血管病。由于先天性TTP发病率极低,症状及实验室检查缺乏特异性,ADAMTS13活性及其抑制物检测未广泛开展,及时的识别和正确的处理仍是先天性TTP诊疗的临床难点。本文总结1例以重症高胆红素血症、贫血、PLT减少为主要表现的先天性TTP的诊疗过程,以提高临床医师对本病的认识,减少漏诊、误诊。
| [1] |
Gunnink SF, Vlug R, Fijnvandraat K, et al. Neonatal thrombocytopenia:etiology, management and outcome[J]. Expert Rev Hematol, 2014, 7(3): 387-395. (  0) 0) |
| [2] |
Zini G, d'Onofrio G, Briggs C, et al. ICSH recommendations for identification, diagnostic value, and quantitation of schistocytes[J]. Int J Lab Hematol, 2012, 34(2): 107-116. (  0) 0) |
| [3] |
George JN, Nester CM. Syndromes of thrombotic microangiopathy[J]. N Engl J Med, 2014, 371(7): 654-666. (  0) 0) |
| [4] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. (  0) 0) |
| [5] |
Zheng XL. ADAMTS13 and von Willebrand factor in thrombotic thrombocytopenic purpura[J]. Annu Rev Med, 2015, 66: 211-225. (  0) 0) |
| [6] |
Joly BS, Coppo P, Veyradier A. Thrombotic thrombocytopenic purpura[J]. Blood, 2017, 129(21): 2836-2846. (  0) 0) |
| [7] |
Mansouri Taleghani M, von Krogh AS, Fujimura Y, et al. Hereditary thrombotic thrombocytopenic purpura and the hereditary TTP registry[J]. Hamostaseologie, 2013, 33(2): 138-143. (  0) 0) |
| [8] |
Kokame K, Kokubo Y, Miyata T. Polymorphisms and mutations of ADAMTS13 in the Japanese population and estimation of the number of patients with Upshaw-Schulman syndrome[J]. J Thromb Haemost, 2011, 9(8): 1654-1656. (  0) 0) |
| [9] |
Fujimura Y, Kokame K, Yagi H, et al. Hereditary deficiency of ADAMTS13 activity:Upshaw-Schulman syndrome[M]. Switzerland: Springer International Publishing, 2015: 73-90.
(  0) 0) |
| [10] |
Fujimura Y, Matsumoto M, Isonishi A, et al. Natural history of Upshaw-Schulman syndrome based on ADAMTS13 gene analysis in Japan[J]. J Thromb Haemost, 2011, 9(Suppl 1): 283-301. (  0) 0) |
| [11] |
Krogh AS, Waage A, Quist-Paulsen P. Congenital thrombotic thrombocytopenic purpura[J]. Tidsskr Nor Laegeforen, 2016, 136(17): 1452-1457. (  0) 0) |
| [12] |
Hanby HA, Zheng XL. Current status in diagnosis and treatment of hereditary thrombotic thrombocytopenic purpura[J]. Hereditary Genet, 2014, 3(1): pii:e108. (  0) 0) |
| [13] |
Kokame K, Matsumoto M, Soejima K, et al. Mutations and common polymorphisms in ADAMTS13 gene responsible for von Willebrand factor-cleaving protease activity[J]. Proc Natl Acad Sci U S A, 2002, 99(18): 11902-11907. (  0) 0) |
| [14] |
Matsumoto M, Kokame K, Soejima K, et al. Molecular characterization of ADAMTS13 gene mutations in Japanese patients with Upshaw-Schulman syndrome[J]. Blood, 2004, 103(4): 1305-1310. (  0) 0) |
| [15] |
Matsumoto M, Fujimura Y, Wada H, et al. Diagnostic and treatment guidelines for thrombotic thrombocytopenic purpura (TTP) 2017 in Japan[J]. Int J Hematol, 2017, 106(1): 3-15. (  0) 0) |
| [16] |
Park HW, Oh D, Kim N, et al. Congenital thrombotic thrombocytopenic purpura associated with unilateral moyamoya disease[J]. Pediatr Nephrol, 2008, 23(9): 1555-1558. (  0) 0) |
| [17] |
Coppo P, Veyradier A. Current management and therapeutical perspectives in thrombotic thrombocytopenic purpura[J]. Presse Med, 2012, 41(3 Pt 2): e163-e176. (  0) 0) |
| [18] |
Saha M, McDaniel JK, Zheng XL. Thrombotic thrombocyto-penic purpura:pathogenesis, diagnosis, and potential novel therapeutics[J]. J Thromb Haemost, 2017, 15(10): 1889-1900. (  0) 0) |
| [19] |
Mise K, Ubara Y, Matsumoto M, et al. Long term follow up of congenital thrombotic thrombocytopenic purpura (Upshaw-Schulman syndrome) on hemodialysis for 19 years:a case report[J]. BMC Nephrol, 2013, 14: 156. (  0) 0) |
| [20] |
傅玲玲, 马洁, 马静瑶, 等. 儿童先天性血栓性血小板减少性紫癜五例分析[J]. 中华儿科杂志, 2019, 57(1): 50-54. (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


