超声技术已成功用于新生儿肺脏疾病的诊断和鉴别诊断,从而可以使其在诊疗过程中避免或减少射线暴露和损害。超声检查具有诸多优点,除无射线损害外,而且简单易学、准确性与可靠性高、可在床边开展、便于动态观察,尤其适合危重症患者,因而建议将超声作为肺部疾病筛查或诊断的首选手段[1-5]。因此,有必要大力推广这一技术,促进肺脏超声在我国新生儿领域的开展和普及,从而使临床医师和超声科医师能够更好地借助超声对肺脏疾病进行诊断和鉴别诊断[6-8]。
鉴于新生儿肺脏超声在我国刚刚起步,尚缺乏完善规范的培训和操作指导意见,为了规范肺脏超声在临床中的应用,中华医学会儿科学分会围产医学专业委员会、中国医师协会新生儿科医师分会超声专业委员会、中国医药教育协会超声医学专业委员会重症超声学组、中国重症超声学院和《中华实用儿科临床杂志》编辑委员会特组织有关专家,在借鉴国内外经验的基础上拟定本指南,并在今后的实践中,根据对肺脏超声认识水平的提高予以修订和完善。
1 探头选择建议使用频率为9.0 MHz以上的高频线阵探头,通常胎龄越小、体重越低,所需探头频率越高[9-10]。
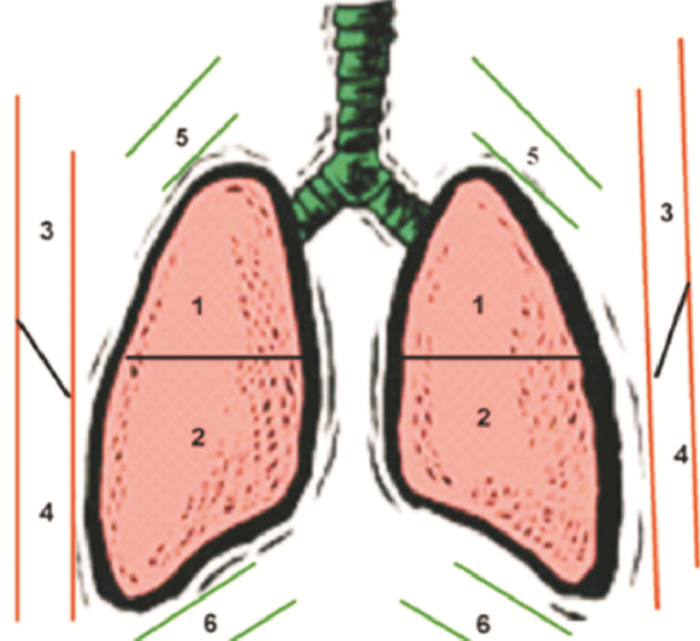
2 检查方法 2.1 肺部分区通常以腋前线、腋后线为界将肺脏分成前、侧、后3个区域,即两侧肺脏被分为6个区域;为避免检查遗漏,还可再以两乳头连线为界,将每侧肺脏分成上、下2个肺野,从而将双侧肺脏分成12个区域(图 1)[11]。为便于标记和描述病变部位,在实际工作中可采用R/L 1~6分区标记法,即R代表右侧肺脏(R1:右前上,R2:右前下,R3:右腋上,R4:右腋下,R5:右后上,R6:右后下);L代表左侧肺脏(L1:左前上,L2:左前下,L3:左腋上,L4:左腋下,L5:左后上,L6:左后下)。
|
图 1 肺脏12分区法[11] 1:前上肺; 2:前下肺; 3:侧上肺; 4:侧下肺; 5:后上肺; 6:后下肺。 |
检查时患儿可仰卧、侧卧或俯卧,对肺脏的每个区域分别进行扫查。
2.3 扫查方法扫查时探头需与肋骨垂直(纵向扫查法)和平行(横向扫查法:探头沿肋间隙走向逐一肋间扫查)。以纵向扫查法最为重要和常用,其中探头与肋骨垂直是保证检查准确可靠的关键。
3 检查对象和检查时机 3.1 检查对象疑似或不能除外肺部疾病的患儿。
3.2 检查时机(1)以呼吸困难入院者:入院后应尽早实施首次肺部超声检查,其中呼吸窘迫综合征(respiratory distress syndrome, RDS)高危儿可在首次检查后每2~4 h复查1次,直至排除该病或明确诊断。(2)住院患儿:在病情变化,尤其出现呼吸道症状时随时检查。(3)正在接受呼吸机治疗者:可每天复查1、2次或根据临床需要随时复查,直至撤机。(4)接受外源性肺表面活性物质(pulmonary surfactant, PS)治疗者:可在给予PS后每2~4 h复查1次,直至撤机。(5)接受支气管肺泡灌洗术或胸腔穿刺引流者:于灌洗后或胸腔穿刺引流后即刻复查。(6)随访:对已经明确诊断肺部疾病者,可根据病情定期复查或随访。
4 常用术语 4.1 胸膜线与肺滑胸膜线(pleural line)是由胸膜与肺表面声阻抗的差异所形成的强回声反射,在超声下呈光滑、清晰、规则的线性高回声;如胸膜线消失、粗糙模糊、不规则或不连续等均为异常。在实时超声下,当探头与肋骨垂直扫描时于胸膜线处可见脏层胸膜与壁层胸膜随肺脏呼吸运动而产生一种水平方向的相对滑动,称为肺滑(lung sliding)[12-13]。
4.2 A-线A-线(A-line)[12-13]系当声束与胸膜垂直时,因混响伪像形成多重反射而产生的一种与胸膜线平行的线性高回声,位于胸膜线下方,超声下呈一系列与之平行的光滑、清晰、规则的线性高回声,彼此间距相等,回声由浅入深逐渐减弱至消失。
4.3 B-线、融合B-线与肺间质综合征起始于胸膜线并与之垂直、呈放射状发散至肺野深部的线性高回声称为B-线(B-line)。当探头与肋骨垂直扫描时,如整个肋间隙内表现为密集存在的B-线(B-线相互融合难以区分计数)而肋骨声影仍清晰显示,这种密集的B-线称为融合B-线(confluent B-line)。当任一扫描区域内有连续2个以上肋间隙存在融合B-线时称为肺间质综合征(alveolar-interstitial syndrome, AIS)[14-16]。
4.4 致密B-线与白肺当探头与肋骨垂直扫描时,如肺野内存在过于密集的B-线,则可能导致整个扫描区域内的肋骨声影几近消失,这种能够导致整个扫描区域内肋骨声影基本消失的B-线称为致密B-线(compact B-line)。如两侧肺脏的每个扫描区域均表现为致密B-线,则称为白肺(white lung)[17]。
4.5 肺实变与肺搏动在超声影像上呈“肝样变”的肺组织称为肺实变(lung consolidation),可伴有支气管充气征(air bronchogram)或支气管充液征(fluid bronchogram),严重者在实时超声下可见动态支气管充气征(dynamic air bronchogram)。当肺实变范围较大、程度较重而接近心脏边缘时,在实时超声下可见实变肺组织随心脏的搏动而搏动,称为肺搏动(lung pulse)[18-19]。
4.6 碎片征当实变肺组织与充气肺组织分界不明确时,二者之间所形成的超声征象称为碎片征(shred sign)[20]。
4.7 肺点随着呼吸运动,在实时超声下所见肺滑存在与消失交替出现的分界点称为肺点(lung point)[21-22]。肺点是气胸的特异性征像,可准确定位轻-中度气胸时气体边界所在的位置,但重度气胸时无肺点。
4.8 双肺点由于病变程度或性质不同,在肺脏超声影像的上下肺野之间可形成一明显的分界点,称为双肺点(double lung point)[23]。
4.9 沙滩征与平流层征在M型超声下,可见由胸膜线上方波浪线样的线性高回声与胸膜线下方由肺滑产生的均匀颗粒样点状回声共同形成的一种类似海滨沙滩样表现的超声影像,称为沙滩征(sandbeach sign)或海岸征(seashore sign)。当肺滑消失时,则胸膜线下方的颗粒样点状回声被一系列平行线所替代,称为平流层征(stratosphere sign)或条形码征(barcode sign)[21, 24]。
5 正常肺脏超声影像学特点新生儿正常肺组织在超声下呈低回声。在B型超声下,胸膜线与A-线均呈清晰、光滑、规则的线性高回声,彼此等间距平行排列,由肺野浅部入深A-线回声逐渐减弱至消失;无(出生3~7 d后)或可有少数几条B线(生后3~7 d内),但无AIS、胸腔积液和肺实变等超声征象;在实时超声下可见肺滑,在M型超声下则表现为沙滩征[12, 25-26](图 2)。

|
图 2 新生儿正常肺脏超声表现 A:B型超声表现; B:M型超声表现。新生儿正常肺脏在B型超声下呈低回声, 胸膜线呈高回声(光滑、清晰、规则), A-线清晰显示, 也呈高回声, 与胸膜线等间距平行排列。无(>7 d)或仅有少数几条B线(<7 d), 无肺间质综合征(AIS)和胸腔积液(图 2A), 实时超声下可见肺滑。在M型超声下表现为沙滩征(图 2B)。 |
RDS系指由于各种原因引起PS的原发或继发性缺乏,导致由肺泡壁至终末细支气管壁嗜伊红透明膜形成和肺不张,以至新生儿出生后不久出现以进行性呼吸困难、呼气性呻吟、发绀和呼吸衰竭为主要临床表现的严重肺部疾病。病理上(光学显微镜下)主要表现为广泛性肺泡萎陷和嗜伊红透明膜形成。
RDS的超声诊断依据[18, 27-29]:(1)肺实变伴支气管充气征:是RDS最重要的超声影像学表现,其特点为:①实变的程度和范围与疾病程度有关:轻度RDS实变可仅限于胸膜下,呈小范围、局灶性,重度RDS则实变范围扩大,并可扩展至肺野深部;②实变可见于两侧肺脏的不同肺野,也可仅限于一侧肺脏的某些肋间;③支气管充气征呈密集的雪花状或斑点状,实变区呈不均质低回声,与周围肺组织易于区分。(2)胸膜线异常与A-线消失。(3)非实变区呈AIS样改变。(4)双肺点:在轻度RDS急性期或重度RDS恢复期可有双肺点。(5)胸腔积液:15%~20%的患儿可有不同程度的单侧或双侧胸腔积液。需要注意的是,在RDS时不但双侧肺脏的病变程度与性质可不一致(如一侧肺脏有实变,另一侧无实变),同一侧肺脏不同肺野的病变程度与性质也可不同(如某一肺野表现为实变,另一肺野表现为水肿或胸腔积液等)(图 3)。

|
图 3 呼吸窘迫综合征(RDS)的超声表现 A:胸片呈RDS(Ⅳ级)改变,肺脏超声显示双肺大面积实变伴明显的支气管充气征,胸膜线与A-线消失。B:胸片呈RDS(Ⅲ ~ Ⅳ级)改变,肺脏超声显示左肺野及右肺上野呈实变伴支气管充气征,胸膜线与A-线消失,右肺下野可见明显胸腔积液。 |
暂时性呼吸增快症(transient tachypnea of the newborn, TTN)系由于肺液吸收清除延迟至肺内液体积聚过多而使肺顺应性下降、气体交换障碍引起的一种暂时性呼吸困难,但重度TTN与RDS可有类似的临床表现、胸部X-线表现和动脉血气分析结果,甚至需要有创或无创呼吸支持治疗,二者临床上易于混淆和误诊。在病理上主要表现为肺组织(肺泡和肺间质)内液量过多,即肺泡或/和间质积液。
TTN的超声诊断依据主要是不同程度的肺水肿,但无肺实变[14, 26, 30-33]:(1)轻度TTN主要表现为AIS或双肺点;重度TTN在急性期主要表现为致密B-线、白肺或程度较重的AIS,随病情恢复亦可出现双肺点。(2)轻度或重度TTN均可有胸膜线异常、A-线消失。(3)胸腔积液:无论轻或重度TTN,均可有不同程度的单侧或双侧胸腔积液。(4)无肺实变(图 4)。

|
图 4 暂时性呼吸增快症(TTN)的超声表现 A:患儿因呼吸困难10 h,于出生后10 h入院。呼吸频率66次/min,无鼻翼扇动和三凹征,血气分析正常。胸部X-线可见肺泡积液征和间质积液征。肺脏超声呈肺间质综合征改变,提示存在肺水肿。B:左图显示双肺点;中间图显示胸腔积液;右图显示致密B-线;如每一扫描区域均呈致密B-线,则为白肺。 |
肺炎指由于病原体感染或理化因素所致的包括终末气道、肺泡腔和肺间质在内的肺实质炎症,可为感染性(包括呼吸机相关性)或吸入性。病理上主要表现为肺泡的炎性渗出、充血和水肿,可累及支气管-细支气管壁和肺泡壁的间质;当细支气管壁上皮细胞坏死,管腔被黏液、纤维素和细胞碎片堵塞后,可发生限局性肺气肿和肺不张。
肺脏超声对肺炎具有确切诊断价值,且超声影像学改变甚至可早于其他影像学检查和实验室检查[27],主要诊断依据[7, 26, 34-39]:(1)肺实变伴支气管充气征或支气管充液征:是肺炎最主要的超声影像学改变,其特点为:①实变的程度和范围与疾病程度有关:重症肺炎实变范围较大、边界不规则或呈锯齿状,实变区边缘可见碎片征,在实时超声下可见动态支气管充气征;轻度肺炎或肺炎早期可仅见累及1个肋间的胸膜下小范围实变区。②实变可位于肺野的任何一个或多个部位,在同一肺野内也可存在大小和形状不同的实变区。(2)实变区胸膜线异常、A-线消失。(3)非实变区可见B-线或呈AIS改变。(4)胸腔积液:少数患儿可有不同程度的单侧或双侧胸腔积液。(5)轻度患儿急性期或重度患儿恢复期偶可见双肺点(图 5)。

|
图 5 肺炎的超声表现 A:患儿因呼吸困难3 d,于出生20 d入院,伴发热(38℃),听诊双肺密集湿性啰音。白细胞22×109/L,中性粒细胞0.78,C反应蛋白66.8 mg/L。肺脏超声显示两侧肺脏均见边缘不规则的大面积实变区伴支气管充气征,胸膜线消失或模糊,A-线消失。胸部X-线检查符合肺炎改变。B:肺脏超声显示左肺大面积实变伴支气管充气征,右肺除实变伴支6.3肺炎气管充气征外,尚可见明显胸腔积液。 |
胎粪吸入综合征(meconium aspiration syndrome, MAS)系因胎儿在宫内缺氧,诱发胎儿排便及呼吸,导致在宫内和分娩过程中吸入了被胎粪污染的羊水,胎粪颗粒致气管-支气管-终末细支气管-肺泡机械性堵塞、化学性炎症及继发性PS缺乏,从而导致患儿严重呼吸困难和呼吸衰竭。病理上可因胎粪颗粒的机械性梗阻而引起肺泡萎陷、肺不张或肺气肿,胎粪颗粒刺激肺泡和小气道而引起化学性炎症和间质性肺水肿。
MAS的主要超声声像图特点[40-41]:(1)肺实变伴支气管充气征:是MAS最重要的超声声像图特点,实变范围与疾病程度有关,实变区边界不规则或呈锯齿状,可见碎片征;两侧肺脏实变程度可以不同,同一侧肺脏内也可存在大小不同的实变区。(2)突变区胸膜线异常与A-线消失。(3)非实变区可见B-线或呈AIS改变。(4)其他:少数患儿可有胸腔积液或双肺点。需要注意的是:仅依据超声表现,MAS与肺炎常难以区别,需结合病史及其他实验室检查才能明确诊断(图 6)。

|
图 6 胎粪吸入综合征(MAS)的超声表现 肺脏超声显示双肺大面积实变伴支气管充气征,边界不规则,胸膜线与A-线消失,右肺可见2个大小不同范围的实变区。胸部X-线检查呈典型MAS改变。 |
肺出血(pulmonary hemorrhage of the newborn, PHN)不是一个独立的疾病,往往是其他疾病的晚期并发症,其病因复杂、起病凶险、病情进展快,是导致新生儿死亡最常见肺疾病之一。病理上可表现为点状出血、局灶性出血和弥散性出血,以肺泡出血和肺泡结构破坏为主,也可累及肺间质。
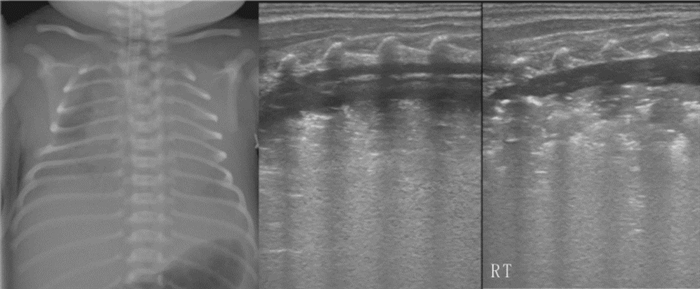
PHN的超声诊断主要依据[42-43]:(1)碎片征:是PHN最常见超声征象。(2)肺实变伴支气管充气征:肺实变的程度和范围与原发病和出血程度有关。(3)胸腔积液:80%以上的PHN患儿有不同程度的单侧或双侧胸腔积液,胸腔穿刺可证实积液为血性;出血严重者在积液内可见纤维蛋白变性形成的纤维条索状漂浮物,实时超声下可见此纤维条索状物随积液的运动而漂浮于其中。(4)可有原发肺疾病的超声表现。(5)其他:如胸膜线异常、A-线消失和AIS等(图 7)。
|
图 7 肺出血的超声表现 肺出血患儿,肺脏超声显示大面积肺实变伴支气管充气征,在右肺内实变区边缘的碎片征,双侧胸腔积液(穿刺证实为血性),胸膜线与A-线消失。在积液内还可见纤维素变性沉着形成的条索状影。 |
肺不张系指一个或多个肺段或肺叶的容量或含气量减少,往往不是一个独立的疾病,而是其他疾病的并发症,是新生儿呼吸困难、病情迁延、撤机困难的常见原因。从病因与机制上可分为阻塞性肺不张和压迫性肺不张2种;根据肺不张的程度,有完全性肺不张和部分性肺不张之分。
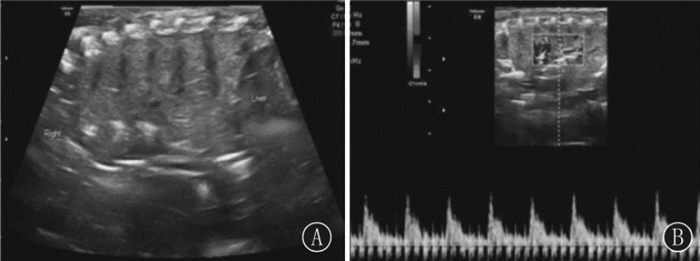
超声检查对肺不张有确切诊断价值,主要依据[26, 44-46]:(1)肺实变伴支气管充气征:严重者可见平行排列的支气管充气征或支气管充液征。(2)动态支气管充气征:严重或大面积肺不张早期,在实时超声下可见动态支气管充气征;当病程较久、发展至晚期时,动态支气管充气征常消失。(3)程度较重的大面积肺不张、实变区边缘多较为清晰、规则、锐利,如为小范围限局性肺不张,实变区边缘与周围肺组织可能界限不明显。(4)肺搏动与肺滑:在严重或大面积肺不张早期,在实时超声下常可见肺搏动,肺滑往往消失;但在小范围限局性肺不张,肺搏动常不明显,肺滑仍可存在。(5)实变区胸膜线异常及A-线消失,而非实变区仍可存在。(6)彩色多普勒超声于实变区可见肺血流(频谱),这是不张的肺组织能够恢复的生理基础;故当肺不张发展至晚期时,肺血流可消失(图 8~9)。

|
图 8 肺不张的超声表现 右肺不张患儿,肺脏超声显示右肺大面积实变伴支气管充气征,实变区边界相对清晰规则(左:探头与肋骨垂直扫描;右:探头与肋骨平行扫描)。 |
|
图 9 肺不张实变区血流频谱 A:B型超声显示肺不张;B:彩色多谱勒超声显示肺不张实变区良好的血供。 |
任何原因使胸膜破裂,致空气进入胸膜腔形成胸腔内积气时即称为气胸,气胸的形成多由于肺组织支气管破裂,空气进入胸膜腔;或因胸壁损伤穿破胸膜,胸膜腔与外界相通,外界空气进入所致。
超声诊断气胸准确可靠,主要依据[22, 26, 47-49]:(1)实时超声下肺滑消失:是超声诊断气胸最重要的征象,如存在可基本除外气胸。(2)存在胸膜线与A-线:如消失,可基本除外气胸。(3)无B-线:如存在,也可基本排除气胸。(4)明确存在的肺点:是轻-中度气胸的特异性征象,但在重度气胸时无肺点,故其诊断气胸的特异性为100%、敏感性约为70%。B型与M型超声均可发现该点,但M型超声更容易。(5)在M型超声下,气体所在部位呈平流层征(图 10~12)。

|
图 10 轻-中度气胸的超声表现 A:胸部X线检查证实为右侧气胸患儿。肺脏超声显示左肺呈肺间质综合征改变;右肺上野可见B-线,下野可见胸膜线与A-线(但未见B-线);右肺上野B-线与下野胸膜线和A-线的过度点为肺点,是为轻-中度气胸的特异性征像。实时超声下B-线处肺滑存在,而A-线处肺滑消失。B:肺脏超声显示双肺野实变伴支气管充气征,右肺下野可见胸膜线与A-线,但未见B-线;上肺野实变与下肺野胸膜线和A-线的过度点为肺点,是为轻-中度气胸的特异性征像。实时超声可见实变处肺滑仍存在,而A-线存在处肺滑消失。 |

|
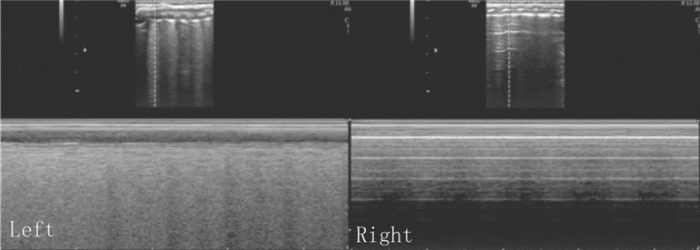
图 11 重度气胸的超声表现(B型) X-线证实左侧重度气胸。肺脏超声显示左肺胸膜线和A-线清晰存在,未见B-线和肺点;右肺呈肺间质综合征改变。实时超声下左肺肺滑消失,右肺肺滑存在。 |
|
图 12 重度气胸的超声表现(M型) B型超声:左肺呈肺间质综合征改变,右肺胸膜线与A-线存在,未见B-线;M型超声:左肺呈沙滩征,右肺呈平流层征;实时超声:左肺肺滑存在、右肺肺滑消失。 |
对临床怀疑气胸者,可采取如下诊断步骤:(1)首先观察胸膜线与A-线,如不存在,除外气胸。(2)如胸膜线与A线存在,实时超声下观察肺滑,如存在,除外气胸。(3)如胸膜线与A线存在而肺滑消失,进一步观察B-线,如存在,除外气胸;如不存在,可确诊气胸。(4)在上述基础上观察肺点,如存在,则为轻-中度气胸;如不存在,则可能为重度气胸。(5)通常情况下,B型超声就能够对气胸作出明确诊断,必要时可行M型超声进一步确认,如呈沙滩征,除外气胸;如呈平流层征或发现肺点,则可确诊气胸(图 13)。
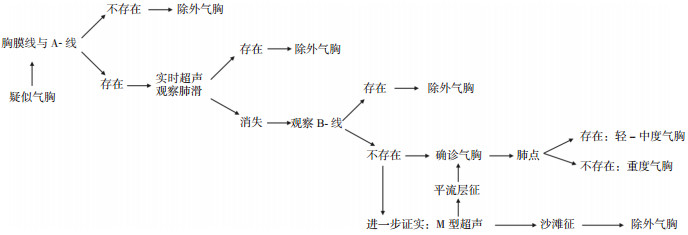
|
图 13 气胸诊断流程图 |
(1)检查者应对超声成像基本原理有一定掌握和了解。(2)至少需要接受8~12周以上的专门培训,诊断气胸可能需要接受6个月以上甚至更长时间培训。(3)与纵向扫查法相比,横向扫查更易于发现局限于一个肋间隙的胸膜下小范围肺实变;而从内向外、从上至下逐一肋间的横向扫查也更有助于发现气胸时的肺点征象。(4)当病变主要累及肺下叶和膈面时,也可借助肝脏为透声窗进行扫查,对以实变为主的肺脏疾病有一定意义。(5)严格按照仪器的操作规程进行操作。(6)尽量减少对新生儿的不良刺激,高危、重症及正在接受呼吸机治疗的患儿需有助手协助看护患儿。(7)宜在患儿安静时检查,但除非有医疗指征,不宜使用镇静剂。(8)注意保暖,并预热耦合剂。(9)注意消毒隔离:操作者应先洗手,注意清洁消毒探头(最简单的办法是使用专用消毒卫生湿巾),以避免交叉感染。(10)在实际工作中,新生儿肺部超声检查不必拘泥于固定程序,可根据婴儿当时所处的体位,从最方便的部位开始扫查。由于从背部扫查更便于操作,又避开了心脏和大血管的干扰,而且从背部扫查即可发现大多数肺部病变。因此,更习惯于首先从背部扫查;但对高度怀疑肺部病变、而经背部扫查又没有发现异常时,应将探头移至其他部位进一步仔细扫查。(11)本指南也可供开展儿童和成人肺脏超声时参考。(12)肺脏超声的局限性:需在获得一定经验和对肺脏超声有充分认识后才可开展工作;皮下气肿可对检查造成一定影响;对肺气肿、纵隔气肿和支气管肺发育不良等疾病的诊断尚具有不确定性;扫查不仔细时可能会遗漏一些轻症病例等。
(刘敬 冯星 胡才宝 邱如新 执笔)
参与讨论制定专家:刘敬(北京市朝阳区妇幼保健院新生儿科);冯星(苏州大学附属儿童医院新生儿科);胡才宝(浙江医院重症医学科);邱如新(北京市朝阳区妇幼保健院新生儿科);金梅(成都市妇女儿童中心医院超声科);陈文娟(湖南省儿童医院超声科);程国强(复旦大学附属儿科医院新生儿科);鲁正荣(成都市妇女儿童中心医院呼吸科);程秀永(郑州大学第一附属医院新生儿科);王晓曼(首都医科大学附属北京儿童医院超声科);曹海英(通用电气医疗超声临床教育部);刘百灵(西安市儿童医院超声科);陈平洋(中南大学湘雅二医院新生儿科);贾立群(首都医科大学附属北京儿童医院超声科);闫媛媛(郑州大学附属郑州中心医院超声科);郭九叶(北京市朝阳区妇幼保健院新生儿科);李建华(《中华实用儿科临床杂志》编辑部);王家勤(新乡医学院第三附属医院儿科/儿童康复科);邓碧滢(广东医科大学附属东莞儿童医院新生儿科);耿珊珊(北京市朝阳区妇幼保健院新生儿科);司姝宇(吉林大学白求恩第一医院新生儿超声科);王琳(华中科技大学同济医学院附属协和医院新生儿科);高月乔(北京市朝阳区妇幼保健院新生儿科);巨容(成都市妇女儿童中心医院新生儿科);李建军(北京市朝阳区妇幼保健院新生儿科);陈水文(暨南大学附属深圳市宝安区妇幼保健院儿科);张兰(中国科学技术大学附属第一医院新生儿科);崔立刚(北京大学第三医院超声科);郭凤梅(东南大学附属中大医院重症医学科);尚莉莉(黑龙江中医药大学附属第二医院重症医学科);Dalibor Kurepa(Division of Neonatal-Perinatal Medicine, Cohen Children' s Medical Center, USA);Erich Sorantin(the Division of Pediatric Radiology, Graz Medical University, Austria);Jovan Lovrenski(Radiology Department, Institute for Children and Adolescents Health Care of Vojvodina, Serbia)。
| [1] |
Cattarossi L, Copetti R, Poskurica B. Radiation exposure early in life can be reduced by lung ultrasound[J]. Chest, 2011, 139(3): 730-731. DOI:10.1378/chest.10-2338 (  0) 0) |
| [2] |
Volpicelli G, Elbarbary M, Blaivas M, et al. International evidence-based recommendations for point-of-care lung ultrasound[J]. Intensive Care Med, 2012, 38(4): 577-591. (  0) 0) |
| [3] |
Lichtenstein DA. Lung ultrasound in the critically ill[J]. Ann Intensive Care, 2014, 4(1): 315-322. (  0) 0) |
| [4] |
Hiles M, Culpan AM, Watts C, et al. Neonatal respiratory distress syndrome:chest X-ray or lung ultrasound -a systematic review[J]. Ultrasound, 2017, 25(2): 80-91. DOI:10.1177/1742271X16689374 (  0) 0) |
| [5] |
胡才宝, Lichtenstein DA.重症肺部超声的过去、现在与未来[J/CD].中华诊断学电子杂志, 2018, 6(2): 77-79.
(  0) 0) |
| [6] |
刘敬. 新生儿监护病房内开展肺脏超声的可行性与必要性[J]. 中华围产医学杂志, 2013, 16(10): 582-584. DOI:10.3760/cma.j.issn.1007-9408.2013.10.002 (  0) 0) |
| [7] |
Liu J, Cao HY, Wang XL, et al. The significance and the necessity of routinely performing lung ultrasound in the neonatal intensive care units[J]. J Matern Fetal Neonatal Med, 2016, 29(24): 4025-4030. DOI:10.3109/14767058.2016.1152577 (  0) 0) |
| [8] |
Chen SW, Fu W, Liu J, et al. Routine application of lung ultrasonography in the neonatal intensive care unit[J]. Medicine, 2017, 96(2): e5826. (  0) 0) |
| [9] |
刘敬, 曹海英, 程秀永. 新生儿肺脏疾病超声诊断学[M]. 郑州: 河南科学技术出版社, 2013: 21-22.
(  0) 0) |
| [10] |
Chen SW, Zhang MY, Liu J. Application of lung ultrasonography in the diagnosis of childhood lung diseases[J]. Chin Med J, 2015, 128(19): 2672-2678. DOI:10.4103/0366-6999.166035 (  0) 0) |
| [11] |
Xirouchaki N, Georgopoulos D. The use of lung ultrasound:a brief review for critical care physicians and pneumonologists[J]. Pneumon, 2007, 2(20): 134-141. (  0) 0) |
| [12] |
Lichtenstein DA, Mauriat P. Lung ultrasound in the critically ill neonate[J]. Curr Pediatr Rev, 2012, 8(3): 217-223. DOI:10.2174/157339612802139389 (  0) 0) |
| [13] |
Lichtenstein DA, Menu Y. A bedside ultrasound sign ruling out pneumothorax in the critically ill. Lung sliding[J]. Chest, 1995, 108(5): 1345-1348. DOI:10.1378/chest.108.5.1345 (  0) 0) |
| [14] |
Piette E, Daoust R, Denault A. Basic concepts in the use of thoracic and lung ultrasound[J]. Curr Opin Anaesthesiol, 2013, 26(1): 20-30. DOI:10.1097/ACO.0b013e32835afd40 (  0) 0) |
| [15] |
Volpicelli G, Caramello V, Cardinale L, et al. Detection of sonographic B-lines in patients with normal lung or radiographic alveolar consolidation[J]. Med Sci Monit, 2008, 14(3): CR122-CR128. (  0) 0) |
| [16] |
Dietrich CF, Mathis G, Blaivas M, et al. Lung B-line artefacts and their use[J]. J Thorac Dis, 2016, 8(6): 1356-1365. DOI:10.21037/jtd (  0) 0) |
| [17] |
Lichtenstein D, Mézière G, Biderman P, et al. The comet-tail artifact. An ultrasound sign of alveolar-interstitial syndrome[J]. Am J Respir Crit Care Med, 1997, 156(5): 1640-1646. DOI:10.1164/ajrccm.156.5.96-07096 (  0) 0) |
| [18] |
Copetti R, Cattarossi L, Macagno F, et al. Lung ultrasound in respiratory distress syndrome:a useful tool for early diagnosis[J]. Neonatology, 2008, 94(1): 52-59. DOI:10.1159/000113059 (  0) 0) |
| [19] |
Lichtenstein DA, LascolsN, Mezière G, et al. Ultrasound diagnosis of alveolar consolidation in the critically ill[J]. Intensive Care Med, 2004, 30(2): 276-281. (  0) 0) |
| [20] |
Lichtenstein DA, Lascols N, Prin S, et al. The "lung pulse":an early ultrasound sign of complete atelectasis[J]. Intensive Care Med, 2003, 29(12): 2187-2192. DOI:10.1007/s00134-003-1930-9 (  0) 0) |
| [21] |
Lichtenstein D, Mezière G, Biderman P, et al. The "lung point":an ultrasound sign specific to pneumothorax[J]. Intensive Care Med, 2000, 26(10): 1434-1440. DOI:10.1007/s001340000627 (  0) 0) |
| [22] |
Touw HR, Tuinman PR, Gelissen HP, et al. Lung ultrasound:routine practice for the next generation of internists[J]. Neth J Med, 2015, 73(3): 100-107. (  0) 0) |
| [23] |
Copetti R, Cattarossi L. The "double lung point":an ultrasound sign diagnostic of transient tachypnea of the newborn[J]. Neonatology, 2007, 91(3): 203-209. DOI:10.1159/000097454 (  0) 0) |
| [24] |
Lichtenstein DA, Mezière G, Lascols N, et al. Ultrasound diagnosis of occult pneumothorax[J]. Crit Care Med, 2005, 33(6): 1231-1238. DOI:10.1097/01.CCM.0000164542.86954.B4 (  0) 0) |
| [25] |
刘敬, 曹海英. 新生儿肺部疾病的超声诊断[J]. 中华围产医学杂志, 2012, 15(12): 753-756. DOI:10.3760/cma.j.issn.1007-9408.2012.12.010 (  0) 0) |
| [26] |
Kurepa D, Zaghloul N, Watkins L, et al. Neonatal lung ultrasound exam guidelines[J]. J Perinatol, 2018, 38(1): 11-22. DOI:10.1038/jp.2017.140 (  0) 0) |
| [27] |
Lovrenski J. Lung ultrasonography of pulmonary complications in preterm infants with respiratory distress syndrome[J]. Ups J Med Sci, 2012, 117(1): 10-17. DOI:10.3109/03009734.2011.643510 (  0) 0) |
| [28] |
Liu J, Cao HY, Wang HW, et al. The role of lung ultrasound in diagnosis of respiratory distress syndrome in newborn infants[J]. Iran J Pediatr, 2014, 24(2): 147-154. (  0) 0) |
| [29] |
刘敬. 肺脏超声诊断新生儿呼吸窘迫综合征[J]. 中华实用儿科临床杂志, 2014, 29(18): 1438-1440. DOI:10.3760/j.issn.2095-428X.2014.18.023 (  0) 0) |
| [30] |
Vergine M, Copetti R, Brusa G, et al. Lung ultrasound accuracy in respiratory distress syndrome and transient tachypnea of the newborn[J]. Neonatology, 2014, 106(2): 87-93. DOI:10.1159/000358227 (  0) 0) |
| [31] |
Liu J, Wang Y, Fu W, et al. Diagnosis of neonatal transient tachypnea and its differentiation from respiratory distress syndrome using lung ultrasound[J]. Medicine, 2014, 93(27): e197. DOI:10.1097/MD.0000000000000197 (  0) 0) |
| [32] |
Liu J, Chen XX, Li XW, et al. Lung ultrasonography to diagnose transient tachypnea of the newborn[J]. Chest, 2016, 149(5): 1269-1275. DOI:10.1016/j.chest.2015.12.024 (  0) 0) |
| [33] |
刘敬. 肺脏超声对新生儿呼吸窘迫综合征与暂时性呼吸增快征的诊断与鉴别[J]. 中华实用儿科临床杂志, 2016, 31(14): 1046-1048. DOI:10.3760/cma.j.issn.2095-428X.2016.14.002 (  0) 0) |
| [34] |
Ibrahim M, Omran A, Ibrahim M, et al. Lung ultrasound in early diagnosis of neonatal ventilator associated pneumonia before any radiographic or laboratory changes[J]. Case Rep Pediatr, 2016, 2016: 4168592. (  0) 0) |
| [35] |
Liu J, Liu F, Liu Y, et al. Lung ultrasonography for the diagnosis of severe neonatal pneumonia[J]. Chest, 2014, 146(2): 383-388. DOI:10.1378/chest.13-2852 (  0) 0) |
| [36] |
Mongodi S, Via G, Girard M, et al. Lung ultrasound for early diagnosis of ventilator-associated pneumonia[J]. Chest, 2016, 149(4): 969-980. DOI:10.1016/j.chest.2015.12.012 (  0) 0) |
| [37] |
周梦洁, 陈文娟, 彭颖慧, 等. 新生儿重症肺炎合并呼吸衰竭肺超声特点分析[J]. 中国新生儿科杂志, 2016, 31(5): 367-369. DOI:10.3969/j.issn.1673-6710.2016.05.012 (  0) 0) |
| [38] |
刘芳, 岳瑾琢, 刘百灵, 等.肺部超声诊断新生儿肺炎的临床应用[J/CD].中华医学超声杂志(电子版), 2016, 13(12): 898-903.
(  0) 0) |
| [39] |
肖甜甜, 金梅, 巨容, 等. 床旁肺部超声在新生儿肺炎中的诊断价值[J]. 中国当代儿科杂志, 2018, 20(6): 444-448. (  0) 0) |
| [40] |
Piastra M, Yousef N, Brat R, et al. Lung ultrasound findings in meconium aspiration syndrome[J]. Early Hum Dev, 2014, 90(Suppl 2): S41-S43. (  0) 0) |
| [41] |
Liu J, Cao HY, Fu W. Lung ultrasonography to diagnose meconium aspiration syndrome of the newborn[J]. J Int Med Res, 2016, 44(6): 1534-1542. DOI:10.1177/0300060516663954 (  0) 0) |
| [42] |
刘敬, 付薇, 陈水文, 等. 新生儿肺出血的超声诊断[J]. 中华儿科杂志, 2017, 55(1): 46-49. DOI:10.3760/cma.j.issn.0578-1310.2017.01.009 (  0) 0) |
| [43] |
Ren XL, Fu W, Liu J, et al. Lung ultrasonography to diagnose pulmonary hemorrhage of the newborn[J]. J Matern Fetal Neonatal Med, 2017, 30(21): 2601-2606. DOI:10.1080/14767058.2016.1256997 (  0) 0) |
| [44] |
刘敬, 刘颖, 王华伟, 等. 肺脏超声对新生儿肺不张的诊断价值[J]. 中华儿科杂志, 2013, 51(9): 644-648. DOI:10.3760/cma.j.issn.0578-1310.2013.09.002 (  0) 0) |
| [45] |
Liu J, Chen SW, Liu F, et al. The diagnosis of neonatal pulmonary atelectasis using lung ultrasonography[J]. Chest, 2015, 147(4): 1013-1019. DOI:10.1378/chest.14-1306 (  0) 0) |
| [46] |
Lichtenstein D, Mezière G, Seitz J. The dynamic air bronchogram. A lung ultrasound sign of alveolar consolidation ruling out atelectasis[J]. Chest, 2009, 135(6): 1421-1425. DOI:10.1378/chest.08-2281 (  0) 0) |
| [47] |
Raimondi F, Rodriguez Fanjul J, Aversa S, et al. Lung ultrasound for diagnosing pneumothorax in the critically ill neonate[J]. J Pediatr, 2016, 175: 74-78. DOI:10.1016/j.jpeds.2016.04.018 (  0) 0) |
| [48] |
Cattarossi L, Copetti R, Brusa G, et al. Lung ultrasound diagnostic accuracy in neonatal pneumothorax[J]. Can Respir J, 2016, 2016: 6515069. (  0) 0) |
| [49] |
Liu J, Chi JH, Ren XL, et al. Lung ultrasonography to diagnose pneumothorax of the newborn[J]. Am J Emerg Med, 2017, 35(9): 1298-1302. DOI:10.1016/j.ajem.2017.04.001 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


