新生儿败血症是由于致病菌侵入循环系统后大量繁殖并不断分泌毒素导致的全身感染性疾病,发病隐匿,临床症状不典型,是导致新生儿死亡的主要原因。2015年世界卫生组织对194个国家进行调查,发现在280万新生儿死亡病例中,败血症和其他严重感染占43万,仅次于早产和分娩期并发症,而且在晚发期(出生72 h以后)位居致死原因之首[1]。高迁移率族蛋白1(high mobility group box 1, HMGB1)是广泛存在于免疫细胞、内皮细胞、上皮细胞等一系列细胞中的DNA结合蛋白,参与调节基因的复制、转录等生物学功能,但是在感染、创伤、烧伤等外界刺激下,HMGB1可发生乙酰化从细胞核转移至胞浆,然后释放至血液循环中,通过活化单核巨噬细胞、中性粒细胞等并大量释放炎症因子,从而在一系列疾病中发挥重要的病理作用,包括感染性肺炎、感染性腹泻、化脓性脑膜炎等[2-5]。研究发现,HMGB1也参与败血症的病理进展,如Yu等[6]发现败血症死亡者的HMGB1水平显著高于幸存者,阻断HMGB1介导的内皮高通透性、炎症细胞迁移和促炎因子的释放可以降低内毒素诱导的组织损伤和高病死率[7-9]。何静雅等[10]发现胎膜早破新生儿血清中HMGB1的含量显著高于无胎膜早破新生儿,其中胎膜早破新生儿组包括新生儿败血症、新生儿肺炎、呼吸窘迫综合征等患儿,但是未对不同感染程度的患儿进行HMGB1表达的分析,而且HMGB1在新生儿败血症中的作用机制以及阻断HMGB1能否缓解新生儿败血症的病理进展尚无报道,因此本文选取新生儿败血症患儿作为研究对象,观察HMGB1的表达状况,并分离新生儿的外周血单个核细胞以研究HMGB1的作用机制,并使用药物阻断HMGB1以观察相关生物学效应。
1 资料与方法 1.1 一般资料选取2016年5月至2018年1月收治的62例新生儿败血症患儿作为败血症组,选取66例局部感染新生儿和70例健康新生儿分别作为局部感染组和健康对照组。败血症组患儿中,男39例,女23例,胎龄39.0±1.6周,体重3 327±658 g;局部感染组患儿中,男35例,女31例,胎龄39.1±1.3周,体重3 371±644 g;健康对照组新生儿中,男40例,女30例,胎龄39.4±1.5周,体重3 425±680 g。各组新生儿在性别、胎龄、体重方面比较差异无统计学意义(P > 0.05),具有可比性。收集各组新生儿的一般临床资料进行比较分析。本研究已获伦理委员会批准及所有入选患儿家属的知情同意。
1.2 纳入标准与排除标准纳入标准:(1)足月新生儿:出生时胎龄37~42周,体重≥2 500 g,出生28 d以内的婴儿;(2)根据2003年中华医学会儿科学分会制定的《新生儿败血症诊疗方案》[11]诊断新生儿败血症:出现发热或低体温、少吃、少哭、少动、面色欠佳、四肢凉、体重不增、黄疸、休克等临床表现,血培养或无菌体腔内培养出条件致病菌;(3)根据《实用新生儿学》第4版诊断局部感染性疾病,包括感染性肺炎、感染性腹泻、化脓性脑膜炎、皮肤感染等。排除标准:(1)入院前经抗感染治疗;(2)合并肝肾功能障碍、先天性畸形、心脑血管疾病、自身免疫性疾病等。
1.3 酶联免疫吸附试验所有新生儿于抗感染治疗前采集2 mL静脉血,室温静置10 min,12 000 r/min离心10 min后取上清液。使用ELISA试剂盒(江苏晶美生物科技有限公司)测定血清中IL-6(JM-03204H1)、IL-8(JM-04713H1)、IL-17(JM-05071H1)、IL-23(JM-03351H2)、C反应蛋白(CRP,JM-03290H2)、降钙素原(PCT,JM-03972H2)的含量。
1.4 人外周血单个核细胞的分离在每组新生儿中分别随机选取20例,于抗感染治疗前采集5 mL EDTA抗凝血,使用Ficoll密度梯度离心法分离人外周血单个核细胞,主要步骤为:使用5 mL PBS稀释等体积的抗凝血,将稀释后的血液缓缓平铺于10 mL人外周血单个核细胞分离液上方(北京索莱宝科技有限公司,P8900),1 000 r/min室温离心30 min,可观察到溶液分为4层,从上至下依次为淡黄色的血浆层、透明的分离液层、乳白色的单个核细胞层及红细胞层,小心吸取单个核细胞至无菌的离心管,PBS洗涤2次后,即得到人外周血单个核细胞。使用实时荧光定量聚合酶链式反应(qRT-PCR)检测各组新生儿外周血单个核细胞中HMGB1、Toll样受体4(TLR4)和核转录因子κB(NF-κB)mRNA的表达,使用Western blot检测各组新生儿外周血单个核细胞中TLR4和NF-κB蛋白的表达。
1.5 细胞培养与分组Ficoll密度梯度离心法分离健康新生儿的外周血单个核细胞,使用含10%胎牛血清的RPMI 1640培养基(美国Gibco公司)进行培养。将对数生长期的细胞分为对照组、HMGB1处理组、HMGB1+TAK-242组、HMGB1+PDTC组。HMGB1处理组细胞添加终浓度为10 ng/mL的HMGB1(美国Sigma公司,H4652),HMGB1+TAK-242组细胞添加10 ng/mL HMGB1和40 nmol/L TLR4抑制剂TAK-242(美国MCE公司,HY11109),HMGB1+PDTC组细胞添加10 ng/mL HMGB1和50 μmol/LNF-κB抑制剂PDTC(美国MCE公司,HY18738),对照组细胞添加等体积的培养基。细胞培养24 h后,采用qRT-PCR检测TLR4、NF-κB和IL-8 mRNA的表达,采用Western blot检测TLR4和NF-κB蛋白的表达。实验独立重复3次。
另将外周血单个核细胞分为对照组、LPS处理组、LPS+甘草甜素组。LPS处理组细胞添加终浓度为100 μg/L的LPS(美国Gibco公司,L2880),LPS+甘草甜素组细胞添加100 μg/L的LPS和1 mmol/L的甘草甜素(美国Gibco公司,PHR1516),对照组细胞添加等体积的培养基。细胞培养24 h后,采用qRT-PCR检测HMGB1、TLR4、NF-κB和IL-8 mRNA的表达,采用Western blot检测TLR4和NF-κB蛋白的表达。实验独立重复3次。
1.6 qRT-PCR法检测HMGB1、TLR4、NF-κB及IL-8 mRNA的表达使用哈佛大学Primer Bank数据库查找基因的引物序列,通过NCBI的Primer Blast和Primer 5.0软件验证序列,最后由上海生工生物工程有限公司合成(表 1)。使用TRIzol(美国Invitrogen公司,15596026)提取细胞中的mRNA,Prime Script RT reagent Kit逆转录试剂盒(日本Takara公司,RR037A)将mRNA逆转录为cDNA,SYBR Premix Ex Taq II荧光定量试剂盒(日本Takara公司,RR820A)进行PCR扩增。PCR反应体系共20 μL,包括cDNA 8 μL,10×PCR预混液10 μL,上下游引物各1 μL。PCR反应条件:95℃预变性10 min;95℃变性10 s,58℃退火30 s,72℃延伸30 s,共循环40次。取5 μL的反应产物,加入1 μL的6×上样缓冲液混匀,使用1%的琼脂糖凝胶进行电泳,结束后成像仪下曝光和拍照。结果以目的基因与GAPDH的灰度值之比表示,将对照组目的基因的相对表达量设置为1。
| 表 1 引物序列 |
|
|
取106个细胞加入100 μL细胞裂解液,充分裂解后12 000 r/min离心5 min,取上清液进行BCA蛋白定量。取40 μg总蛋白,加入SDS-PAGE蛋白上样缓冲液,100℃加热5 min。使用10%的分离胶进行电泳,将目的蛋白电转膜至聚偏二氟乙烯膜,5%的牛血清白蛋白封闭1 h,使用英国Abcam公司生产的兔抗人TLR4多克隆抗体(1 : 500)、兔抗人NF-κB单克隆抗体(1 : 1 000)和兔抗人GAPDH单克隆抗体(1 : 5 000)4℃孵育过夜。洗涤3次,使用辣根过氧化物酶标记的山羊抗兔多克隆抗体(武汉博士德生物工程有限公司,1 : 1 000)室温孵育1 h,洗涤3次,DAB显色液显色后成像仪下曝光和拍照。结果以目的蛋白与GAPDH的灰度值之比表示,将对照组中目的蛋白与GAPDH的灰度值之比设置为1。
1.8 统计学分析使用SPSS 20.0统计软件对数据进行统计学分析。符合正态分布的计量资料以均数±标准差(x±s)表示,多组计量资料间的比较采用单因素方差分析,组间两两比较采用SNK-q检验。P < 0.05为差异有统计学意义。
2 结果 2.1 各组新生儿的一般临床资料纳入的62例败血症患儿中,血培养共分离得到62株病原菌,均为单一菌株感染,其中革兰阴性菌43例,以肺炎克雷伯菌(29例)和大肠埃希菌(5例)为主;革兰阳性菌18例,以表皮葡萄球菌(6例)和金黄色葡萄球菌(5例)为主;真菌1例,为热带假丝酵母菌。纳入的66例局部感染组患儿,血培养共分离得到66株病原菌,均为单一菌株感染,包括感染性肺炎39例,以肺炎克雷伯菌(15例)、大肠埃希菌(8例)和金黄色葡萄球菌(5例)为主;感染性腹泻11例,以诺如病毒(3例)、致泻性大肠埃希菌(3例)和轮状病毒(2例)为主;化脓性脑膜炎8例,以表皮葡萄球菌(4例)和大肠埃希菌(2例)为主;皮肤感染8例,以金黄色葡萄球菌(4例)为主。
2.2 各组新生儿血清炎症因子水平变化败血症组患儿血清中IL-6、IL-8、IL-17、IL-23、CRP、PCT水平均显著高于局部感染组和健康对照组(P < 0.05);局部感染组患儿血清中上述指标水平均显著高于健康对照组(P < 0.05)。见表 2。
| 表 2 各组新生儿血清炎症因子水平比较(x±s) |
|
|
败血症组患儿外周血单个核细胞中HMGB1 mRNA,以及TLR4、NF-κB mRNA及其蛋白的相对表达量均显著高于局部感染组和健康对照组(P < 0.05);局部感染组患儿外周血单个核细胞中HMGB1 mRNA,以及TLR4、NF-κB mRNA及其蛋白的相对表达量均显著高于健康对照组(P < 0.05)。见图 1~2。
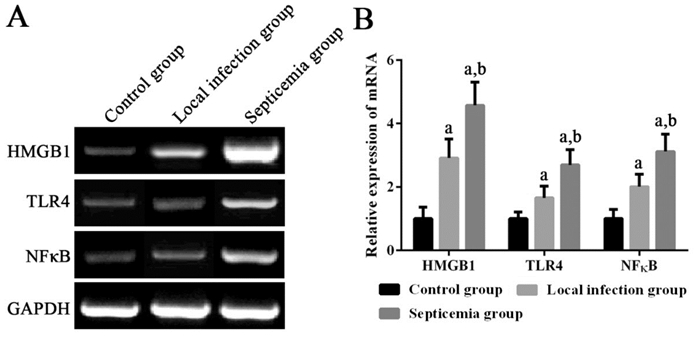
|
图 1 各组新生儿外周血单个核细胞中HMGB1、TLR4及NF-κB mRNA表达变化 左图为电泳图。右图为统计图(n=20),a示与健康对照组比较,P < 0.05;b示与局部感染组比较,P < 0.05。 |
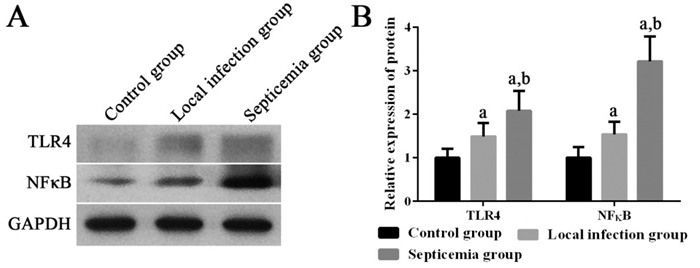
|
图 2 各组新生儿外周血单个核细胞中TLR4和NF-κB蛋白表达变化 左图为电泳图。右图为统计图(n=20),a示与健康对照组比较,P < 0.05;b示与局部感染组比较,P < 0.05。 |
HMGB1可以显著诱导外周血单个核细胞高表达TLR4、NF-κB mRNA及其蛋白(P < 0.05);使用TLR4抑制剂TAK-242可以抑制TLR4、NF-κB mRNA及其蛋白的高表达,并进而抑制IL-8 mRNA的表达(P < 0.05);使用NF-κB抑制剂PDTC可以抑制NF-κB mRNA及其蛋白的高表达,并进而抑制IL-8 mRNA的表达(P < 0.05)。见图 3~4。
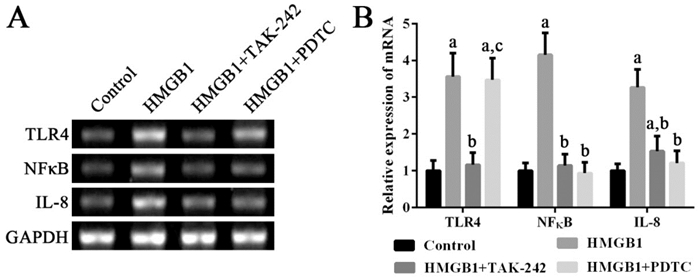
|
图 3 各组细胞中TLR4、NF-κB和IL-8 mRNA表达变化 左图为电泳图。右图为统计图(n=3),a示与对照组比较,P < 0.05;b示与HMGB1组比较,P < 0.05;c示与HMGB1+TAK-242组比较,P < 0.05。 |
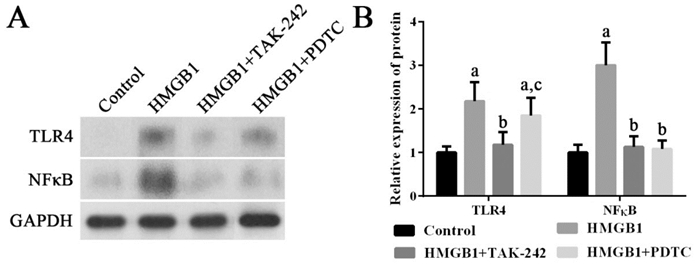
|
图 4 各组细胞中TLR4和NF-κB蛋白表达变化 左图为电泳图。右图为统计图(n=3),a示与对照组比较,P < 0.05;b示与HMGB1组比较,P < 0.05;c示与HMGB1+TAK-242组比较,P < 0.05。 |
LPS可以显著诱导HMGB1 mRNA的表达,诱导TLR4、NF-κB mRNA及其蛋白的表达,进而刺激IL-8 mRNA的表达(P < 0.05);使用HMGB1抑制剂甘草甜素可以抑制HMGB1 mRNA的高表达,抑制TLR4、NF-κB mRNA及其蛋白的高表达,进而降低IL-8 mRNA的高表达(P < 0.05)。见图 5~6。

|
图 5 各组细胞中HMGB1、TLR4、NF-κB及IL-8 mRNA的表达变化 左图为电泳图。右图为统计图(n=3),a示与健康对照组比较,P < 0.05;b示与LPS组比较,P < 0.05。 |
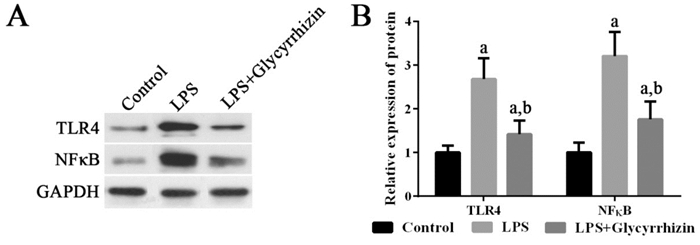
|
图 6 各组细胞中TLR4及NF-κB蛋白的表达变化 左图为电泳图。右图为统计图(n=3),a示与健康对照组比较,P < 0.05;b示与LPS组比较,P < 0.05。 |
败血症以严重的感染诱导炎症因子大量释放为主要临床表现,包括IL-6、IL-8、IL-17、IL-23、CRP、PCT等。使用药物抑制炎症细胞的信号通路活化和促炎因子释放可以显著缓解败血症诱导的组织损伤,改善患者的临床症状[12]。因此,本文首先对新生儿败血症患儿的炎症因子表达进行了检测,结果显示败血症组患儿血清中IL-6、IL-8、IL-17、IL-23、CRP、PCT的含量均显著高于局部感染组和健康对照组,表明新生儿败血症具有高炎症状态,间接表明了临床症状的严重性。
大量研究发现,释放至血液循环中的HMGB1具有明显的促炎效应[13-14],如Scaffidi等[15]发现HMGB1可由活化的单核巨噬细胞分泌或者坏死细胞被动释放,然后通过与高级糖基化终末产物受体结合促进炎症,而HMGB1敲除的细胞促发炎症的能力显著减弱。为了研究新生儿败血症高炎症状态的病理机制,本文对HMGB1在新生儿败血症中的表达进行检测,结果发现败血症组患儿外周血单个核细胞中HMGB1 mRNA的相对表达量显著高于局部感染组和健康对照组。
TLR4/NF-κB信号通路与HMGB1介导的促炎效应密切相关,参与心脏缺血再灌注损伤、哮喘、急性胰腺炎、类风湿性关节炎、系统性红斑狼疮等一系列疾病的病理机制[16-18],如Li等[19]发现HMGB1、TLR4和NF-κB在重症急性胰腺炎小鼠模型中高表达,使用重组HMGB1蛋白靶向注射至胰腺可活化TLR4/NF-κB信号通路,显著诱导胰腺的病理损伤,而对于TLR4敲除小鼠则可降低HMGB1的生物学效应。本研究结果也显示,败血症组患儿外周血单个核细胞中TLR4和NF-κB mRNA及其蛋白的相对表达量均显著高于局部感染组和健康对照组。为了更有效的验证TLR4/NF-κB信号通路在HMGB1介导炎症因子释放中的作用,本研究通过分离和培养新生儿外周血的单个核细胞进行机制研究,结果显示HMGB1可以显著诱导外周血单个核细胞高表达TLR4和NF-κB,然后促进IL-8的表达,分别使用TLR4抑制剂TAK-242和NF-κB抑制剂PDTC则可以显著抑制TLR4和NF-κB的高表达,并进而抑制IL-8的表达。综上所述,HMGB1可通过活化TLR4/NF-κB信号通路促进炎症因子的大量释放,是新生儿败血症发生发展的重要病理机制。
甘草甜素是一种具有抗炎和抗氧化功能的传统中草药,可与HMGB1直接结合,因此常用于HMGB1阻断的相关研究[20-21]。本文在LPS诱导的体外细胞模型中应用甘草甜素,结果显示甘草甜素可以抑制HMGB1 mRNA的高表达,抑制TLR4、NF-κB mRNA及其蛋白的高表达,进而降低IL-8 mRNA的高表达,表明HMGB1的药物阻断可以抑制TLR4/NF-κB信号通路活化,降低炎症因子表达,未来针对HMGB1的靶向治疗对于新生儿败血症可能具有一定的临床治疗价值。
尽管本文初步探讨了HMGB1在新生儿败血症中的表达与机制,但是仍然有许多问题亟待解决:(1)本文仅从HMGB1 mRNA的表达进行研究,对于HMGB1从外周血单个核细胞中释放在败血症中的作用尚不清楚;(2)本文通过分离新生儿外周血单个核细胞进行体外实验,但是体外细胞学实验存在稳定性差、重复率低的不足,未来仍需要通过构建相应的动物模型进行结论的验证;(3)甘草甜素可以阻断HMGB1的生物学效应,抑制炎症的级联放大,具有广阔的应用前景,但是能否应用到新生儿败血症的临床治疗中仍不清楚。
综上所述,HMGB1在新生儿败血症患儿的外周血单个核细胞中呈高表达,可能通过激活TLR4/NF-κB信号通路诱导IL-8等炎症因子的高分泌,HMGB1阻断剂甘草甜素可抑制LPS诱导的HMGB1/TLR4/NF-κB信号通路活化和炎症因子分泌。
| [1] |
Oza S, Lawn JE, Hogan DR, et al. Neonatal cause-of-death estimates for the early and late neonatal periods for 194 countries:2000-2013[J]. Bull World Health Organ, 2015, 93(1): 19-28. DOI:10.2471/BLT.14.139790 (  0) 0) |
| [2] |
Richard SA, Jiang Y, Xiang LH, et al. Post-translational modifications of high mobility group box 1 and cancer[J]. Am J Transl Res, 2017, 9(12): 5181-5196. (  0) 0) |
| [3] |
He SJ, Cheng J, Feng X, et al. The dual role and therapeutic potential of high-mobility group box 1 in cancer[J]. Oncotarget, 2017, 8(38): 64534-64550. (  0) 0) |
| [4] |
Dipasquale V, Cutrupi MC, Colavita L, et al. Neuroinflammation in autism spectrum disorders:role of high mobility group box 1 protein[J]. Int J Mol Cell Med, 2017, 6(3): 148-155. (  0) 0) |
| [5] |
Bianchi ME, Crippa MP, Manfredi AA, et al. High-mobility group box 1 protein orchestrates responses to tissue damage via inflammation, innate and adaptive immunity, and tissue repair[J]. Immunol Rev, 2017, 280(1): 74-82. (  0) 0) |
| [6] |
Yu H, Qi Z, Zhao L, et al. Prognostic value of dynamic monitoring of cellular immunity and HMGB1 in severe sepsis:delayed chronic inflammation may be the leading cause of death in late severe sepsis[J]. Clin Lab, 2016, 62(12): 2379-2385. (  0) 0) |
| [7] |
Lee W, Ku SK, Bae JS. Zingerone reduces HMGB1-mediated septic responses and improves survival in septic mice[J]. Toxicol Appl Pharmacol, 2017, 329: 202-211. DOI:10.1016/j.taap.2017.06.006 (  0) 0) |
| [8] |
Yang M, Cao L, Xie M, et al. Chloroquine inhibits HMGB1 inflammatory signaling and protects mice from lethal sepsis[J]. Biochem Pharmacol, 2013, 86(3): 410-418. DOI:10.1016/j.bcp.2013.05.013 (  0) 0) |
| [9] |
Wang H, Liao H, Ochani M, et al. Cholinergic agonists inhibit HMGB1 release and improve survival in experimental sepsis[J]. Nat Med, 2004, 10(11): 1216-1221. DOI:10.1038/nm1124 (  0) 0) |
| [10] |
何静雅, 章乐, 王晓蕾, 等. HMGB1在胎膜早破新生儿及孕妇外周血中表达及临床意义[J]. 江苏医药, 2015, 41(13): 1575-1576. (  0) 0) |
| [11] |
中华医学会儿科学分会新生儿学组, 《中华医学会中华儿科杂志》编辑委员会. 新生儿败血症诊疗方案[J]. 中华儿科杂志, 2003, 41(12): 897-899. DOI:10.3760/j.issn:0578-1310.2003.12.005 (  0) 0) |
| [12] |
Huang Y, Zhou M, Li C, et al. Picroside Ⅱ protects against sepsis via suppressing inflammation in mice[J]. Am J Transl Res, 2016, 8(12): 5519-5531. (  0) 0) |
| [13] |
Xu M, Zhou GM, Wang LH, et al. Inhibiting high-mobility group box 1(HMGB1) attenuates inflammatory cytokine expression and neurological deficit in ischemic brain injury following cardiac arrest in rats[J]. Inflammation, 2016, 39(4): 1594-1602. DOI:10.1007/s10753-016-0395-2 (  0) 0) |
| [14] |
Wang X, Guo Y, Wang C, et al. MicroRNA-142-3p inhibits chondrocyte apoptosis and inflammation in osteoarthritis by targeting HMGB1[J]. Inflammation, 2016, 39(5): 1718-1728. DOI:10.1007/s10753-016-0406-3 (  0) 0) |
| [15] |
Scaffidi P, Misteli T, Bianchi ME. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation[J]. Nature, 2002, 418(6894): 191-195. DOI:10.1038/nature00858 (  0) 0) |
| [16] |
Zhang H, Yang N, Wang T, et al. Vitamin D reduces inflammatory response in asthmatic mice through HMGB1/TLR4/NFkappaB signaling pathway[J]. Mol Med Rep, 2018, 17(2): 2915-2920. (  0) 0) |
| [17] |
Dong LY, Chen F, Xu M, et al. Quercetin attenuates myocardial ischemia-reperfusion injury via downregulation of the HMGB1-TLR4-NF-kappaB signaling pathway[J]. Am J Transl Res, 2018, 10(5): 1273-1283. (  0) 0) |
| [18] |
Li MJ, Li F, Xu J, et al. rhHMGB1 drives osteoblast migration in a TLR2/TLR4-and NF-kappaB-dependent manner[J]. Biosci Rep, 2016, 36(1): e00300. DOI:10.1042/BSR20150239 (  0) 0) |
| [19] |
Li G, Wu X, Yang L, et al. TLR4-mediated NF-kappaB signaling pathway mediates HMGB1-induced pancreatic injury in mice with severe acute pancreatitis[J]. Int J Mol Med, 2016, 37(1): 99-107. DOI:10.3892/ijmm.2015.2410 (  0) 0) |
| [20] |
Xiong X, Gu L, Wang Y, et al. Glycyrrhizin protects against focal cerebral ischemia via inhibition of T cell activity and HMGB1-mediated mechanisms[J]. J Neuroinflammation, 2016, 13(1): 241. DOI:10.1186/s12974-016-0705-5 (  0) 0) |
| [21] |
Ekanayaka SA, McClellan SA, Barrett RP, et al. Glycyrrhizin reduces HMGB1 and bacterial load in pseudomonas aeruginosa keratitis[J]. Invest Ophthalmol Vis Sci, 2016, 57(13): 5799-5809. DOI:10.1167/iovs.16-20103 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


